§ 4. Свойства и функции белков
Биология, 10 класс (Лисов, 2014)
[ Содержание ]
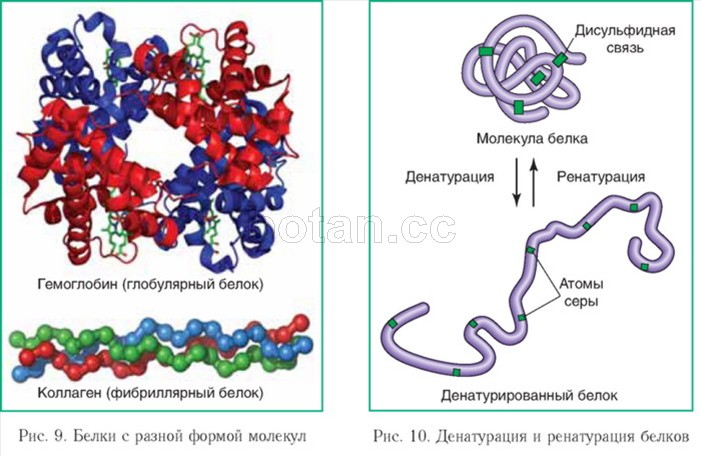
Многообразие и свойства белков. По форме молекул белки можно разделить на две группы. Молекулы глобулярных белков имеют округлую форму, фибриллярные белки характеризуются вытянутой, нитевидной формой молекул. Так, глобулярными белками являются глобулины и альбумины крови, фибриноген, гемоглобин. Фибриллярные белки — кератин, коллаген, миозин, эластин и др. (рис. 9).
Белки — преимущественно водорастворимые вещества, именно в водных растворах они проявляют свою функциональную активность. Белковые молекулы несут большой поверхностный заряд. Это сказывается на каталитической активности белков, на проницаемости биологических мембран (белки входят в их состав) и других функциях. Еще одной важной особенностью белков является то, что они проявляют свою активность лишь в узких температурных рамках и в определенном диапазоне кислотности среды.
Денатурация и ренатурация белков. Одно из основных свойств белков — способность изменять структуру и свойства под влиянием различных факторов (высокая температура, действие концентрированных кислот и щелочей, тяжелых металлов и др.). Процесс нарушения природной структуры белков под влиянием каких-либо факторов без разрушения первичной структуры называется денатурацией (от лат. де — приставка, означающая утрату, натура — природные свойства). Денатурация происходит вследствие разрыва водородных, ионных, дисульфидных и других связей, стабилизирующих пространственную структуру белковых молекул. При этом может утрачиваться их четвертичная, третичная и даже вторичная структура (рис. 10). Денатурация сопровождается потерей биологической активности белка. При этом наблюдается уменьшение его растворимости, изменение формы и размеров молекул. Так, соли тяжелых металлов при взаимодействии с белками образуют нерастворимые соединения, и белки выпадают в осадок.
Денатурация часто имеет необратимый характер. Однако в ряде случаев после непродолжительного воздействия повреждающего фактора белок может восстановить свое первоначальное состояние. Это явление называется ренатурацией (от лат. ре — приставка, означающая возобновление). Развернутая полипептид-ная цепь способна самопроизвольно закрутиться в спираль, а затем уложиться в третичную структуру. Это означает, что пространственная структура белка определяется его первичной структурой, т. е. последовательностью аминокислотных остатков.
Явление денатурации часто используется в биологических исследованиях и в медицине. При определении в биологическом материале низкомолекулярных соединений из раствора сначала удаляют белки. Для этого вызывают их денатурацию, затем осаждают или отфильтровывают.
В медицине денатурацию применяют для стерилизации инструментов и материалов (здесь денатурирующим агентом является высокая температура). Такие денатурирующие агенты, как этиловый спирт, фенол и хлорамин, используют в качестве антисептиков для дезинфекции загрязненных материалов и поверхностей. Аналогичные процессы происходят при обеззараживании ран, ссадин, царапин раствором йода или спиртом.
Функции белков. Большое разнообразие белков позволяет им выполнять в живом организме множество различных функций.
Структурная функция. Белки входят в состав всех клеток и тканей живых организмов. Белки являются обязательным компонентом всех клеточных мембран и органоидов клетки. Из белков построены элементы цитоскелета, сократительные элементы мышечных волокон. Преимущественно из белков состоят хрящи и сухожилия. В их состав входит белок коллаген. Важнейшим структурным компонентом перьев, волос, ногтей, когтей, рогов, копыт у животных является белок кератин. В состав связок, стенок артерий и лёгких входит структурный белок эластин.
Ферментативная (каталитическая) функция. Многие белки являются ферментами. Ферменты — это биологические катализаторы, т. е. вещества, ускоряющие протекание химических реакций в живых организмах. Ферменты участвуют в процессах синтеза и расщепления различных веществ. Они обеспечивают фиксацию углерода в процессе фотосинтеза, расщепление питательных веществ в пищеварительном тракте и т. д.
Практически все процессы жизнедеятельности, протекающие в организме, обусловлены ферментативными реакциями.
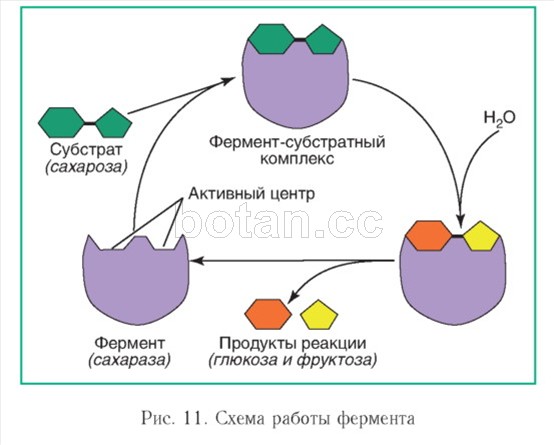
Ферменты ускоряют химические реакции за счет тесного взаимодействия с молекулами субстратов — исходных реагирующих веществ (рис. 11). С субстратом (или субстратами) взаимодействует не вся молекула фермента, а лишь небольшой ее участок — активный центр. Чаще всего он образован несколькими аминокислотными остатками. Форма и химическое строение активного центра таковы, что с ним могут связываться только определенные субстраты из-за соответствия их пространственных структур. Иными словами, субстрат по форме подходит к активному центру, как ключ к замку. Присоединение к активному центру приводит к тому, что молекулы субстрата определенным образом располагаются в пространстве и деформируются, в их структуре ослабляются определенные химические связи. Все это приводит к ускорению реакции.
На заключительном этапе химической реакции фермент-субстратный комплекс распадается с высвобо>вдением конечных продуктов и свободного фермента. Освободившийся активный центр может принимать новые молекулы субстрата.
Сходство ферментов с обычными химическими катализаторами проявляется в том, что и те и другие увеличивают скорость реакции, но при этом не расходуются и могут использоваться многократно.
В отличие от обычных химических катализаторов ферменты обладают специфичностью, т. е. каждый фермент ускоряет только одну определенную реакцию или действует только на определенный тип связи. Эта особенность объясняется соответствием активного центра фермента определенным субстратам. Ферменты работают гораздо быстрее (ускоряют реакции в миллионы и миллиарды раз, а неорганические катализаторы — в сотни и тысячи раз), поэтому даже в очень малых концентрациях обеспечивают интенсивное протекание катализируемых реакций.
Ферменты являются белками, поэтому активно работают лишь в определенном диапазоне pH, температуры и других факторов. Например, фермент желудочного сока пепсин активен только в кислой среде, а ферменты слюны амилаза и мальтаза — в слабощелочной. При повышении температуры все химические реакции ускоряются, а реакции, катализируемые ферментами, замедляются, а затем вовсе прекращаются. Повышение температуры, изменение кислотности среды и других факторов приводит к денатурации ферментов, в результате чего они теряют способность связываться со своими субстратами.
Некоторые ферменты, помимо активного центра, имеют один или несколько регуляторных центров. Как с активным, так и с регуляторным центрами могут связываться определенные вещества, влияющие на активность фермента. Вещества, повышающие скорость ферментативных реакций, называются активаторами (от лат. активус — деятельностный).
Вещества, снижающие или блокирующие активность ферментов, называются ингибиторами (от лат. ингибео — сдерживаю, останавливаю).
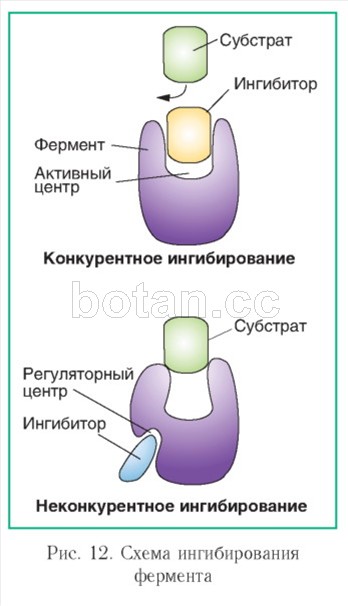
Различают несколько типов ингибирования, в частности, конкурентное и неконкурентное (рис.12).
Конкурентное ингибирование вызывается веществами, которые по структуре сходны с субстратом и способны связываться с активным центром фермента. При этом молекулы субстрата и ингибитора конкурируют за активный центр. Конкурентные ингибиторы нередко используются в качестве лекарственных средств (антибиотики, противоопухолевые препараты и др.).
Неконкурентные ингибиторы не имеют структурного сходства с субстратом и присоединяются не к активному центру, а к другим участкам фермента (в частности, к регуляторному центру).
Ферменты широко используются в пищевой промышленности (при производстве сыров, соков, овощных и фруктовых пюре, в хлебопечении, пивоварении, виноделии, для обработки мяса и т. д.). Их также применяют в сельском хозяйстве для получения кормов, в медицине для диагностики и лечения заболеваний, в текстильной и кожевенной промышленности для обработки тканей, кожи и меха, в производстве синтетических моющих средств и др.
Транспортная функция. Многие белки способны присоединять и переносить различные вещества. Гемоглобин связывает и переносит кислород и углекислый газ. Альбумины крови транспортируют жирные кислоты, глобулины — ионы металлов и гормоны. Многие белки, входящие в состав цитоплазматической мембраны, участвуют в транспорте веществ в клетку и из нее.
Сократительная (двигательная) функция. Сократительные белки обеспечивают способность клеток, тканей, органов и целых организмов изменять форму, двигаться. Так, актин и миозин обеспечивают работу мышц и немышечные внутриклеточные сокращения. Белок тубулин входит в состав микротрубочек веретена деления, ресничек и жгутиков эукариотических клеток.
Регуляторная функция. Некоторые пептиды и белки являются гормонами. Они влияют на различные физиологические процессы. Например, инсулин и глюкагон регулируют содержание глюкозы в крови, а соматотропин (гормон роста) — процессы роста и физического развития.
Сигнальная функция. Некоторые белки клеточных мембран способны изменять свою структуру в ответ на действие внешних факторов. С помощью этих белков происходит прием сигналов из внешней среды и передача информации в клетку. Примером может служить опсин — составная часть зрительного пигмента родопсина, содержащегося в клетках сетчатки глаза.
Защитная функция. Белки предохраняют организм от вторжения чужеродных организмов и от повреждений. Так, в ответ на проникновение чужеродных объектов (антигенов) определенные лейкоциты вырабатывают специфические белки — иммуноглобулины (антитела), участвующие в иммунном ответе организма. Белок интерферон защищает организм от вирусной инфекции. Фибриноген, тромбопластин и тромбин обеспечивают свертывание крови, предотвращая кровопотерю.
Токсическая функция. Многие живые организмы выделяют белки-токсины, которые являются ядами для других организмов. Токсины синтезируются в организме ряда животных, грибов, растений, микроорганизмов. В свою очередь, некоторые организмы способны вырабатывать антитоксины, которые подавляют действие этих ядов.
Энергетическая функция. После расщепления до аминокислот белки могут служить источником энергии в клетке. При полном окислении 1 г белка выделяется 17,6кДж энергии. Однако белки расходуются на энергетические нужды лишь в крайних случаях, когда исчерпаны запасы углеводов и жиров.
Запасающая функция. В семенах растений запасаются резервные белки, которые используются при прорастании зародышем, а затем и проростком как источник азота.
1. Как называется процесс нарушения природной структуры белка, при котором сохраняется его первичная структура? Действие каких факторов может приводить к нарушению структуры белковых молекул?
2. Чем фибриллярные белки отличаются от глобулярных? Приведите примеры фибриллярных и глобулярных белков.
3. Назовите основные биологические функции белков, приведите соответствующие примеры.
4. Что такое ферменты? Почему без их участия протекание большинства биохимических процессов в клетке было бы невозможным?
5. В чем заключается специфичность ферментов? Какова ее причина? Почему ферменты активно функционируют лишь в определенном диапазоне температуры, pH и других факторов?
6. Почему белки, как правило, используются в качестве источников энергии лишь в крайних случаях, когда в клетках исчерпаны запасы углеводов и жиров?
7. У многих бактерий в процессах синтеза веществ, необходимых для нормального роста и размножения, участвует парааминобензойная кислота (ПАБК). В то же время в медицине для лечения ряда бактериальных инфекций используются сульфаниламиды — вещества, по структуре сходные с ПАБК. Как вы думаете, на чем основано лечебное действие сульфаниламидов?

- § 1. Содержание химических элементов в организме. Макро- и микроэлементы
- § 2. Химические соединения в живых организмах. Неорганические вещества
- § 3. Органические вещества. Аминокислоты. Белки
- § 4. Свойства и функции белков
- § 5. Углеводы
- § 6. Липиды
- § 7. Нуклеиновые кислоты
- § 8. АТФ
- § 9. Биологически активные вещества
- § 10. История открытия клетки. Создание клеточной теории
- § 11. Методы изучения клетки. Общий план строения клетки
- § 12. Цитоплазматическая мембрана
- § 13. Гиалоплазма. Цитоскелет
- § 14. Клеточный центр. Рибосомы
- § 15. Эндоплазматическая сеть. Комплекс Гольджи. Лизосомы
- § 16. Вакуоли
- § 17. Митохондрии. Пластиды
- § 18. Ядро
- § 19. Особенности строения клеток прокариот
- § 20. Особенности строения клеток эукариот
- § 21. Клеточный цикл
- § 22. Простое бинарное деление. Митоз. Амитоз
- § 23. Мейоз и его биологическое значение
- § 24. Общая характеристика обмена веществ и преобразование энергии
- § 25. Клеточное дыхание
- § 26. Брожение
- § 27. Фотосинтез
- § 28. Хранение наследственной информации
- § 29. Реализация наследственной информации
- § 30. Структурная организация живых организмов
- § 31. Регуляция жизненных функций организма
- § 32. Общая неспецифическая защита организма
- § 33. Специфическая иммунная защита организма
- § 34. Типы размножения организмов. Бесполое размножение
- § 35. Половое размножение. Образование половых клеток
- § 36. Оплодотворение
- § 37. Онтогенез. Эмбриональное развитие животных
- § 38. Постэмбриональное развитие животных
- § 39. Онтогенез человека
- § 40. Закономерности наследования признаков, установленные Г Менделем. Моногибридное скрещивание. Первый и второй законы Менделя
- § 41. Цитологические основы наследования признаков при моногибридном скрещивании
- § 42. Взаимодействие аллельных генов. Множественный аллелизм
- § 43. Дигибридное скрещивание. Третий закон Менделя
- § 44. Сцепленное наследование. Хромосомная теория наследственности
- § 45. Генетика пола
- § 46. Изменчивость организмов, ее типы. Модификационная изменчивость
- § 47. Генотипическая изменчивость
- § 48. Особенности наследственности и изменчивости человека
- § 49. Наследственные болезни человека
- § 50. Селекция, ее задачи и основные направления
- § 51. Методы и достижения селекции
- § 52. Основные направления биотехнологии
- § 53. Успехи и достижения генетической инженерии
- Словарь основных терминов и понятий
Глава 1. Химические компоненты живых организмов
Глава 2. Клетка — структурная и функциональная единица живых организмов
Глава 3. Обмен веществ и преобразование энергии в организме
Глава 4. Структурная организация и регуляция функций в живых организмах
Глава 5. Размножение и индивидуальное развитие организмов
Глава 6. Наследственность и изменчивость организмов
Глава 7. Селекция и биотехнология


