§ 3. Органические вещества. Аминокислоты. Белки
Биология, 10 класс (Лисов, 2014)
[ Содержание ]
Органические вещества. Понятие о биополимерах. Как уже отмечалось, в состав живых организмов, кроме неорганических, входят различные органические вещества: белки, липиды, углеводы, нуклеиновые кислоты и др. Они образованы, прежде всего, четырьмя химическими элементами: углеродом, водородом, кислородом и азотом. В составе белков к этим элементам добавляется сера, а в нуклеиновых кислотах — фосфор.
В живых организмах органические вещества представлены как небольшими, с относительно низкой молекулярной массой, молекулами, так и макромолекулами. К низкомолекулярным соединениям относятся аминокислоты, моносахариды, нуклеотиды, карбоновые кислоты, спирты и некоторые другие. Макромолекулы (от греч. макрос — большой) представлены белками, полисахаридами и нуклеиновыми кислотами. Это сложные по структуре соединения с большой молекулярной массой. Так, относительная молекулярная масса большинства белков составляет от 5000 до 1 000 000. Как вы знаете из курса химии, относительная молекулярная масса (Л4Г) равна отношению массы одной молекулы вещества к части массы атома углерода и, следовательно, является величиной безразмерной. Значение Л4Г показывает, во сколько раз масса молекулы данного вещества больше атомной единицы массы.
Молекулы белков, полисахаридов и нуклеиновых кислот состоят из большого числа одинаковых или различных по составу повторяющихся звеньев. Как вы знаете из курса химии, подобные соединения называются полимерами. Простые молекулы, из остатков которых состоят полимеры, называются мономерами. Мономерами белков являются аминокислоты, мономерами полисахаридов — моносахариды, молекулы нуклеиновых кислот построены из нуклеотидов. Белки, полисахариды и нуклеиновые кислоты содержатся в клетках всех живых организмов и выполняют исключительно важные биологические функции, поэтому их называют биологическими полимерами (биополимерами).
В клетках различных живых организмов содержание тех или иных органических соединений разное. Например, в клетках животных преобладают белки и липиды, а в клетках растений — углеводы. Однако в различных клетках определенные органические соединения выполняют схожие функции.
В живых организмах среди макромолекул по функциональному значению ведущая роль принадлежит белкам. Белки во многих организмах преобладают и количественно. Так, в организме животных они составляют 40—50 %, в организме растений — 20—35 % сухой массы. Белки — это полимеры, мономерами которых являются аминокислоты.
Аминокислоты — «кирпичики» белковых молекул. Аминокислоты — органические соединения, содержащие одновременно аминогруппу (—NH2), для которой характерны основные свойства, и карбоксильную группу (—СООН) с кислотными свойствами. Известно около 200 аминокислот, но в образовании природных белков участвует только 20. Такие аминокислоты называются белок-образующими. В таблице 2 приведены полные и сокращенные названия этих аминокислот (не для запоминания).
Таблица 2. Белокобразующие аминокислоты и их сокращенные обозначения
|
Название аминокислоты |
Обозначение |
Название аминокислоты |
Обозначение |
|
Аланин |
Ала |
Лейцин |
Лей |
|
Аргинин |
Apr |
Лизин |
Лиз |
|
Аспарагин |
Асн |
Метионин |
Мет |
|
Аспарагиновая кислота |
Асп |
Пролин |
Про |
|
Валин |
Вал |
Серии |
Сер |
|
Гистидин |
Гис |
Тирозин |
Тир |
|
Глицин |
Гли |
Треонин |
Тре |
|
Глутамин |
Глн |
Триптофан |
Трп |
|
Глутаминовая кислота |
Глу |
Фенилаланин |
Фен |
|
Изолейцин |
Иле |
Цистеин |
Цис |
В молекулах белокобразующих аминокислот карбоксильная группа и аминогруппа связаны с одним и тем же атомом углерода. По этому признаку 20 аминокислот сходны между собой. Другая часть молекулы, называемая радикалом (R), у разных аминокислот имеет различное строение (рис. 6). Радикал может быть неполярным или полярным, гидрофобным или гидрофильным, что и придает разным аминокислотам особые свойства.
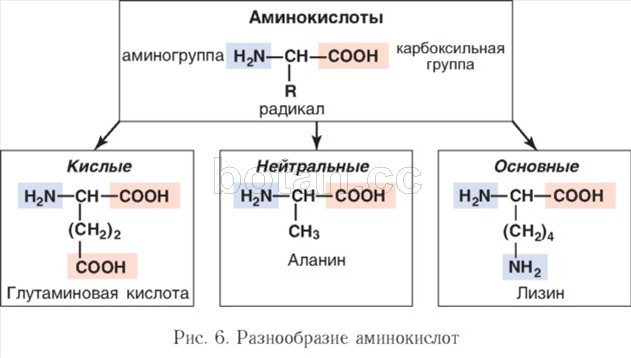
У большей части белокобразующих аминокислот имеется одна карбоксильная группа и одна аминогруппа — такие аминокислоты называются нейтральными (см. рис. 6). Существуют также основные аминокислоты, с более чем одной аминогруппой, и кислые аминокислоты, с более чем одной карбоксильной группой. Наличие дополнительной амино- или карбоксильной группы оказывает влияние на свойства аминокислоты, которые играют определяющую роль в формировании пространственной структуры белка. В состав радикала некоторых аминокислот (например, цистеина) входят атомы серы.
Автотрофные организмы синтезируют все необходимые им аминокислоты из первичных продуктов фотосинтеза и азотсодержащих неорганических соединений. Для гетеротрофных организмов источником аминокислот является пища. В организме человека и животных некоторые аминокислоты могут синтезироваться из продуктов обмена веществ (в первую очередь — из других аминокислот). Такие аминокислоты называются заменимыми. Другие же, так называемые незаменимые аминокислоты, не могут быть синтезированы в организме и поэтому должны постоянно поступать в него в составе белков пищи. Белки пищи, содержащие остатки всех незаменимых аминокислот, называются полноценными, в отличие от неполноценных, в составе которых отсутствуют остатки тех или иных незаменимых аминокислот.
Незаменимыми аминокислотами для человека являются: триптофан, лизин, валин, изолейцин, треонин, фенилаланин, метионин и лейцин. Для детей незаменимыми являются также аргинин и гистидин.
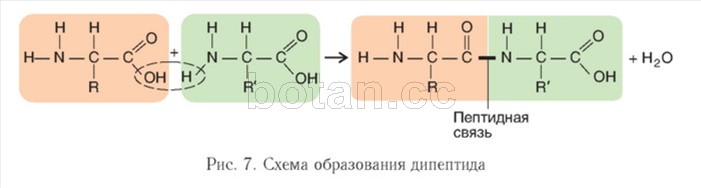
Наличие как основной, так и кислотной групп обусловливает амфотерность и высокую реакционную способность аминокислот. Аминогруппа (—NH2) одной аминокислоты способна взаимодействовать с карбоксильной группой (—СООН) другой аминокислоты. При этом выделяется молекула воды, а между атомом азота аминогруппы и атомом углерода карбоксильной группы возникает ковалентная связь, которая называется пептидной связью. Образующаяся молекула представляет собой дипептид (рис. 7). На одном конце молекулы дипептида находится свободная аминогруппа, а на другом — свободная карбоксильная группа. Благодаря этому дипептид может присоединять к себе другие аминокислоты, образуя олигопептиды. Если таким образом соединяется более 10 остатков аминокислот, то образуется полипептид.
Пептиды играют важную роль в организме человека. Многие гормоны (глюкагон, ва-зопрессин, о кс и то ц и н и др.), антибиотики (например, грамицидин), токсины (например, дифтерийный токсин) по химической природе являются олиго- и полипептидами.
Белки. Уровни организации белковой молекулы. Полипептидные цепи могут быть очень длинными и включать самые разные комбинации аминокислотных остатков. Полипептиды, в состав молекул которых входит от 50 до нескольких тысяч остатков аминокислот, называются белками. Каждый конкретный белок характеризуется строго постоянным составом и последовательностью аминокислотных остатков.
Белки, образованные только остатками аминокислот, называются простыми. Сложными являются белки, имеющие в своем составе компонент неаминокислотной природы. Это могут быть ионы металлов (Fe2+, Zn2+, Mg2^ Мп2+), липиды, нуклеотиды, сахара и др. Простыми белками являются альбумины крови, фибрин, некоторые ферменты (трипсин) и др. Сложные белки — это большинство ферментов, иммуноглобулины (антитела).
Молекулы белков могут принимать различные пространственные формы, которые представляют собой четыре уровня их структурной организации (рис. 8).
Цепочка из множества аминокислотных остатков, соединенных пептидными связями, представляет собой первичную структуру белковой молекулы. Это наиболее важная структура, так как именно она определяет форму, свойства и функции белка. На основе первичной структуры создаются другие виды структур. Каждый белок организма имеет уникальную первичную структуру.
Вторичная структура белка возникает в результате образования водородных связей между атомами водорода NH-групп и атомами кислорода СО-групп разных аминокислотных остатков полипептидной цепи. Полипептидная цепь при этом закручивается в спираль. Водородные связи слабые, но благодаря значительному количеству они обеспечивают стабильность этой структуры. Полностью спиральную конфигурацию имеют, например, молекулы кератина — основного белка волос и ногтей человека. Спиральная вторичная структура характерна и для некоторых других белков, например для миозина
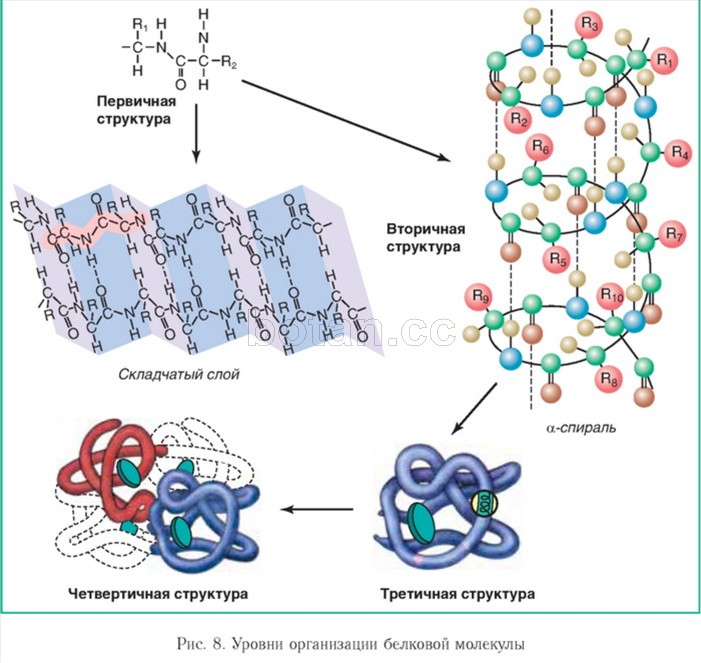
Вторичная структура белка, помимо спирали, может быть представлена складчатым слоем. В этом случае несколько полипептидных цепей (или участков одной полипептидной цепи) размещаются параллельно, образуя структуру, сложенную наподобие гармошки (см. рис. 8). Такую конфигурацию имеет, например, белок фиброин, составляющий основу волокон натурального шелка.
Третичная структура формируется за счет образования водородных, ионных и других связей, возникающих между разными группами атомов белковой молекулы в водной среде. У некоторых белков важную роль в образовании третичной структуры играют S — S связи (дисульфидные связи) между остатками цистеина (аминокислоты, содержащей серу). При этом полипептидная спираль укладывается в своеобразный клубок (глобулу) таким образом, что гидрофобные аминокислотные радикалы погружаются внутрь глобулы, а гидрофильные располагаются на поверхности и взаимодействуют с молекулами воды. Третичной структурой определяются специфичность белковых молекул, их биологическая активность. Третичную структуру имеют многие белки, например миоглобин (белок, который участвует в создании запаса кислорода в мышцах) и трипсин (фермент, расщепляющий белки пищи в кишечнике).
В состав молекул некоторых белков входит не один, а несколько полипептидов, образующих единый комплекс. Так формируется четвертичная структура. Полипептиды (они могут иметь одинаковое или разное строение) не связываются ковалентными связями. Прочность четвертичной структуры обеспечивается взаимодействием слабых межмолекулярных сил. Например, четвертичная структура характерна для белка гемоглобина. Его молекула состоит из четырех структурных элементов — субъединиц, в состав каждой субъединицы входит полипептидная цепь и небелковый компонент — гем.
1. Какие вещества являются биологическими полимерами? Какие вещества являются мономерами для построения молекул биополимеров?
а ) Аминокислоты; г ) нуклеотиды;
б ) нуклеиновые кислоты; д ) белки;
в ) полисахариды; е ) моносахариды.
2. Какие функциональные группы характерны для всех аминокислот? Какими свойствами обладают эти группы?
3. Сколько аминокислот участвует в образовании природных белков? Назовите общие черты строения этих аминокислот. Чем они различаются?
4. Каким образом аминокислоты соединяются в полипептидную цепь? Постройте дипептид и трипептид. Для выполнения задания используйте структурные формулы аминокислот, показанные на рисунке 6.
5. Охарактеризуйте уровни структурной организации белков. Какие химические связи обусловливают различные уровни структурной организации белковых молекул?
6. Человек и животные получают аминокислоты из пищи. Из чего могут синтезироваться аминокислоты у растений?
7. Сколько разных трипептидов можно построить из трех молекул аминокислот (например, аланина, лизина и глутаминовой кислоты), если каждую аминокислоту можно использовать только один раз? Будут ли эти пептиды обладать одинаковыми свойствами?
8. Для разделения смеси белков на компоненты используется метод электрофореза: в электрическом поле отдельные белковые молекулы с определенной скоростью перемещаются к одному из электродов. При этом одни белки двигаются в сторону катода, другие перемещаются к аноду. Как строение молекулы белка связано с его способностью двигаться в электрическом поле? От чего зависит направление движения белковых молекул? От чего зависит их скорость?
- § 1. Содержание химических элементов в организме. Макро- и микроэлементы
- § 2. Химические соединения в живых организмах. Неорганические вещества
- § 3. Органические вещества. Аминокислоты. Белки
- § 4. Свойства и функции белков
- § 5. Углеводы
- § 6. Липиды
- § 7. Нуклеиновые кислоты
- § 8. АТФ
- § 9. Биологически активные вещества
- § 10. История открытия клетки. Создание клеточной теории
- § 11. Методы изучения клетки. Общий план строения клетки
- § 12. Цитоплазматическая мембрана
- § 13. Гиалоплазма. Цитоскелет
- § 14. Клеточный центр. Рибосомы
- § 15. Эндоплазматическая сеть. Комплекс Гольджи. Лизосомы
- § 16. Вакуоли
- § 17. Митохондрии. Пластиды
- § 18. Ядро
- § 19. Особенности строения клеток прокариот
- § 20. Особенности строения клеток эукариот
- § 21. Клеточный цикл
- § 22. Простое бинарное деление. Митоз. Амитоз
- § 23. Мейоз и его биологическое значение
- § 24. Общая характеристика обмена веществ и преобразование энергии
- § 25. Клеточное дыхание
- § 26. Брожение
- § 27. Фотосинтез
- § 28. Хранение наследственной информации
- § 29. Реализация наследственной информации
- § 30. Структурная организация живых организмов
- § 31. Регуляция жизненных функций организма
- § 32. Общая неспецифическая защита организма
- § 33. Специфическая иммунная защита организма
- § 34. Типы размножения организмов. Бесполое размножение
- § 35. Половое размножение. Образование половых клеток
- § 36. Оплодотворение
- § 37. Онтогенез. Эмбриональное развитие животных
- § 38. Постэмбриональное развитие животных
- § 39. Онтогенез человека
- § 40. Закономерности наследования признаков, установленные Г Менделем. Моногибридное скрещивание. Первый и второй законы Менделя
- § 41. Цитологические основы наследования признаков при моногибридном скрещивании
- § 42. Взаимодействие аллельных генов. Множественный аллелизм
- § 43. Дигибридное скрещивание. Третий закон Менделя
- § 44. Сцепленное наследование. Хромосомная теория наследственности
- § 45. Генетика пола
- § 46. Изменчивость организмов, ее типы. Модификационная изменчивость
- § 47. Генотипическая изменчивость
- § 48. Особенности наследственности и изменчивости человека
- § 49. Наследственные болезни человека
- § 50. Селекция, ее задачи и основные направления
- § 51. Методы и достижения селекции
- § 52. Основные направления биотехнологии
- § 53. Успехи и достижения генетической инженерии
- Словарь основных терминов и понятий
Глава 1. Химические компоненты живых организмов
Глава 2. Клетка — структурная и функциональная единица живых организмов
Глава 3. Обмен веществ и преобразование энергии в организме
Глава 4. Структурная организация и регуляция функций в живых организмах
Глава 5. Размножение и индивидуальное развитие организмов
Глава 6. Наследственность и изменчивость организмов
Глава 7. Селекция и биотехнология


