§ 2. Химические соединения в живых организмах. Неорганические вещества
Биология, 10 класс (Лисов, 2014)
[ Содержание ]
Познакомившись с химическими элементами, содержащимися в живых организмах, обратимся к изучению веществ, в состав которых эти элементы входят. Среди них выделяют неорганические (вода, минеральные соли и кислоты) и органические соединения (рис. 1). Больше всего по массе в живых организмах содержится воды.
Вода. Содержание воды в живых организмах составляет 60—75 % их массы, а у некоторых, например медуз, — до 98 %. В листьях и сочных плодах растений содержание воды также может достигать 98 %.
Количество воды неодинаково в разных тканях и органах. Так, у человека в сером веществе головного мозга ее содержание составляет 85 %, а в костной ткани — 22 %. Наибольшее содержание воды в организме наблюдается в эмбриональный период (95 %) и с возрастом постепенно уменьшается. Без употребления воды человек может прожить не более 5—7 дней.
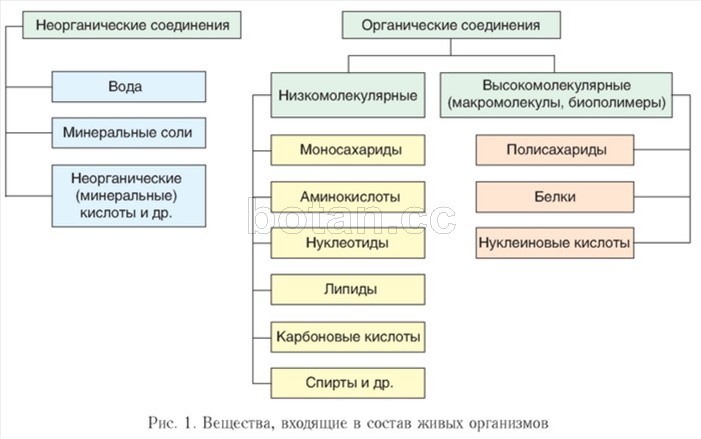
Как вы уже знаете из курса химии, молекула воды (Н20) состоит из двух атомов водорода, соединенных ковалентными полярными связями с атомом кислорода.
Связи Н—О—Н расположены под углом 104,5° друг к другу. Кислород обладает большей электроотрицательностью, чем водород, поэтому атом кислорода притягивает к себе общие электронные пары и приобретает частично отрицательный заряд. Атомы водорода приобретают частично положительный заряд, т. е. молекула воды является полярной.
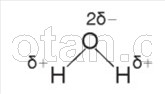
Между атомом кислорода одной молекулы воды и атомом водорода другой молекулы возникает электростатическое притяжение. Такое взаимодействие,
более слабое, чем ионная связь, называется водородной связью. Каждая молекула воды, подобно маленькому магниту, притягивает к себе за счет образования водородных связей еще четыре молекулы (рис. 2). Благодаря образованию водородных связей молекулы воды связаны друг с другом. Поэтому вода при температурах от О °С до 100 °С может сохранять жидкое агрегатное состояние, тогда как подобные ей водородные соединения (например, H2S, NH3, HF) являются газами.
Биологическая роль воды в живых организмах связана с ее свойствами, прежде всего с малыми размерами молекул, их полярностью и способностью образовывать водородные связи между собой и с другими соединениями.
Именно вода определяет объем клеток и внутриклеточное (тургорное) давление. Благодаря полярности молекулы воды способны формировать так называемые гидратные оболочки вокруг ионов и полярных молекул. Это способствует обособлению частиц и препятствует их склеиванию друг с другом, что особенно важно, например, для белковых молекул.
Полярность молекул и способность образовывать водородные связи делает воду универсальным растворителем для полярных веществ, лучшим, чем большинство известных жидкостей. В зависимости от растворимости в воде соединения условно делят на растворимые, или гидрофильные (от греч. гидор — вода, фшшя — люблю), и нерастворимые, или гидрофобные (от греч. фобос — страх). Гидрофильными веществами являются моно- и дисахариды, многие минеральные соли и кислоты, низшие спирты, низшие карбоновые кислоты и др. Гидрофобны высшие карбоновые кислоты, жиры и некоторые другие вещества.
Вода — это среда протекания множества обменных процессов. Большинство химических реакций в организме происходит именно в водных растворах. Поступление и выведение веществ из клетки осуществляется, как правило, в растворенном виде. Вода принимает непосредственное участие во многих химических реакциях, происходящих в клетках, в том числе в процессах расщепления органических соединений. Она является одним из исходных веществ в реакциях фотосинтеза. Кислород, образующийся в ходе фотосинтеза, выделяется при расщеплении молекул воды.
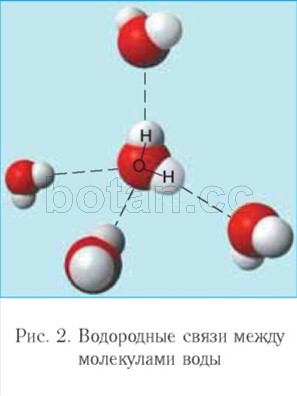
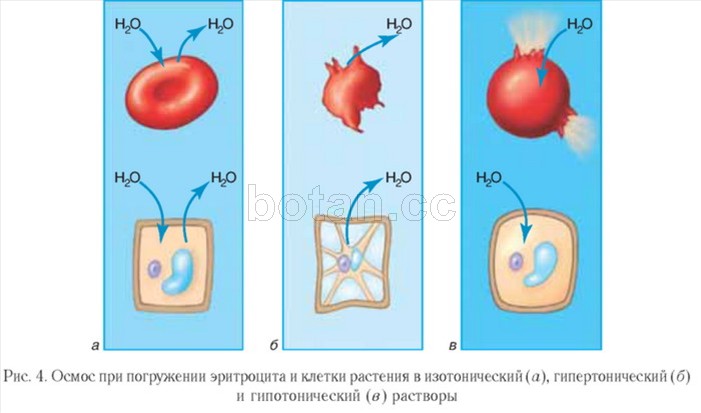
Вода как растворитель принимает участие в явлениях осмоса, играющих важную роль в жизнедеятельности клеток организма. Осмос — это перемещение молекул воды через полупроницаемую мембрану (например, через цитоплазматическую мембрану клетки) из области с меньшей концентрацией растворенных веществ (например, солей, сахаров или мочевины) в область с более высокой концентрацией этих веществ (рис. 3). За счет осмоса происходит выравнивание концентраций растворенных веществ в клетке и внеклеточной среде.
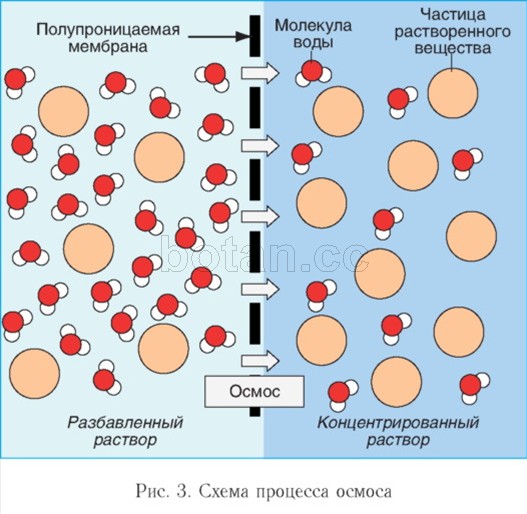
Если раствор и растворитель (например, воду) разделить избирательно проницаемой мембраной, наблюдается перемещение молекул растворителя через мембрану в раствор. Для того чтобы воспрепятствовать поступлению растворителя, к раствору необходимо приложить определенное давление, которое называется осмотическим давлением. Чем более концентрированным является раствор, тем выше его осмотическое давление.
Растворы, осмотическое давление которых такое же, как в клетках, получили название изотонических. Объем клеток, погруженных в изотонические растворы, остается неизменным (рис. 4, а). Изотонические растворы, в частности физиологический раствор (водный раствор NaCl массовой долей 0,9 %), используются в медицине. Их применяют при сильном обезвоживании и потере крови больными, для растворения лекарственных препаратов, вводимых путем инъекций.
Раствор, осмотическое давление которого выше, чем в клетках, называется гипертоническим. Клетки, погруженные в гипертонический раствор, теряют воду и уменьшаются в объеме, т. е. сморщиваются (рис. 4, б). Гипертонический раствор находит применение в лечении ран. Марлевая повязка, смоченная таким раствором, хорошо впитывает гной, что способствует очищению и заживлению раны.
Противоположная картина наблюдается при погружении клеток в гипотонический раствор, в котором концентрация растворенных веществ ниже, чем в клетках. В этом случае вода устремляется в клетку, клетка разбухает и может лизироваться, т. е. лопнуть (рис. 4, в).
С водой связана также регуляция теплового режима организмов. Воде свойственна высокая теплоемкость — способность поглощать большое количество теплоты при незначительных изменениях собственной температуры. Благодаря этому вода предотвращает резкие изменения температуры в клетках и организме в целом, даже когда температурные колебания в окружающей среде достаточно велики.
Общее количество водородных связей меязду молекулами воды изменяется в зависимости от температуры. При таянии льда разрушается примерно 15 % водородных связей, а при 40 °С — половина. При переходе в состояние пара разрушаются все водородные связи. При изменении температуры внешней среды вода поглощает (или выделяет) теплоту вследствие разрыва (или образования) многочисленных водородных связей. Этим объясняется высокая удельная теплоемкость воды.
При испарении воды организмами (транспирация у растений, потоотделение у млекопитающих) тратится много теплоты, что защищает их от перегрева.
Благодаря высокой теплопроводности вода обеспечивает равномерное распределение теплоты между тканями организма (например, через систему кровообращения). Таким образом, вода участвует в регуляции теплового режима организма.
Минеральные соли и кислоты. Для поддержания жизнедеятельности клеток и организма в целом необходимы минеральные соли. В живых организмах они находятся либо в растворенном виде (диссоциированы на ионы), либо в твердом состоянии. С биологической точки зрения наиболее важными среди ионов являются катионы К+, Na+, Са2+, Mgr+ и анионы СГ, НСО3, НРО^, Н0РО4.
Общее содержание минеральных солей в различных клетках варьирует от одного до нескольких процентов. Их роль в клетке разнообразна. Так, разная концентрация ионов К+ и Na+ внутри и снаружи клеток приводит к возникновению разности электрических потенциалов на цитоплазматической мембране, что очень важно для передачи нервных импульсов, а также для транспорта веществ через мембрану. При уменьшении этой разности снижается возбудимость клеток.
Некоторые ионы необходимы для синтеза органических веществ. Например, остатки фосфорной кислоты входят в состав нуклеотидов и АТФ, ион Fe2+ — в состав гемоглобина, Mg2+ — в состав хлорофилла и т.д. Ионы NO3, NHJ являются источниками атомов азота, ион SO2- — атомов серы, которые необходимы автотрофным организмам для синтеза аминокислот. Регуляторную функцию и активизацию многих ферментов осуществляют ионы Са2+ и Mg2+. Кроме того, ионы Mg2* активизируют энергетический обмен и синтез АТФ.
Соединения кальция (например, СаС03) входят в состав раковин моллюсков, панцирей ракообразных и других животных. У некоторых протестов внутриклеточный скелет построен из оксида кремния (IV) Si02 или сульфата стронция SrS04.
Неорганические кислоты также выполняют важные функции в организме. Так, в желудке позвоночных соляная кислота создает кислую среду, способствуя уничтожению болезнетворных микроорганизмов и активации ферментов желудочного сока, стимулирует сокращения стенок желудка. Угольная кислота и ее анионы формируют бикарбонатную буферную систему, а анионы фосфорной кислоты — фосфатную буферную систему.
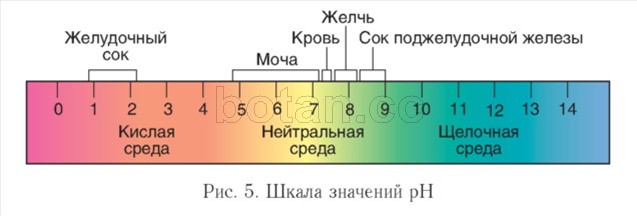
Кислотность среды. На протекание биохимических реакций в живых организмах существенное влияние оказывает концентрация ионов водорода (Н+) — кислотность среды. В нейтральных растворах эта концентрация составляет 1(Г7 моль/л. Для характеристики кислотности среды удобно пользоваться водородным показателем рН( пэ-аш) и шкалой pH (рис. 5).
В водных растворах величина pH обычно принимает значения от 0 до 14. Нейтральная среда характеризуется значением pH = 7, в щелочной среде pH больше 7, в кислой — меньше 7. Чем больше величина pH отличается от 7, тем более кислым или щелочным является раствор.
Внутри клеток среда нейтральная или слабощелочная (pH = 7,0—7,3), в крови величина pH несколько выше, чем в клетках и обычно колеблется в пределах 7,35—7,45. В пищеварительном тракте pH сильно варьирует. Экстремальные величины pH характерны для желудка (1 —2) и тонкого кишечника (более 8). Значительные колебания pH (4,8—7,4) наблюдаются в моче.
Понятие о буферных растворах. Живые организмы в целом и их отдельные клетки обладают способностью поддерживать кислотность среды на определенном уровне. В поддержании слабощелочной реакции внеклеточной среды
участвуют угольная кислота Н2С03 и гидрокарбонат-ион НСО3. Угольная кислота — слабый электролит, в растворе определенная часть ее молекул диссоциирована и наблюдается баланс:
Н2С03 ^ Н+ + НСОд.
Если по какой-либо причине концентрация ионов Н+ в растворе увеличивается (среда становится более кислой), анионы НСОд связывают их:
Н+ + НСО3 ->• Н2С03.
Если кислотность среды снижается, молекулы угольной кислоты диссоциируют, высвобождая дополнительные ионы водорода:
Н2С03 Н+ + НСО3.
Так в растворе сохраняется относительно постоянная концентрация ионов Н+. Сходным образом анионы фосфорной кислоты НоРО^ и НРО^ обеспечивают поддержание нейтральной или слабощелочной среды внутри клеток. Растворы, в которых при изменении состава среды обеспечивается относительное постоянство концентрации ионов водорода (Н+), называются буферными.
1. Какие неорганические вещества входят в состав живых организмов?
2. Какие вещества называют гидрофильными? Гидрофобными? Приведите примеры.
3. Охарактеризуйте биологическую роль минеральных солей и кислот.
4. Сколько воды содержится в живых организмах? От чего это зависит? Почему растения при недостатке воды увядают?
5. Два раствора глюкозы разделены мембраной, не пропускающей молекулы глюкозы, но пропускающей воду. Концентрация глюкозы в первом растворе— 1 %, во втором — 0,1 %. Что происходит с молекулами воды? Как называется это явление?
6. Каковы основные функции воды в живых организмах? Как физические и химические свойства воды связаны с ее биологическими функциями?
7. Как вы думаете, почему большинство полярных веществ хорошо растворяются в воде, а неполярные, как правило, нерастворимы в ней?
8. Буферные свойства внеклеточной среды обеспечивают угольная кислота и гидрокар-бонат-ион, внутри клеток эту функцию выполняют анионы фосфорной кислоты. Почему эти соединения позволяют поддерживать в растворах определенную концентрацию ионов водорода, в то время как азотная и соляная кислоты, а также их анионы, не обладают такими свойствами?
- § 1. Содержание химических элементов в организме. Макро- и микроэлементы
- § 2. Химические соединения в живых организмах. Неорганические вещества
- § 3. Органические вещества. Аминокислоты. Белки
- § 4. Свойства и функции белков
- § 5. Углеводы
- § 6. Липиды
- § 7. Нуклеиновые кислоты
- § 8. АТФ
- § 9. Биологически активные вещества
- § 10. История открытия клетки. Создание клеточной теории
- § 11. Методы изучения клетки. Общий план строения клетки
- § 12. Цитоплазматическая мембрана
- § 13. Гиалоплазма. Цитоскелет
- § 14. Клеточный центр. Рибосомы
- § 15. Эндоплазматическая сеть. Комплекс Гольджи. Лизосомы
- § 16. Вакуоли
- § 17. Митохондрии. Пластиды
- § 18. Ядро
- § 19. Особенности строения клеток прокариот
- § 20. Особенности строения клеток эукариот
- § 21. Клеточный цикл
- § 22. Простое бинарное деление. Митоз. Амитоз
- § 23. Мейоз и его биологическое значение
- § 24. Общая характеристика обмена веществ и преобразование энергии
- § 25. Клеточное дыхание
- § 26. Брожение
- § 27. Фотосинтез
- § 28. Хранение наследственной информации
- § 29. Реализация наследственной информации
- § 30. Структурная организация живых организмов
- § 31. Регуляция жизненных функций организма
- § 32. Общая неспецифическая защита организма
- § 33. Специфическая иммунная защита организма
- § 34. Типы размножения организмов. Бесполое размножение
- § 35. Половое размножение. Образование половых клеток
- § 36. Оплодотворение
- § 37. Онтогенез. Эмбриональное развитие животных
- § 38. Постэмбриональное развитие животных
- § 39. Онтогенез человека
- § 40. Закономерности наследования признаков, установленные Г Менделем. Моногибридное скрещивание. Первый и второй законы Менделя
- § 41. Цитологические основы наследования признаков при моногибридном скрещивании
- § 42. Взаимодействие аллельных генов. Множественный аллелизм
- § 43. Дигибридное скрещивание. Третий закон Менделя
- § 44. Сцепленное наследование. Хромосомная теория наследственности
- § 45. Генетика пола
- § 46. Изменчивость организмов, ее типы. Модификационная изменчивость
- § 47. Генотипическая изменчивость
- § 48. Особенности наследственности и изменчивости человека
- § 49. Наследственные болезни человека
- § 50. Селекция, ее задачи и основные направления
- § 51. Методы и достижения селекции
- § 52. Основные направления биотехнологии
- § 53. Успехи и достижения генетической инженерии
- Словарь основных терминов и понятий
Глава 1. Химические компоненты живых организмов
Глава 2. Клетка — структурная и функциональная единица живых организмов
Глава 3. Обмен веществ и преобразование энергии в организме
Глава 4. Структурная организация и регуляция функций в живых организмах
Глава 5. Размножение и индивидуальное развитие организмов
Глава 6. Наследственность и изменчивость организмов
Глава 7. Селекция и биотехнология


