- Учителю
- Сандық есептер шығару, 10 сыныпқа арналған қолданбалы курс
Сандық есептер шығару, 10 сыныпқа арналған қолданбалы курс
</ Ақтөбе облыстық білім басқармасы
Ақтөбе облыстық ғылыми -тәжірибелік орталығы
«Химиядан сандық және сапалық
есептерді шығару үлгілері»
Химия пәнінен оқушыларға,
жас мұғалімдерге арналған
әдістемелік көмекші құрал
Ақтөбе 2014
Құрастырған:
А.Х.Мунайтбасова Қ.Жұбанов атындағы орта мектебінің химия пәні мұғалімі
Пікір жазғандар:
Г.К.Мукеева- Ақтөбе облыстық ғылыми -тәжірибелік орталығының бөлім меңгерушісі
Б.Б.Досанова -Ақтөбе өңірлік мемлекеттік университетінің химия және химиялық технология кафедрасының оқытушысы, педагогика ғылымдарының кандидаты, доцент.
Кіріспе
Қазіргі кездегі ғылым мен техниканың даму деңгейі әрбір оқушыға сапалы және терең білім мен іскерліктің болуын, олардың шығармашылықпен жұмыс істеуін ойлауға қабілетті болуын талап етеді.
Химия пәнін оқыту үрдісінің негізгі мақсаты - оқушылардың химиялық білім негіздерін толық түсіну мен меңгеру арқылы шығармашылық қабілетін дамыту. Химия пәнін оқып - үйренгенде есептер шығарып, жаттығулар орындаудың маңызы өте зор. Есеп шығарып, жаттығулар орындау білімді тексеру ғана емес, сонымен қатар оқушыларды өздігінен ізденуге де дағдыландырады. Есеп шығару - оқушыларды химиялық ой - өрісін дамытудың негізгі құралдарының бірі, теориялық білім мен тәжірибе арасындағы байланысты жүзеге асырудың жолы .
Есеп шығару оқушыларды жаңа химиялық біліммен қаруландырып, қалыптасқан іскерліктері мен дағдыларын жүйелеуге және нақтылауға да көмектеседі. Есеп шығару барысында оқушының білімі, зердесі, ойлау қабілеті дамумен қатар химиялық білімді, заңдарды, құбылыстарды тереңірек түсінуі қалыптасады.
Химиялық есептер :
-
Жаңа химиялық ұғымдар мен мағлұматтарды үйрету;
-
Сарамандық іскерліктер мен дағдыларды қалыптастыру;
-
Білімнің тереңдігі мен баяндылығын тексеру;
-
Проблема қою, проблемалық жағдай туғызу;
-
Материалды пысықтау, қорытындылау және қайталау;
-
Политехникалық ұстанымдарын іске асыру;
-
Оқушылардың шығармашылық қабілетін тәрбиелеу үшін қолданылады;
Есеп шығару химия пәнің меңгеруде үлкен орын алады, себебі ол кезде оқушы өзінің алған теориялық білімін практикада қолданып үйренеді. Қажет болған жағдайда анықтамаларды пайдаланып оқулықтардан теориялық материалды қайталайды, есеп шығаруға қажетті мәліметтерді еске түсіреді.
Есеп шығарып үйренудің негізгі 2 жолы бар.Есеп шығаруды мұғалім үйретеді, немесе арнайы оқу құралдарының көмегімен оқушы өз бетімен үйренеді. Химия пәніне бөлінген апталық 2 сағаттың ішінде мұғалім теориямен қатар есеп шығаруды үйретуі тиіс. Ал сабақтан тыс уақытта химияға қызығатын оқушылар өз бетімен есеп шығарып, үйренуі үшін қазақ тілінде шыққан арнайы оқу құралдары мен есептер жинақтары керек. Әзірше ондай оқу құралдары жоқтың қасы. Осы орайда, бұл әдістемелік құрал химия есептерін өз бетімен шығарып үйренгісі келетін оқушыларға және ұстаздық қызметтерін жаңадан бастап жатқан жас мамандарға пайдасын тигізетін шығар деп ойлаймын. Сонымен қатар бұл әдістемелік оқу құралы «Химия мен биология» мамандықтары бойынша оқитын жоғары оқу орындарының студенттеріне мектептерде өтетін педогогикалық практика кезінде көмектесе алады.
Химия есептерін шығаруға арналған курс жүргізуде қолданбалы көмекші құрал бола алады деп сенемін.
1
І Химиялық есептерді шығарудың жалпы әдістемелік талаптары
Химиядан есеп шығару, жаттығу орындауда химиялық ұғымдар қайталанып, алынған білімдер тереңдей түседі, оқушылардың ой - өрісі дамиды, бұл орайда оларды өз бетімен жұмыс істеуге итермелейді.Есеп шығару арқылы оқушылар еңбекке үйренеді, жауапкершілік артады, мақсатқа жету үшін табандылық пайда болады. Есеп шығаруда пәнаралық байланыста іске асады, ғылым мен білімнің өмірдің байланысын ұштастырады. Табиғаттың тұтастығы туралы көзқарас қалыптасады. Есеп шығаруда оқушылардың ой әрекеті мен іс әрекеті дамиды.Олар ойға тоқу, дәлелдеу, талдау сияқты ойлау элементтерін үйренеді. Игерген білімдерін болашақта мамандық таңдауда пайдалануға бейімделеді.
Оқушылар қабілетіне қарай мемлекеттік стандартқа сәйкес сапалы білім алады.
-
Пәнге қызығушылығы артады
-
Болашақ мамандық таңдауына жол ашады
Мектеп курсында химиялық есептер негізгі 2 топқа бөлінеді:
-
сандық есептер
-
сапалық және сынақ - тәжірибелік (эксперименттік) есептер.
Сандық есептерді 3 - ке топтастыруға болады:
-
Химиялық формула бойынша есептер шығару;
-
Химиялық реакция теңдеулері бойынша есептер шығару;
-
Ерітіндіге байланысты есептер шығару;
Әр топтың есептерінің бірнеше түрлері болады.
Бірінші топқа 15 түрлі есеп кіреді:
-
Қосылыстың салыстырмалы молекулалық массасын анықтау;
-
Күрделі заттың формуласы бойынша ондағы элементтер массаларының қатынастарын есептеу;
-
Қосылыстардағы элеметтердің массалық үлесін анықтау;
-
Белгілі заттың массасынан элементтің массасын анықтау;
-
Элементтің массасы арқылы заттың массасын табу;
-
Салыстырмалы тығыздық арқылы газдардың молекулалық формуласын табу;
-
Газдардың салыстырмалы тығыздығын есептеу;
-
Заттың белгілі мөлшері бойынша массасын табу;
-
Заттың белгілі массасына сәйкес зат мөлшерін есептеу;
-
Қосылыстағы элементтердің массалық үлесі бойынша заттың қарапайым формуласын табу;
-
Газдардың тығыздығы мен элементтердің массалық үлесі бойынша заттардың молекулалық формуласын анықтау;
-
Газ тәрізді заттың мөлшері бойынша қалыпты жағдайда алатын көлемін есептеу;
-
Газ тәрізді заттың массасы боынша қалыпты жағдайда алатын көлемін есептеу;
14.Жану өнімдерінің массалары мен көлемдері, олардың буларынан салыстырмалы тығыздықтары бойынша заттың молекулалық формуласын табу;
15.Газ тәрізді заттың қалыпты жағдайдағы көлемі бойынша массасын есептеу;
2
Сандық есептерді С.Г. Шаповаленко бойынша мынадай (7)типтерге бөлуге болады:
1 - Моль ұғымы бойынша есептер шығару;
2 - Элементтердің массаларының арақатынасы мен химиялық формула арқылы есептеу;
3 - Зат құрамындағы элементтердің массаларын формуласы арқылы есептеу;
4 - Салыстырмалық тығыздыққа байланысты және газдың көлемі арқылы салыстырмалы молекулалық массасын анықтау
5 - Химиялық теңдеулер арқылы есептеу;
6 - Ертінділерге арналған есептер;
7 - Қарапайым молекулалық формула құрастыру:
Ю.В.Плетнер,В.С.Полосин бойынша сандық есептер 8 типке бөлінеді.
1- Формула арқылы есептеу
2-Ертіндіге байланысты есептер
3-Реакцияға қатысқан газдардың көлемдік қатынасын анықтауға байланысты есептеулер
4-Заттың салыстырмалы молекулалық массасын табуға байланысты есептер
5-Реакция өнімінің шығымына байланысты есептер
6-Реакцияға қатысқан заттың біреуі артық мөлшерде алынған жағдайда заттың сандық мөлшерін анықтауға байланысты есептер
7- Қоспаға байланысты есептер
8-Реакцияға қатысқан газтәрізді заттардың сандық мөлшерін анықтауға байланысты есептер
Сапалық есептер де бірнеше типтерге бөлінеді.
-
Заттарды алу әдістері
-
Заттың сапалық құрамын анықтау әдістері
-
Химиялық заттарды бір-бірінен ажырата білу
-
Химиялық құбылыстарды бақылау және түсіндіру
-
Заттарды жеке кластарға жатқыза білу
-
Берілген мөлшердегі ерітінділерді дайындау
-
Берілген заттарды қоспаның бар екендігін анықтау және затты қоспадан тазарту
II Химиялық есеп бөлімдері
Есептің мазмұны,яғни химиялық бөлімі және математикалық,яғни есептеу бөлімі болады.Есеп шығарғанда оқушылар есептің химиялық бөліміне көңіл бөлмей бірден математикалық есептеу жағына көңіл бөледі,сондықтан есептер жаттанды шығарылады. Оқушыларға заттардың сандық құрамымен қоса сапалық құрамы болатынын ескеру керек.
Мысалы: Мына қосылыстардың
5H2O, O2 , 2Cu, H2SO4, 3NaOH, CaCO3
сандық,сапалық құрамын анықтаңдар.
Шешуі: Сандық құрамы 5H2O
-
5 молекула су
-
Қандай элементтен құралған (H, O)
-
Заттың типі ( күрделі)
-
Қосылыс түрі (оксид)
3
Сапалық құрамы:
1.Салыстырмалы молекулалық массасы Mr(H2O)=18
2.Молярлық массасы М(H2O) =18г/моль
3.Зат мөлшері V(H2O)=5моль
4.Зат массасы m=M×V m=18г/×моль×5моль=90г
5.Элементтердің массалық үлестері (W)
W(H)=×100% =11% W(O)=![]() ×100%=89%
×100%=89%
6.Элементтердің массалық қатынасы
m(H)/m(O)=2/16=1/8
Есеп шығарғанда ең бірінші есептің химиялық мазмұнына мән беру керек,содан кейін есептің есептеу бөліміне ауысу қажет.
III. Химиялық есепті талдау
Есепті шығарарда оны мұқият оқып және есепте химиялық процесс туралы айтыла ма немесе тек қана зат туралы айтыла ма соны анықтап алу керек.Химиялық процесс болса реакция теңдеуі,ал зат туралы болса химиялық формуласы жазылады.
Есепті талдау арқылы оқушылардың ойлау іс-әрекеттері дамиды.
Есепті талдаудың 2 жолы бар:
А) есептің мазмұнын сұраққа қарай,яғни белгілі өлшемнен белгісіз өлшемге қарай талдау.Бұл талдаудың синтездік әдісі.
Б) ізделініп отырған шамадан белгілі шамаға қарай талдау-аналитикалық әдіс
Синтездік әдісте не берілді,оны қандай өлшеммен анықтауға болады,соңында нені анықтау керек,белгісіз өлшемді анықтау үшін мәліметтер жеткілікті ме,қандай қосымша анықтамалар керек,оны қалай анықтауға болады, міне осыларға мән беріледі. Есеп № 1
1кг 17% аммиак ертіндісін алу үшін аммоний хлоридімен сөндірілген әктің қандай массасын әрекеттестіруге болады?
Синтездік әдіс: Есеп мазмұнынан білетініміз: аммиактың массасы, проценттік мөлшері, сөндірілген әк массасын табу.
Б ерілгені W =
ерілгені W = ![]()
m (NH3) - 1к m (ер.зат) = W× m(ерітінді)
W (NH3) - 17 m (ер.зат) = 0,17 × 1000г=170г
т /к m Ca (OH)2 2NH4Cl + Ca
(OH)2 = CaCl2+2NH3 +
2H2O
/к m Ca (OH)2 2NH4Cl + Ca
(OH)2 = CaCl2+2NH3 +
2H2O
4
Mr (Ca(OH)2=40+(16+1)×2=74
M (Ca(OH)2=74 г\моль
mCa(OH)2=74г/моль ×1моль =74г
Mr (NH3) =14+(1×3) =17
M(NH3) =17г/ моль
m (NH3) =17г/моль×2моль =34 г
![]() =
=
![]() х=
х=![]() =370г
=370г
Жауабы: m (Ca (OH)2) =370г
Егер оқушыға белгілі өлшеммен белгісіз өлшем арасындағы байланыс түсініксіз болса , онда есептің зерттеудің аналитикалық әдісіне көшу керек. Бұл кезде белгісіз өлшемге көңіл аударады, оны қалай анықтау керек, яғни бұл үшін қандай теориялық ілім, заңдылық керек. Бұл сұрақты шешкеннен кейін , белгісіз өлшеммен белгілі өлшем арасындағы тура және жанама байланыстарды анықтайды.
1.Есептің шарты бойынша Ca (OH)2 массасын анықтау керек болса, реакция теңдеуі бойынша қорытынды жасайды,яғни реакцияға 2 мольNH4Cl мен 1 моль Ca (OH)2 әрекеттесіп 1 моль CaCl2 мен 2моль NH3 және 2 моль H2Oтүзеледі.
2 Ca (OH)2 массасынтабу үшін реакцияға қатысқан заттардың төртеуінің біреуінің массасын анықтауға болады, ондай зат аммиак.Оның массасын формула бойынша анықтауға болады. Олай болса Ca (OH)2 массасын аммиактың массасымен салыстыра отырып, анықталады.
Есеп №2
Құрамы 80 магнитті темірден тұратын әрбір тонна темір рудасынан құрамында 95 темір бар 570 кг шойын алуға болады.
Теориямен салыстырғанда шыққан темірдің массалық үлесінің шғымын анықтаңдар.
Аналитикалық әдіс:
Б ерілгені Шойындағы темірдің практикалық массасын
табу
ерілгені Шойындағы темірдің практикалық массасын
табу
m (руда) =1m m(Fe) = 570кг × 0,95 = 541,5кг
m ( шойын) =570 кг 1 тонна рудадағы Fe3O4 массасын табу
W ( Fe) = 0,95 m (Fe3O4) =0,8×1000кг=800кг
W ( Fe3O4) =0,8
Fe3O4 құрамындағы темірдің теориялық массасын
табу.
( Fe3O4) =0,8
Fe3O4 құрамындағы темірдің теориялық массасын
табу.
т/к ![]() (Fe)
- ? 800кг Fe3O4 ---Х кг
(Fe)
- ? 800кг Fe3O4 ---Х кг
232кг Fe3O3 --- 168 кг
х=![]() =579
=579
![]() (Fe) =
(Fe) =
![]() =
=
![]() =
0,94×100%=94%
=
0,94×100%=94%
5
IVХимиялық есептерді шығаруда физикалық математикалық білімдерді пайдалану
Оқушылар химияны оқуға кіріскенде оларда біршама математика мен
физикадан алған білімдері болады және есеп шығарғанда сол
білімдерін пайдаланады.Оқыту процесінде оқушыларға физикалық
шаманы, өлшем бірліктерін пайдалануды үйрету керек.
Есеп шығарғанда қолданатын физикалық шамалардың шартты белгілері , аты , өлшем бірліктері(ауа)
![]() H2
H2
өлшемсіз
Массалық үлес
![]() (омега)
(омега)
%
Зат шығымы
![]() (эта)
(эта)
%
Көлемдік үлес
![]() (фи)
(фи)
%
Химиялық реакция жылдамдығы
![]()
Моль/ л сек
Жылу мөлшері
Q(ку)
Дж
Қысым
![]() (пэ)
(пэ)
Па
Температура
T
T
Кельвин Т = 273 К
Цельсий t=15oC
-
Есеп шығаруда әр типті есептің алгоритімдік жүйесін сақтаған жөн. Сонда оқушылар іс - әрекеттерін бір бағытта жұмсайды.
-
Есептің шартын дұрыс жаза білу есепті шығарудағы ең негізгі болып есептелінеді.
-
Есептегі физикалық шамаларды, оның таңбасын, өлшем бірліктерін дұрыс пайдалана білуге оқушыларды үйрету керек.
V Типтік есептерді шешу үлгілері
Химиялық есептерді шығаруда мұғалім оқушылардың психологиялық жас ерекшелігін, білім деңгейлерін ескеру қажет. Егер оқушылардың кейбір есеп шығарудың білім деңгейі жоғары болса, кейбір есеп шығарудың әдістемелік бөлімдерін ескермей бірден жазылады.
Мысалы
2Al+3H2SO4=Al2(SO4)3+3H2
Формулаларын пайдаланып алюминий мен күкірт қышқылының массасын сутектің көлемін (қ.ж.)есептеу керек.
6
Mr(Al)=27
M(Al)=27г/моль
m(Al)=M×V=27г/моль![]() 2
моль=54 г
2
моль=54 г
Mr(H2SO4)=1×2+32+(16×4)=98
M(H2SO4)=98г/моль
m(H2SO4)= 98г/моль×3 моль=294 г
V = Vm× ![]()
V(H2)=22,4 л/моль×3 моль=67,2л
Осы әрекеттерден кейде ескермей бірден жазуға болады, оқушы түсініп, ойы жүйрік болса
2 Al +3H2SO4=Al2(SO4)3+3H2
54г 294 г 67,2л
Есепті шығару алгоритмі
-
Есептің қысқаша шартын жазу;
-
Реакция теңдеуін құру;
-
Формуланың үстіне берілгенін жазу;
-
Қажетті шаманы тауып формула астына жазу;
-
Зат массасын табу;
Б ерілгені 16 г
ерілгені 16 г
 хг SO2
хг SO2
m(SO2)=16г Na2SO3+ H2SO4= Na2SO4+ H2SO3 64г
т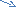
 /к m(Na2SO3) - ? 126г
H2O
/к m(Na2SO3) - ? 126г
H2O
Mr(SO2)=32+(16×2)=64
M(SO2)=64г/моль
m(SO2)= 64г/моль×1 моль=64 г
Mr(Na2SO3 )=(23×2)+32+(16×3)=126
M(Na2SO3 )=126г/моль
m(Na2SO3 )=126г/моль×1 моль=126г
![]() =
=
![]() x=
x=![]() =
31,5 г
=
31,5 г
Жауабы: 16г SO2 алу үшін 31,5 г Na2SO3 керек
7
VI Химия сабағында сандық есептерді жаттығуларды пайдалану әдістемесі
Сандық есептерді, және жаттығуларды
-
Жаңа сабақты түсіндіру кезінде, сабақты бекітуде, үйге тапсырма бергенде, күнделікті білімді тексеруге болады.
-
Қайталау, қорытынды сабақта, өзіндік жұмыстарда, бақылау жұмысында, таңдау, факультативтіктің курсында пайдаланады.
-
Химия пәнінен 8 - 11 класс типтік оқу бағдарламасы бойынша сандық есептер шығаруға 8класта - 10 сағат, 9 класта - 11 сағат, 10 класта - 12 сағат, 11класта - 7сағат берілген.
8 класс
Химиялық формула бойынша қосылыстағы элементтің массалық үлесін есептеу.
1 - есеп
Күкірт қышқылы H2SO4 құрамындағы элементтердің массалық үлестерін есептеңдер.
Есепті 2 тәсілмен шығаруға болады.
-
Дайын формула бойынша
-
Пропорция арқылы.
1 тәсіл
Б ерілгені Массалық үлесін табу формуласы (1)
ерілгені Массалық үлесін табу формуласы (1)
H 2SO4 W(э) = ×100%
2SO4 W(э) = ×100%
W(э) - элементтің массалық үлесі
т/к W(H)-? ![]() (э)-элементтің
атом саны
(э)-элементтің
атом саны
W(S) -?
W(O) -?
1.H2SO4 - салыстырмалы молекулалық массасын табамыз
Mr (H2SO4) = (1×2)+32+(16×4) =98
2.Формула(1) бойынша сутектің, күкірттің оттектің массалық үлесін табамыз.
W(H)=![]() ×100%=0,02×100%=2%
×100%=0,02×100%=2%
W(S)= ![]() ×100%=0,327×100%=32,7%
×100%=0,327×100%=32,7%
W(O)= ![]() ×100%=0,653×100%=65,3%
×100%=0,653×100%=65,3%
Тексеру: 2+32,7+65,3=100%
8
2 - тәсіл
Заттың салыстырмалы молекулалық массасы 100% ке сәйкес деп алып пропорция арқылы элементтердің массалық үлесін табамыз
-
cутектің массалық үлесін табу
98---100% x=![]() 2%
2%
32--- x %
-
күкірттің массалық үлесін табу
98---100% у= ![]() =327,5%
=327,5%
32---у%
-
оттектің массалық үлесін табу
98---100% ![]() =
=![]() =65,3%
=65,3%
64--- ![]() %
%
Жауабы:W(H)=2%
W(S)=32,7%
W(O)= 65,3%
Элементтердің массалық үлестері бойынша заттың қарапайым формуласын табу
2 - есеп
Құрамында элементтердің массалық үлестері мынадай:
Na - 42,1 % , P - 18,9 % , O - 39%
Осы қосылыстың қарапайым формуласын табыңдар
Қосылыстағы натрий атомының санын - х,
фосфор атомының санын - у , оттек атомының санын - Z деп белгілейміз, қосылыс формуласын
9
Nax Py Oz деп жазуға болады. 1)
![]() бөлеміз
бөлеміз
x :y :z = ![]() ÷
÷![]() ÷
÷![]() =1,83÷0,61÷2,44
=1,83÷0,61÷2,44
2) Зат формуласында атом сандарының қатынасы бүтін сандар болу керек. Сондықтан ең кіші санды бірлік ретінде алып, соған бөлеміз.
х:y:z = ![]() ÷
÷![]() ÷
÷![]() =3÷1÷4
=3÷1÷4
Белгісіз заттың формуласы Na3PO4
Жауабы: Na3PO4 натрий фосфатының формуласы
3 - есеп
Заттың құрамында 80% көміртегі, 20% сутегі бар, оның сутегі бойынша тығыздығы 15 - ке тең. Осы заттың формуласын табыңд
Б ерілгені:
ерілгені:
W (C) - 80% x:y = ![]() ÷
÷![]() =6,6÷20=1÷3
=6,6÷20=1÷3
W( H) =20% C H3
D ( H2)=15 Mr (Cx
Hy)= Mr(H2) ×D(H2)
( H2)=15 Mr (Cx
Hy)= Mr(H2) ×D(H2)
т/к: Cx Hy - ? Mr (Cx Hy)=2×15=30
Mr (C H3)=12+(1×3)=15
n = ![]() =2
(2еселеу)
=2
(2еселеу)
 ( C H3)2 C2
H6 этан заттың формуласы
( C H3)2 C2
H6 этан заттың формуласы
4 - есеп
Қаныққан көмірcутектің малекулалық массасы 86 ға тең. Заттың формуласын табыңдар.
Қаныққан көміртектің жалпы формуласы Cn H2n+2
10
Mr (Cn H2n+2)=86
12n+2n+2=86
14n=86-2
14n=84
![]() =
84/14
=
84/14
![]() = 6
C6H2×6+2 ------- C6 H14
гексан
= 6
C6H2×6+2 ------- C6 H14
гексан
Жауабы: Заттың формуласы C6 H14
Жаңа өнімдерінің массасы бойынша заттың малекулалық формуласын табу.
Есеп:
2,3 грамм зат жанғанда 4,4 грамм көміртегі (ІV)оксиді және 2,7 грамм су түзілді. Бұл заттың сутек бойынша тығыздығы 23 ке тең . Осы заттың формуласын табыңдар.
-
Белгісіз заттың малекулалық массасы
Mr(зат) = D (H2) × M (H2)=23×2=46
-
CO2 құрамындағы көміртегінің массасын анықтау
Mr (CO2)= 12+(16×2)=44
44г CO2---12г C х=![]() =1,2г(С)
=1,2г(С)
-
г CO2---xг C
-
H2O құрамындағы сутегі массасын анықтау
Mr (H2O) = (1×2)+16=18
18 г H2O---2 г H х=![]() =0,3г(Н)
=0,3г(Н)
2,7 г H2O---x г H
-
Белгісіз зат құрамындағы оттегінің массасын анықтау.
m (зат)= 1,2г+0,3г= 1,5г
m(О)= 2,3г-1,5г= 0,8г(О)
11
-
2,3 г зат--- 1,2 гС х =
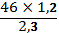 =24г(С)
=24г(С)
46г зат ---хг С
2,3 г зат--- 0,3гН у=![]() =6г(Н)
=6г(Н)
46г зат ---у г Н
2,3 г зат---0,3гН z=![]() =16г(O)
=16г(O)
46г зат--- z г О
х:y:z=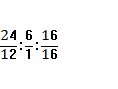 =2:6:1
=2:6:1
С хНуО z
С2Н6О
хНуО z
С2Н6О
немесе бес амалды былай орындауға болады
х:y:z = =0,1:0,3:0,05
х:y:z==2:6:1
С2Н6О этил спирті немесе диметил эфирі СН3 - О - СН3
Mr (С2Н6О) = (12×2)+(1×6)+16 =46
Теорияның мүмкіндікпен салыстырғандағы реакция өнімінің шығымына байланысты есептеулер
а) Бастапқы затпен реакция өнімі бойынша теориялық шығымды есептеу
Есеп:
10кг натрий гидроксидін кремнийдің оксидімен қосып балқытқанда 12,2кг натрий силикаты алынды. Натрий силикатының теориялық шығымын есептеңдер.
 Берілгені: 10кг xкг
Берілгені: 10кг xкг
m(NaOH)=10кг 2 NaOH+ SiO2= Na2SiO3+ H2O
m (Na2SiO3)=12,2кг 80кг
122кг
(Na2SiO3)=12,2кг 80кг
122кг
т/к![]() ()
Mr(NaOH)=23+16+1=40
()
Mr(NaOH)=23+16+1=40
M(NaOH)=40кг/моль
m(NaOH)= 40кг/моль×2моль=80кг
12
Mr (Na2SiO3)=(23×2)+28+(16×3)=122
M(Na2SiO3)=122кг/моль
m(Na2SiO3)= 122кг/моль×1 моль=122кг
![]() =
=
![]() x=
x=![]() =15,25кг
=15,25кг
15,25кг---100% х=![]() =80%
=80%
12,2кг---х%
Жауабы: ![]() (Na2SiO3)=80%
(Na2SiO3)=80%
б) Теориялық шығымы 80% болса, массасы 31 кг кальций фосфатына күкірт қышқылымен әсер еткенде алынатын фосфор қышқылының массасын есептеңдер
Б ерілгені: 31кг x
ерілгені: 31кг x
m(Ca3(PO4)2)=31кг Ca3(PO4)2+3 H2SO4= 3CaSO4+ 2H3 PO4
![]()
 (H3PO4)=80% 310кг
98кг
(H3PO4)=80% 310кг
98кг
т/к m(H3PO4)![]() =
=![]()
х=![]() =19,6кг
=19,6кг
19,6кг---100% х=![]() =15,6кг
=15,6кг
х кг---80%
Жауабы: m(H3PO4)=15,68кг
әрекеттесуші заттардың біреуі артық мөлшерде берілгенде реакция теңдеуі бойынша реакция өнімін есептеу
Есеп: 20кг магний оксиді 94,5 г азот қыщқылымен әрекеттескенде түзілген тұздың массасын есептеңдер
13
 Берілгені: 20г 94,5г xг
Берілгені: 20г 94,5г xг
m(MgO)=20г MgO+2HNO3= Mg(NO3 )2+ H2 O
m(HNO3)=94,5г Бастапқы заттардың әрқайсысының молярлық массасын, зат мөлшерін, зат
т /к m(Mg(NO3)2-? мөлшерін
табамыз
/к m(Mg(NO3)2-? мөлшерін
табамыз
Mr(MgO)=40 Mr(НNO3)=63
M(MgO)=40г/моль M(HNO3)=63г/моль
![]() (MgO)=
(MgO)=![]() =0,5моль
=0,5моль
![]() (HNO3)=1,5моль(артық)
сондықтанесептеуді MgO бойынша жүргіземіз
(HNO3)=1,5моль(артық)
сондықтанесептеуді MgO бойынша жүргіземіз
Mr(Mg(NO3)2=148
M(Mg(NO3)2=148 г/моль
Формула бойынша m=M×![]() есептеу
есептеу
M(Mg(NO3)2=148 г/моль×0,5 моль=74г
немесе пропорция арқылы есептеуге болады.
![]() =
=
![]() х=
х=![]() =74г
=74г
Жауабы: m Mg(NO3 )2 =74г
Құрамында қоспасы бар заттардан алынған өнімнің массасын табу
Өндіріске байланысты есептерде көбінесе берілген шикізаттың құрамында қоспасы болып келетін мәліметтер болады. Бұл қоспалар өндірістік үрдіс кезінде тиісті өнімге айнала алмайды. Сондықтан да тиісті өнімге айналатын таза заттың массасын анықтау қажет болады.Оны формула арқылы анықтайды.
W(таза заттың)=m(таза зат/ m(қоспа)
m(таза зат/= m(қоспа)×W(таза зат)
Есеп: Құрамында 35% қоспасы бар 50 m фосфорит заводқа әкелінді
Таза кальций фосфатының массасын табыңдар.
Рудадағы таза кальций фосфатының мөлшерін табу.
14
100 %-35%=65%
W(қоспа)=35% немесе 0,35
W Ca3(PO4)2 =65% немесе 0,65
m Ca3(PO4)2 =50m×0,65=32,5m
m(қоспа)=50 m×0,35=17,5m
m(Ca3(PO4)2)=50m-17,5m=32,5m
Жауабы: mCa3 (PO4)2=32,5m
Ерітіндіге байланысты есептеулер
Ерітіндідегі заттың массалық үлесін есептеуге арналған формулалар
1.Еріген заттың массалық үлесін есептеу
W(еріген)=![]() 100%
100%
2.Еріген заттың массасын есептеу
m(ер зат)=W(ер.зат)×m(ерітінді)
3.Ерітіндінің массасын табу
m(ерітінді)= ![]()
немесе m(ерітінді)=
немесе m(ерітінді)=m(ер.зат)+m(еріткіш)
5.Еріткіштің массасын табу
m(еріткіш)= m(ерітінді)- m(ер зат)
6.Еріткіштің массалық үлесін табу
W(еріткіш)=100%- W(ер зат)
15
Есеп: Медицинада массалық үлесі 0,2% калий перманганатының ерітіндісін қолданады. Массасы 800г ерітіндіні дайындау үшін қанша марганцовка және су қажет?
W(KMnO4)=0,2%
m(ері)=800г
табу керек m(H2 O)-?
m(KMnO4)-?
100г ерітінді ---0,2г KMnO4
800г ер-і ---хг KMnO4
х=![]() =1,6г
=1,6г
m(KMnO4)=1,6г
m(H2 O)=800-1,6=798,4г (мл)
судың тығыздығы 1 г/мл болғандықтан m(H2 O) = V
(H2 O) ×![]()
m(H2 O)=798,4г(мл)× 1 г/мл= 798,4 мл
Жауабы: m(H2 O)=798,4г(мл)
m(KMnO4)=1,6г
Есеп: Массасы 20г тұзды 180г суда еріткенде түзілген ерітіндідегі тұздың массалық үлесін есептеңдер
1.Ерітінді массасын табамыз.
m(ер-і)=180г+20г=200г
2.Тұздың массалық үлесін табамыз.
W(тұз)=![]() 10%
10%
Жауабы: W(тұз)=10%
16
Сапалық есептер шығару
Берілген мөлшердегі ертінділерді дайындау
І Проценттік концентрациясы берілген ерітінді дайындау
Есеп: Кристаллогидраттар негізінде ертінділер дайындаған кезде оның құрамындағы суды ескере отырып есептеулер жүргізу керек.
Мысалы, мыс купоросын пайдаланып массасы 200г 0,08 мыс (ІІ) сульфатының ертіндісін дайындау
-
Алдымен қажетті сусыз мыс сульфатының массасын табамыз.
m (CuSO4) = 200×0,08=16
-
Оған сәйкес мыс купоросының массасын есептейміз.
3.16г хг
CuSO4--- CuSO4×5Н2О
160г 250г
![]() =
=![]() х=
х=![]() =25(г)
=25(г)
3.Қосатын судың массасы
m(H2 O)=200-250 = 175г немесе 175 мл (судың тығыздығын 1г/мл деп аламыз)
Қажетті ертіндіні дайындау үшін 25 г мыс купоросын таразыға өлшеп алып , оны 175 мл суда ерітеміз.
6 - есеп: ІІ Концентрлі ерітіндіден сұйытылған ерітінді дайындау.
Концентрлі күкірт қышқылынан (96 % H2SO4) оның 500 мл 10 %ерітіндісін дайындау.
1.Анықтамалық кестелерден күкірт қышқылының сулы ерітінділерінің тығыздықтары мен оларға сәйкес концентрацияларын табамыз.
Мысалы , анықтамалық кестелер бойынша 96 % H2SO4 ертіндісінің тығыздығы 1,836 г/см3
2.Көлемі 500мл 10% ерітінді дайындау үшін есептеу жүргіземіз
Ертіндінің массасын табу
m(ерітінді) = V ерітінді×![]() 500мл
× 1,066 г/ мл =533г
500мл
× 1,066 г/ мл =533г
Ондағы сусыз H2SO4 массасы
533 г--100% х=![]() =55,3г
=55,3г
хг--10 %
17
Құрамында 53,3 г H2SO4 болатын концентрлі ерітіндінің массасы
100г -- 96г х=![]() =55,3
=55,3
хг --53,3г
Оның көлемі
V=![]() =
=
![]() ==30,23г
==30,23г
3) Шамамен 450 мл суға концентрлі ертіндінің есептелген көлемін 30,23 мл аз - аздан араластыра отырып қосамыз. Ерітінді бөлме температурасына дейін суыған соң оның көлемі 500мл дейін жеткенше дистильденген су қосып араластырамыз сосын ыдыстың сыртына заттың формуласын концентрациясы және дайындалған күні жазылған этикетка жапсырамыз.
III Молярлық концентрациялары берілген ертінділерді дайындау
Есеп: Мыс купоросынан концентрациясы 0,1 моль/л , көлемі 500мыс (ІІ) сульфатының ертіндісін дайындау
-
Кристаллогидраттың (CuSO4×5Н2О) қажетті массасын есептейміз
m= C×M×V = 0,1 моль/л × 250г/ моль ×0,5 л = 12
Кристаллогидраттың өлшендісін сыйымдылығы 500 мл колбаға воронка арқылы саламыз және дистильденген сумен шаямыз. Шайынды колбаның ішіне бару керек. Үстіне колбаның белгі сызығына сәл жеткізбей су құямыз. Ертіндінің менискісі өлшеуіш колбаның белгі сызығына сәйкес келу керек.
І![]() Ертінділерді сұйылтуға есеп шығару
Ертінділерді сұйылтуға есеп шығару
Ерітінділерді сұйылтуға арналған есептерді шығаруда қолданылатын формула
W(ер.зат)=
Есеп: Натрий гидроксидінің массалық үлесі 10% немесе (0,1) массасы 45г ерітіндісіне 105г су қосылды.Алынған ерітіндідегі натрий гидроксидінің массалық үлесі қандай?
W(NaOH)=![]() =
=![]() =0,03
немесе 3%
=0,03
немесе 3%
Жауабы:W(NaOH) =3%
V. Ерітінділерді араластыруға есеп шығару
Ерітінділерді араластыруға байланысты есептерді мына формулаларды пайдаланып шығаруға болады.
W(ер.зат) =
18
Есеп: Натрий хлоридінің массалық үлесі 0,05 массасы 100г ерітіндімен құрамында натрий хлоридінің массалық үлесі 0,15 массасы 300г ерітіндісі араластырылды. Алынған ерітіндідегі тұздың массалық үлесін есептеңдер
Б ерілгені:
ерілгені:
W1(NaCL)=0,05 W(NaCl)=![]() =
=![]() =
=![]() =0,125
=0,125
W2(NaCL)=0,15 Жауабы: W(NaCl)=0,125немесе 12,5%
m1(ері)=100г
m 2(ері)=300г
2(ері)=300г
табу керек: W(NaCl)
Есеп: Тұз қышқылының массалық үлесі 15% массасы 300г ерітіндісін дайындау үшін тұз қышқылының массалық үлесі 20% және 12% екі ерітіндісінің қандай массаларын араластыру қажет
Есепті "Крест ережесі," немесе "Пирсон квадраты," әдісімен шығару жеңілдеу 1.Диагональдың сол жағындағы жоғары және төменгі бұрыштарына бастапқы есептің шарты бойынша берілген екі ерітіндінің массалық үлестерін W1 мен W2 (20% және 12%) диагональдың қиылысқан ортасына дайындалатын ерітіндінің (3-ерітінді) массалық үлесін W3(15%) жазамыз.
2. Диагональдың оң жақтағы бұрыштарына, диагональдың бойына орналасқан сандардың (массалық үлестердің) айырымдарын(үлкен саннан кішісін алып)жазамыз:
2
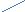

 0 3 W1 W3 - W2
0 3 W1 W3 - W2
 15
15 

 яғни W3
яғни W3
12 5 W2 W1 - W3
3. Бұл айырым сандар бастапқы ерітінділердің салмақ бөліктерін (c.б.) көрсетеді, яғни 20 ерітіндінің 3 c.б. мен 12% ерітіндінің 5 c.б. алып, барлығы.
3 c.б.+5 c.б.=8 c.б. ерітінді дайындау керек олай болса 8 c.б.=300г
1 c.б.=![]() =37,5г
=37,5г
4.Тапқан c.б. мәндерін c.б. санына көбейтіп, бастапқы ерітінділердің массасын табамыз:
m1(ері)=37,5×3=112,5г
m2(ері)=37,5×5=187,5г
19
Есепті тексеру:
m3(ері)= m1(ері)+ m2(ері)=112,5+187,5=300г
Жауабы: m1(ері)=112,5г
m2(ері)=185,7г
Химиялық заттарды бір-бірінен ажырата білуге эксперименттік есептер шығару
1.Тұз ерітінділері кұйылған сынауықтардың қайсысында темір(ІІІ) хлориді, мыс(ІІ) хлориді, кальций хлориді бар екенін анықтаңдар.
Әр ерітінді құйылған сынауыққа аммоний тиоцианатын тамызамыз. Нәтижесінде қызыл-қан түске өзгерген сынауықта-темір(ІІІ) хлориді, қара түске өзгергені -мыс(ІІ) хлориді ал ешқандай эффект байқалмаған сынауықтағы кальций хлориді
FeCl+3NH4CNS=Fe(CNS)3+3NH4Cl
қызыл қан тусті
CuCl2+2NH4CNS=Cu(CNS)2+2NH4Cl
қара түс
Немесе:
Әр сынауыққа NaOH тамызамыз.Қызыл-қоңыр тұнба түзілген сынауықтағы темір(III) хлориді, қөгілдір түсті тұнба түзілген мыс(II) хлориді ал реакция жүрмей, өзгеріссіз қалған сынауықта- кальций хлориді болған
F eCl3+3NaOH=Fe(OH)3 +3NaCl
eCl3+3NaOH=Fe(OH)3 +3NaCl
қызыл-қоңыр
C uCl2+2NaOH=Cu(OH)2 +2NaCl
uCl2+2NaOH=Cu(OH)2 +2NaCl
көгілдір
С aCl2+NaOH=
aCl2+NaOH=
Түзілген темір(ІІІ) гидроксидін қыздырсақ күрең-қоңыр түсті
темір(ІІІ) оксиді, ал мыс(II) гидроксидін қыздырсақ қара түсті
мыс(II) оксиді түзіледі![]()
![]()
2Fe(OH)3=Fe2O3+3H2O
күрең-қоңыр
Сu(OH)2=CuO+H2O
қара 20
Заттың сапалық құрамын анықтауға эксперименттік есептер шығару
1.Хлорид ионға сапалық реакция
Төрт сынауыққа 5-7 тамшыдан мынадай: бірінші сынауыққа-кальций хлориді, төртіншісіне-натрий хлориді ерітінділерін құйыңдар.
Әр сынауыққа 2 тамшыдан күміс нитратының ерітіндісін қосыңдар.
Барлық сынауықтағы нәтижелерді салыстырыңдар.
Ұқсастық байқала ма? Оны немен түсіндіруге болады? Барлық жүрген реакциялардың молекулалық және иондық түрде теңдеулерін жазыңдар.Барлық иондық теңдеулекрді өзара салыстырыңдар.
Әр сынауыққа 1 тамшы концентрлі азот қышқылын қосыңдар.
Өзгеріс байқала ма? Күміс хлоридінің қышқылдық ортадағы жай-күйі туралы не айтуға болады? Хлор анионына Cl қандай ион реактив болатынына қорытынды жасаңдар.
Шешуі:
Қажетті реактивтер мен құрал-жабдықтар: кальций хлориді, барий хлориді, калий хлориді, күміс нитраты, концентрлі азот қышқылы ерітінділері, сынауықтар.K
Сынауықтарға ерітінділерді құйып, оларға күміс нитратының ерітіндісін қосқанда төрт сынауықта да бірдей ірімшік тәрізді ақ тұнба түзіледі. Себебі, реакция нәтижесінде төрт сынауықта да түзілген зат бірдей-күміс хлориді AgCl.
Бірінші сынауықта:
CaCl2+2AgNO3=2 AgCl![]() +
Ca(NO3)2 молекулалық теңдеу
+
Ca(NO3)2 молекулалық теңдеу
2Cl-+2Ag+ =2AgCl![]() қысқартылған
иондық теңдеу
қысқартылған
иондық теңдеу
Екінші сынауықта:
BaCl2+2AgNO3=2AgCl![]() +
Ba(NO3)2 молекулалық теңдеу
+
Ba(NO3)2 молекулалық теңдеу
2Сl-+2Ag+=2AgCl ![]() қысқартылған
иондық теңдеу
қысқартылған
иондық теңдеу
21
Үшінші сынауықта:
KCl+AgNO3=KNO3+AgCl![]() молекулалық
теңдеу
молекулалық
теңдеу
Cl-+Ag+=AgCl қысқартылған иондық теңдеу
Төртінші сынауықта:
NaCl+AgNO3=NaNO3+AgCl![]() молекулалық теңдеу
молекулалық теңдеу
Cl+Ag=AgCl![]() қысқартылған
иондық теңдеу
қысқартылған
иондық теңдеу
Бұдан әрі, сынауыққа концентрлі азот қышқылын қосқанда ешқандай өзгеріс байқалмайды. Демек, күміс хлориді азот қышқылында ерімейді.
Хлор анионына Cl- күміс ионы Ag+ реактив болып табылады.
-
Сульфат-ионына сапалық реакция
Бір сынауыққа сұйытылған күкірт қышқылын, екіншісіне натрий сульфатын құйыңдар және әрқайсысына барий хлориді немесе нитраты ерітіндісін қосыңдар.
Түзілген тұнбаның құрамы қандай? Реакцияның молекулалық, толық және қысқартылған иондық түрде теңдеуін жазыңдар.
SO 42- ионына қандай ион реактив болып табылады?
Шешуі:
Қажетті реактивтер мен құрал-жабдықтар: сұйытылған күкірт қышқылы, натрий сульфаты, барий хлориді немесе нитраты ерітінділері, сынауықтар.
Реакция нәти+жесінде екі сынауықта бірдей, Ba2+ және SO42-
иондарынан құрылған ерімейтін ақ тұнба түзіледі.
-
Бірінші сынауықта:
H2SO4+BaCl2=BaSO4
 +2HCl молекулалық теңдеу
+2HCl молекулалық теңдеу
SO42-+Ba2+=BaSO4
 қысқартылған иондық теңдеу
қысқартылған иондық теңдеу
22
 Екінші сынауықта:
Екінші сынауықта:
 NaSO4+BaCl2=BaSO4 +2NaCl
молекулалық теңдеу
NaSO4+BaCl2=BaSO4 +2NaCl
молекулалық теңдеу
SO42-+Ba2+=BaSO4 қысқартылған иондық теңдеу
Демек, SO42-+Ba2+ катионы реактив болып табылады.
-
Нитрат- ионына сапалық реакция
Сынауыққа 0,5г натрий нитратын (немесе басқа нитратты) салып, тұзды толығымен жабатындай етіп концентрлі күкірт қышқылының ерітіндісін құйыңдар, содан кейін біраз мыс ұнтағын қосып
қыздырыңдар. Қандай газ бөлінеді? Сынауықтағы ерітінді неге көгереді? Реакция теңдеуін жазып, электронды баланс әдісімен коэффициенттерін қойыңдар. Тотықтырғыш пен тотықсыздандырғышты көрсетіңдер.
Шешуі:
Қажетті реактивтер мен құрал-жабдықтар: құрғақ натрий нитраты, концентрлі күкірт қышқылы, мыс ұнтағы, сынауықтар, таразы, қалақша.
Реакция нәтижесінде қоңыр-қошқыл газ бөлінеді. Сынауықта көк түсті мыс(ІІ) сульфаты түзіледі:
2NaNO3+4H2SO4+3Cu=3CuSO4+2NO
 +4H2O+Na2SO4
+4H2O+Na2SO4
2NO3-+8H++3Cu=3Cu2++4H2O+2NO
2NO
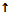 +O2=2NO2
+O2=2NO2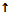
Демек,
2NaNO3+2H2SO4+Cu=CuSO4+2NO2 +2H2O+Na2SO4
Осы теңдеуді электрондық баланс әдісімен теңестірсек:
+5 0 +2 +4
2NaNO3+2H2SO4+Cu=CuSO4+2NO2
 +2H2O+Na2SO4
+2H2O+Na2SO4

Тотықсыздану N+5+1ê=N+4 2
Тотығу Cu0-2ê=C+2 1
2N+5+Cu0=N+4+Cu2+
Бұдан көрініп тұрғандай, азот (нитрат ионы)- тотықтырғыш,ал мыс-тотықсыздандырғыш.
23
О
 сы теңдеуді электрондық-иондық әдіспен
теңестірер болсақ:
сы теңдеуді электрондық-иондық әдіспен
теңестірер болсақ:
NO3-+2H++ ê=NO2
 +H2O 2
+H2O 2
Cu0-2ê=Cu2+ 1
Яғни,
2NO3-+4H++Cu0=2NO2
 +2H2O+Cu2+
+2H2O+Cu2+
-
Фосфат-ионға сапалық реакция.
Сынауыққа 1-2 мл ортофосфор қышқылының ерітіндісін құйып,осындай мөлшерде күміс нитратының ерітіндісін қосыңдар. Не байқалады? Реакция теңдеуін жазыңдар.
Шешуі:
Қажетті реактивтер мен құрал-жабдықтар: ортофосфор қышқылы, күміс нитраты ерітінділері, сынауықтар.
Фосфат ионына PO43- күміс Ag+ катионы сапалық реактив болып табылады. Сондықтан, ортофосфор қышқылының ерітіндісіне күміс нитратының ерітіндісін қосқанда сары тұнба түзіледі:

 H3PO4+3AgNO3=Ag3PO4
+3HNO3
H3PO4+3AgNO3=Ag3PO4
+3HNO3
PO43-+3Ag+=Ag3PO4
5.Карбонат-ионға сапалық реакция.
Сынауыққа 1 мл натрий карбонаты ерітіндісін және осындай көлемде барий хлориді ерітіндісін құйыңдар. Не байқалады? Реакцияның толық және қысқартылған иондық теңдеулерін жазыңдар.
Сынауыққа 1 мл натрий карбонаты ерітіндісін құйып, бірнеше тамшы күміс нитратын қосыңдар. Не байқалады? Реакцияның толық және қысқартылған иондық теңдеуін жазыңдар.
Түзілген тұнбаға 0,5мл сұйытылған азот қышқылының ерітіндісін қосыңдар. Не байқалады? Реакцияның толық және қысқартылған иондық теңдеулерін жазыңдар.
Шешуі:
Қажетті реактивтер мен құрал-жабдықтар: натрий карбонаты, барий хлориді,күміс нитраты, сұйытылған азот қышқылы ерітінділері, сынауықтар.
Натрий карбонатының ерітіндісіне барий хлоридінің ерітіндісін қосқанда ақ барий карбонатының тұнбасы түзіледі:
24
Na 2CO3+BaCl2=BaCO3
 +2NaCl молекулалық теңдеу
+2NaCl молекулалық теңдеу
2Na++CO32-+Ba2++2Cl-=BaCO3
 +2Na++2Cl- толық иондық теңдеу
+2Na++2Cl- толық иондық теңдеу
CO32-+ Ba2+= BaCO3
 қысқартылған иондық теңдеу
қысқартылған иондық теңдеу
Ал күміс нитратының ерітіндісін қосқанда ақ күміс карбонатының тұнбасы түзіледі:
Na 2CO3+2AgNO3=Ag2CO3
 +
2NaNO3молекулалық теңдеу
+
2NaNO3молекулалық теңдеу
2Na++CO32-+2Ag++2NO3- -=Ag2CO3
 +2Na++2NO3-
толық иондық теңдеу
+2Na++2NO3-
толық иондық теңдеу
CO32-+2Ag+= Ag2CO3
 қысқартылған иондық теңдеу
қысқартылған иондық теңдеу
Ag2CO3= Ag2O
 +CO2
+CO2
қара тұнба
Түзілген тұнбаға сұйытылған азот қышқылының ерітіндісін қосқанда жүретін реакция теңдеулері:
BaCO3
 +2HNO3(сұйы)=
Ba(NO3)2+Н2O+CO2
+2HNO3(сұйы)=
Ba(NO3)2+Н2O+CO2
Ag2CO3
 +
2HNO3(сұйы)=2
AgNO3+ Н2O+CO2
+
2HNO3(сұйы)=2
AgNO3+ Н2O+CO2
6.Аммоний ионына сапалық реакция
Сынауыққа 5-7 тамшы аммоний сульфаты ерітіндісін құйып, 1-2 тамшы концентрлі сілті ерітіндісін қосыңдар.
Дымқыл лакмус немесе фенолфталеин қағазын дайындаңдар. Сынауықтың қабырғасына тигізбей шетіне индикатор қағазын ұстап тұрып, сынауықтағы қоспаны қыздырыңдар.
Индикатордың түсі өзгерді ме? Неге? Аммоний ионына қандай реакция сапалық болып табылатыны туралы қорытынды жасаңдар.
1 мл еритін алюминий тұзы ерітіндісіне 1 тамшы сілті ерітіндісін қосыңдар. Не байқалды? Содан кейін тағы да бірнеше тамшы сілті ерітіндісін қосыңдар. Жүрген реакцияның теңдеуін жазыңдар.
Аммоний тұздарын танып-білу туралы қорытынды жасаңдар.
Шешуі:
Қажетті реактивтер мен құрал-жабдықтар: аммоний сульфатының ерітіндісі, концентрлі сілті ерітіндісі, алюминий тұзының ерітіндісі, индикаторлар, спиртшам, сынауықтар.
25
А
 ммоний сульфатының ерітіндісіне
концентрлі сілті ерітіндісін қоссақ:
ммоний сульфатының ерітіндісіне
концентрлі сілті ерітіндісін қоссақ:
(NH4)2SO4+2NaOH(конц)=Na2SO4+2NH3 + 2H2O
Реакция нәтижесінде бөлінген газ сілтілік қасиеттер көрсететін болғандықтан дымқылданған лакмус қағазы-көк түске, ал дымқылданған фенолфталеин қағазы - таңқурай түске өзгереді(1-кесте(8-бетте)). Аммоний тұзын реакция нәтижесінде бөлінетін аммиактың иісінен байқаймыз. Демек, аммоний ионына концентрлі сілті ерітіндісі сапалық реактив болып табылады.
Алюминий тұзы ерітіндісіне сілті ерітіндісін қосқанда жүретін реакция теңдеуі:
 AlCl3+3NaOH=Al(OH)3 +3NaCl
AlCl3+3NaOH=Al(OH)3 +3NaCl
Түзілген алюминий гидроксиді сілтінің артық мөлшерінде еріп, комплексті қосылыс-натрий тетрагидроксоалюминатын береді;
Al(OH)3+NaOH=Na [Al(OH)4]
«Бейметалдар» тақырыбына эксперименттік есептер
1-есеп. Нөмірленген үш сынауықта келесі заттардың құрғақ үлгілері берілген: натрий сульфаты, магний сульфаты және аммоний сульфаты. Қай сынауықта аммоний сульфаты бар екенін тәжірибелік жолмен анықтаңыздар.
Шешуі:
Қажетті реактивтер мен құрал-жабдықтар: натрий сульфаты, магний сульфаты және аммоний сульфатының құрғақ үлгілері, концентрлі сілті ерітіндісі, спиртшам, сынауықтар.
Берілген заттардың аниондары бірдей (сульфат) болғандықтан, оларды бір бірінен ажырату үшін катиондарының химиялық қасиеттерінің айырмашылықтарына сүйенеміз. Мысалы, олардвы натрий гидроксиді ерітіндісінің әсері мен олардың тұздарының жалынға әсері бойынша анықтауға болады. Тәжірибелер кезінде байқалатын эффектілерді көрнекі болу үшін төмендегідей теориялық кестеге жинауға болады.Na2SO4
-
сары түске
боялады
жалын сары түске
боялады
MgSO4
M

 g(OH)2 ақ тұнба
g(OH)2 ақ тұнба
-

 ақ түсті тұнба түзіледі
ақ түсті тұнба түзіледі
(NH4)2SO4
NH3
-
иісті газ бөлінеді
26
Реакция теңдеуері:

 Na2SO4+NaOH(конц)
Na2SO4+NaOH(конц)
MgSO4+2NaOH(конц)=Mg(OH)2 +Na2SO4
(NH4)2SO4+2NaOH(конц)=Na2SO4+2NH3 +2H2O
2-қадам. Тәжірибелік кесте.
Берілген заттарды суда ерітіп, ары қарай олардың ерітінділермен жұмыс істейміз. Енді нөмірленген сынауықтардағы ерітінділермен теориялық кестеде жоспарланған тәжірибелерді жасап, олардың нәтижелерін тәжірибелік кестеге жинастырамыз. Кестені толтырған кезде оның қиылыстарына нөмірленген сынауықтардағы заттарды бір біріне құған кезде байқалатын эффектілерді шартты белгілермен белгілейміз. Мысалы, нәтижелер келесідегідей болсын делік.иісті газ бөлінеді
№2
 ақ тұнба
ақ тұнба
-
 ақ түсті тұнба түзіледі
ақ түсті тұнба түзіледі
№3
-
сары түске
боялады
жалын сары түске боялады
Әдетте, түскен тұнбалардың түсіне және олардың кейбір қасиеттеріне көңіл аударған жөн.
3-қадам. Тәжірибелік кесте мен теориялық кестені салыстыра отырып, қорытынды жасаймыз. Мысалы, осы жағдайда, бірінші сынауықта-аммоний сульфаты, екінші сынауықта-магний сульфаты, ал үшінші сынауықта- натрий сульфаты болғаны.
2-есеп. Берілген зат- аммоний сульфаты екенін тәжірибе жүзінде анықтаңдар.
Шешуі.
Қажетті реактивтер мен құрал-жабдықтар: аммоний сульфаты, концентрлі сілті ерітіндісі, барий хлориді ерітіндісі, барий хлориді ерітіндісі, индикаторлар, сынауықтар, пипетка.
Егер зат құрғақ күйде берілсе, онда оны суда ерітіп (аммоний сульфатының суда ерігіштігі-70,6г/100мл(00 C), 74,4 г/100мл (200C),103,8г/100 мл (1000C)), оның ерітіндісімен жұмыс жасаған жөн. Берілген зат аммоний сульфаты екенін тәжірибе жүзінде анықтау үшін оның 5-7 тамшысын сынауыққа құйып, 1-2 тамшы концентрлі сілті ерітіндісін қосамыз. С
 ынауықтың қабырғасына тигізбей шетіне
дымқыл лакмус немесе фенолфталеин қағазын ұстап тұрып,
сынауықтағы қоспаны қыздырамыз. Реакция теңдеуі:
ынауықтың қабырғасына тигізбей шетіне
дымқыл лакмус немесе фенолфталеин қағазын ұстап тұрып,
сынауықтағы қоспаны қыздырамыз. Реакция теңдеуі:
(NH4)2SO4+2NaOH=Na2SO4+2NH3 + 2H2O
27
Реакция нәтижесінде аммиактың иісі арқылы оның бөлінгенін білеміз. Лакмус қағазын бақылайтын болсақ, оның көк түске боялғанын көреміз (кесте-1). Бұл берілген заттың құрамында аммоний ионының бар екенін көрсетеді.
Бұдан әрі, берілген заттың мөлшеріндей етіп оған барий хлоридін қосамыз. Ақ тұнба түзіледі:
 (NH4)2SO4+BaCl2=BaSO4
+2NH4Cl
(NH4)2SO4+BaCl2=BaSO4
+2NH4Cl
Ақ тұнбаның түзілуі берілген заттың құрамында сульфат ионы SO42- бар екенін көрсетеді
3-есеп. Лакмуспен аммоний нитраты, натрий карбонаты және калий хлориді ерітінділерін сынаңдар және байқалған өзгерісті түсіндіріңдер.
Шешуі:
Қажетті реактивтер мен құрал-жабдықтар: аммоний нитраты, натрий карбонаты және калий хлориді ерітінділері, лакмус қағазы не ерітіндісі сынауықтар.
Заттар ерігенде су молекулаларымен алмасу реакциясына түсіп, гидролизге ұшырайды.
Аммоний нитраты сулы ерітіндісіне лакмус қағазы қызыл түске боялады. Бұдан гидролиз нәтижесінде түзілген орта қышқылдық болатынына көз жеткізуге болады. Гидролиз процесінің молекулалық және иондық теңдеулері:

 NH4NO3+HOH
NH4OH+HNO3(орта қышқылдық)
NH4NO3+HOH
NH4OH+HNO3(орта қышқылдық)
 NH4++HOH
NH4OH+H+
NH4++HOH
NH4OH+H+
Ал, натрий карбонатының гидролизі екі сатыда жүреді.
І саты:
 Na2CO3+HOH
Na2CO3+HOH
 NaOH+CO2
+H2O
NaOH+CO2
+H2O
 CO32-+HOH
CO32-+HOH HCO3-+OH-
HCO3-+OH-
І
 І саты:
І саты:
N

 aHCO3+HOH
NaOH+CO2 + H2O
aHCO3+HOH
NaOH+CO2 + H2O
 HCO3-+ HOH
H2O+CO + OH- орта негіздік
HCO3-+ HOH
H2O+CO + OH- орта негіздік
Негіздік ортада лакмус қағазы көк түске боялады( 1-кесте (8-бетте)).
Ал, калий хлориді KCl гидролизге ұшырамайды, себебі ол күшті негіз бен күшті қышқылдың тұзы. Орта бейтарап болғандықтан лакмус қағазы күлгін түске боялады.
28
4-есеп. Сынауықтарда хлорсутек (тұз), азот және күкірт қышқылы ерітінділері бар. Қай сынауықта қышқыл бар екенін анықтаңдар.
Шешуі:
Қажетті реактивтер мен құрал-жабдықтар : хлорсутек (тұз), азот және күкірт қышқылы ерітінділері, күміс нитраты,барий хлориді ерітінділері, сынауықтар.
Есепті шешу үшін алдымен теориялық кесте құрамыз.
1-қадам. Теориялық кесте.ақ тұнба
HNO3
-
-
-
H2SO4
A
 g2SO4 ақ
g2SO4 ақ
B
 aSO4 ақ
aSO4 ақ

 екі ақ тұнба
екі ақ тұнба
Реакция теңдеулері:
 HCl+AgNO3=AgCl +
HNO3
HCl+AgNO3=AgCl +
HNO3
 HNO3+AgNO3≠
HNO3+AgNO3≠
H2O4+2AgNO3=Ag2SO4 +2HNO3
HCl+BaCl2≠
2HNO3+BaCl2=Ba(NO3)2+2HCl
H
 2SO4+BaCl2=BaSO4
+2HCl
2SO4+BaCl2=BaSO4
+2HCl
2-қадам. Тәжірибелік кесте. Бұдан әрі, теориялық кестеде жоспарланған тәжірибелерді жасай отырып, олардың нәтижелерін тәжірибелік кестеге түсіреміз. Кестені жоғарыдағы (1-есептің 2 қадамындағыдай) тәртіп бойынша толтырамыз. Мысалы, нәтижелер келесідегідей болсын делік:Шешуі:
Қажетті реактивтер мен құрал-жабдықтар: аммоний сульфаты, аммоний хлориді және аммоний нитраты, натрий хлориді, натрий карбонаты, натрий сульфаты, барий хлориді,күміс нитраты,тұз қышқылы ерітінділері, сынауықтар.
Есепті шешу үшін жоғарыдағыдай теориялық және тәжірибелік кестелер құрамыз.
1-қадам. Теориялық кесте.(NH4)2SO4+ BaCl2=BaSO4 + 2NH4Cl
NH4 Cl+ BaCl2≠
2NH4NO3+BaCl2=Ba(NO3)2+2NH4Cl
(
 NH4)2SO4+2AgNO3=Ag2SO4
+2NH4NO3
NH4)2SO4+2AgNO3=Ag2SO4
+2NH4NO3
 NH4Cl+AgNO3=AgCl
+NH4NO3
NH4Cl+AgNO3=AgCl
+NH4NO3
NH4NO3+AgNO3≠
2-қадам.Тәжірибелік кесте. Мұнда нөмірленген сынауықтардағы ерітінділермен теориялық кестеде жоспарланған тәжірибелерді жасап, одан байқалатын эффектілерді тәжірибелік кестеге жинақтаймыз.
Мысалы, нәтижелео төмендегідей болсын делік:ә ) Нөмірленген үш сынауықта тұз ерітінділері бар: натрий хлориді, натрий карбонаты, натрий сульфаты. Қай сынауықта қандай тұз бар екенін анықтаңдар.
Есепті шешу үшін теориялық және тәжірибелік кестелер құрамыз.
1-қадам. Теориялық кесте.NaCl+BaCl2≠
 Na2CO3+BaCl2=BaCO3
+ 2NaCl
Na2CO3+BaCl2=BaCO3
+ 2NaCl
 Na2SO4+BaCl2=BaSO4
+2NaCl
Na2SO4+BaCl2=BaSO4
+2NaCl
NaCl+HCl≠
 Na2CO3+2HCl(сұйық)=2NaCl+CO2
H2O
Na2CO3+2HCl(сұйық)=2NaCl+CO2
H2O
Na2SO4+HCl≠
2-қадам. Тәжірибелік кесте. Мұнда теориялық кестедегі заттардың формулаларының орнына заттар құйылған сынауықтардың нөмірлерін жазамыз. Кестені толтырған кезде оның қиылыстарына нөмірленген сынауықтардың бір біріне құйған кезде байқалатын эффектерді шартты белгілермен белгілейміз. Мысалы, алынған нәтижелер былай болсын делік: олардыШешуі:
Қажетті реактивтер мен құрал-жабдықтар: кальций карбонаты мен натрий карбонатының ұнтақтары, дистилденген су, тұз қышқылы, платина сымы, сынауықтар, спиртшам, шыны таяқша.
Кальций карбонаты мен натрий карбонатының ақ ұнтақтарын ажырату үшін оларды суда еріту қажет.
Натрий карбонаты суда жақсы ериді. Оның осы қасиетін пайдаланып, оны кальций карбонатынан ажыратуға болады.
Бұдан әрі, нақтырақ көз жеткізу үшін екі затты жалыны арқылы да ажыратуға болады. Ол үшін сынауыққа 1 мл тұз қышқылын құйып, оған бірнеше секундқа екі сымды саламыз. Содан соң сымдарды жалынның үстінде түсі өзгергенше ұстап, түсі өзгерген соң сымдарды суытып, оның біреуінің ұшына құрғақ кальций карбонатын,екіншісінің ұшына натрий карбонатының біраз бөлігін іліп аламыз да тұздарды жеке-жеке жалынға апарамыз. Кальций катионы жалынды қызыл-кірпішті түске, ал натрий катионы бар тұз жалынды сары түске бояйды.
7-есеп.а) мыс нитратын; ә) кальций карбонатын екі әдіспен алыңдар.
Шешуі:
Қажетті реактивтер мен құрал-жабдықтар: мыс нитраты, кальций карбонаты, концентрлі азот қышқылы, жаңадан дайындалған кальций гидроксиді, кальций сульфаты ерітінділері, сынауықтар, шыны түтікше.
а) Мыс нитратын алу:
1. Сынауыққа мыс жоңқасының бірнеше кесегін салып, 0,5 мл концентрлі азот қышқылының ерітіндісін қосамыз.
32
Нәтижесінде мыс нитраты алынады.
 Cu+4HNO3(конц)=Cu(NO3)2+2NO2
+2H2O
Cu+4HNO3(конц)=Cu(NO3)2+2NO2
+2H2O
1.Мыс нитратын алу үшін сынауыққа 1-2 мл мыс оксидін құйып, оған сондай мөлшерде азот қышқылын қосамыз.
CuO+2HNO3=Cu(NO3)2+H2O
ә) Кальций карбонатын алу үшін сынауыққа 2-3 мл жаңадан дайындалған кальций гидроксидін құйып, сынауықтағы ерітіндіге шыны түтік арқылы абайлап ауа үрлейміз, Ерітінді лайланады. Бұл кальций карбонатының алынуының белгісі.
 Ca(OH)2+CO2=CaCO3 +
H2O
Ca(OH)2+CO2=CaCO3 +
H2O
1
 .Сынауыққа 1-2 мл кальций сульфатын
құйып, оған 1-2 мл натрий карбонатын қосамыз. Кальций карбонаты
ақ тұнба түрінде алынады:
.Сынауыққа 1-2 мл кальций сульфатын
құйып, оған 1-2 мл натрий карбонатын қосамыз. Кальций карбонаты
ақ тұнба түрінде алынады:
CaSO4+ NaCO3=CaCO3 + Na2SO4
8-есеп. Мынадай айналуларды жүзеге асыру үшін тәжірибе жүргізіңдер:


 a) C CO 2 CaCO3
CO2;
a) C CO 2 CaCO3
CO2;
ә



 ) P P2O5
H3PO4 Na2HPO4
) P P2O5
H3PO4 Na2HPO4
Ag3PO4
Шешуі:
Есепті шешу үшін алдымен реакция теңдеулерін нөмірлеп шығамыз.
1 2 3


 a) C CO2 CaCO3
CO2
a) C CO2 CaCO3
CO2



 ә) P P2O5
H3PO4 Na2HPO4
ә) P P2O5
H3PO4 Na2HPO4
3(a)
Ag3PO4
33
Бұдан әрі, әрбір фрагмент үшін реакцияның бастапқы затының және өнімінің құрамын талдап шығамыз да, бастапқы затпен қандай прлоцесті жүргізгенде көрсетілген өнімді алуға болатынын анықтай отырып, сол процессті жүргізуге қажетті заттарды таңдап аламыз.
а)Бұл тізбектегі өзгерістерді орындау үшін кальцийгидроксидін, көмір түйірлерін, шыны түтікше, темір қасық, спиртшам және сынауықтарды таңдап аламыз.
1.Темір қасыққа бірнеше көмір түйірін салып, оны ауада (600-7000 С) жаққанда көміртек (ІV) оксиді бөлінеді:
C
 +O2= CO2
(600-7000 C, ауада жаққанда)
+O2= CO2
(600-7000 C, ауада жаққанда)
Осы тәжірибеге қажетті заттарды жинап, тәжірибені орындаймыз.
2. Бұдан әрі, сынауыққа 2-3 мл кальций гидроксидін құйып, оған шыны түтікшемен мұқият ауа үрлейміз.
Ерітінді лайланып, ақ тұнба түрінде кальций карбонаты алынады.
 CO2+Ca(OH)2=CaCO3 +
H2O
CO2+Ca(OH)2=CaCO3 +
H2O
3. Бұдан әрі, алынған кальций карбонатын (900-12000C) қыздырамыз. Көміртек (IV) оксиді алынады.
 CaCO3=CaO+CO2
(900-12000C)
CaCO3=CaO+CO2
(900-12000C)
ә) Тәжірибеге қажетті заттарды таңдап аламыз да төмендегі тәжірибелерді жүзеге асырамыз.
1.Фосфордан фосфор ангидридін алу үшін тығыны жоғары арнайы шыны колокол немесе түбі кесілген бөтелке қолданылады.
Колоколдың көлемі 6 бөлікке бөлінген. Оның 5 бөлігі тең болуы тиіс, ал алтыншысы жанама белгіленуі тиіс. Бұл бөлікті колоколдың жанынан 4-5 см-ден төмен алмау керек, өйткені фосфор жанғанда суды іштен ығыстыратын ауа тез кеңейеді. Осылайша колокол суға бірінші сызыққа дейін батырылса, ал қалған көлем 5 бөлікке бөлінеді.
Тәжірибе басында кристаллизаторға суды оның беті колоколдың бірінші бөлігі деңгейінде болатындай етіп құю керек. Суға фарфор тигельден қақпағы бар үлкен тығынды салады немесе тығында тереңдетіп тесік жасайды. Тигельдің қақпағына немесе тесігіне шамалы құрғақ қызыл форфор салады. Колоколды ашады, оны кристализаторда балқитын тығынмен бекітеді. Егер су деңгейі төмендесе, онда оған беті бірінші бөлікке сәйкес келетіндей су құяды. Содан кейін спиртшам жалынымен немесе газды жанарғымен шыны таяқшаны қатты қыздырып, қатты қызған оның соңын колоколға салады және қызыл фосфорға жанастырады. Фосфор жанады. Таяқшаны алып, колоколды тығынмен жабады(тығын резиналы болғаны дұрыс). 34
Фосфор жанады, колокол фосфор ангидридінің ақ түтінімен толады:
4P+5O2=2P2O5
2.Бұдан әрі, 10-15 минуттан кейін фосфорлы ангидридке сссу қосамыз. Фосфор қышқылы алынады:
P2 O5 +3H2 O=2H3 PO4
3.Алынған фосфор қышқылына натрий гидроксидінің ерітіндісін қосқанда натрий гидрофосфаты алынады:
H3 PO4(сұй)+2NaOH(сұй)=Na2HPO4 +2H2O
3(а). Фосфор қышқылына сондай көлемде күміс нитратын қосамыз. Күмістің ортофосфаты сары тұнба түрінде алынады:
H
 3 PO4
+3AgNO3=Ag3 PO4
+3HNO3
3 PO4
+3AgNO3=Ag3 PO4
+3HNO3
Аудандық химия олимпиадаларының тәжірибелік тур есептері
8-2006 ауд. Бес нөмірленген сынауыққа келесі заттардың ерітінділері құйылған: барий хлориді, натрий хлориді, алюминий нитраты, калий карбонаты және күкірт қышқылы. Оптималь жоспар құрып және басқа заттарды пайдаланбай қай сынауыққа қай заттың ерітіндісі құйылғанын анықтаңыздар. Сәйкес реакция теңдеулерін молекулалық және иондық түрде жазыңыздар.
Шешуі:
Теориялық матрица:Al(NO3)3
-
-
*
A

 l(OH)3
l(OH)3
+CO2
-

 +
+
K2CO3
B

 aCO3
aCO3
-
A

 l(OH)3
l(OH)3
+CO2
*







 +
+
H2SO4
BaSO4
-
-
*
+
35
Р
 еакция теңдеулері:
еакция теңдеулері:
1.BaCl2+K2CO3=BaCO3 +2KCl
2
 .BaCl2+H2SO4=BaSO4
+2HCl
.BaCl2+H2SO4=BaSO4
+2HCl
3
 .3K2CO3+2Al(NO3)3+3H2O=2Al(OH)3
+6KNO3 +3CO2
.3K2CO3+2Al(NO3)3+3H2O=2Al(OH)3
+6KNO3 +3CO2
9-2006ауд. Бес нөмірленген сынауыққа келесі заттардың ерітінділері құйылған: Тұз қышқылы, күкірт қышқылы, калий сульфаты,натрий карбонаты, барий хлориді. Оптималь жоспар құрып және басқа заттарды пайдаланбай қай сынауыққа қай заттың ерітіндісі құйылғанын анықтаңыздар. Сәйкес реакция теңдеулерін молекулалық және иондық түрде жазыңыздар.
Шешуі:K2CO3




*



2
 +
+
3

Ba(NO3)2
-


3

Al2(SO4)3
-
-
-



*
2

36
11-2006ауд.Жеті нөмірленген сынауыққа келесі заттардың ерітінділері құйылған: барий хлориді,натрий сульфаты, барий гидроксиді, натрий карбонаты, магний нитраты және күкірт қышқылы. Оптималь жоспар құрып және басқа заттарды пайдаланбай қай сынауыққа қай заттың ерітіндісі құйылғанын анықтаңыздар. Сәйкес реакция теңдеулерін молекулалық және иондық түрде жазыңыздар.
§2.Бейорганикалық заттар жұмбақталған есептер
және оларды шешу үлгілері
№1.Массасы 4г болатын қатты А затын хлормен өңдегенде, қалыпты жағдайда сұйық күйде болатын жалғыз В өнімі алынады. В затын судың артық мөлщеріне енгізген кезде массасы 3 г бастапқы Азаты алынады. Түзілген күшті қышқыл ерітіндісін қыздырған кезде ауа бойынша тығыздығы 2,2 болатын С газы бөлінеді. А затының бастапқы үлгісін тотықтырған кезде, В затын суға енгізгенге қарағанда,С газы 4 есе артық мөлшерде алынады. А,В және С заттарын анықтаңыздар.
Шешуі: Mr(C)=29×2,2=64.Ол күкірт (IV) оксидінің молекулалық массасына тең және ол газ к.үкіртті қышқылды қыздырған кезде бөлінуі мүмкін. Яғни, оттегімен және хлормен әрекеттесетін А затын-күкірт. В заты- күкірт хлориді; SCl2,S2Cl2, SCl4 болуы мүмкін. Галогенидтердің күкіртпен және сумен реакциялары:
2SCl2+3H2O3+4HCl+S; (1)
2S2Cl2+3H2O=H2SO4+4HCl+3S; (2)
SCl4+3H2O=H2SO3+4HCl. (3)
Күкірт хлоридінің формуласын анықтау үшін,күкірттің сумен реакциясы кезінде бастапқы күкірттің тек s-і ғана бөлінетіндігін ескеру керек. Бұл шартқа S2Cl2 жауап береді ((2) теңдеуді қара).
(2) теңдеуден хлормен әрекеттескен күкірттің j бөлігі ғана сумен әрекеттескен кезде SO2 береді. Сонымен, А-күкірт,В-S2Cl2, C-SO2.
№2. А және В жай заттарды өзара реакцияласып, С затын түзеді. С заты көміртек (IV) оксидімен әрекеттескен кезде В және D заттары(құрамында 8,14% көміртегі және 32,5% оттегі бар) түзіледі. А- D заттарын анықтаңыздар және реакция теңдеулерін жазыңыздар.
37
Шешуі: Көміртек атомының 1 молі бар заттың массасын есептейік: 12/0,0814=147,4 г/моль. Осы заттағы оттегінің үлесі:147,4×0,325=48г. Яғни, заттың құрамында карбонат-ион СO32- бар.
Егер D затының құрамындағы металл бір валентті болса, онда оның молярлық массасы(147,4-60)/2=43,7г/моль. Ондай металл жоқ.
Егер металл екі валентті, онда оның молярлық массасы 147,4-60=87,4г/моль. Металл- стронций. Түзілген өнім D-SrCO3, A-SrO, B-H2O, C-Sr(OH)2.
Реакция теңдеулері:
SrO+H2O=Sr(OH)2;
 Sr(OH)2+CO2=SrCO3
+H2O.
Sr(OH)2+CO2=SrCO3
+H2O.
№3. Қатты В затының сумен реакциясының нәтижесінде түзілген А газы оттегімен әрекеттесе отырып, С,D, (көп мөлшерде)және E (салыстырмалы молекулалық массалары 18,19,20) заттарды түзіледі. А газы натриймен әрекеттескен кезде эквимолярлы мөлшерде В және Ғ заттардын түзеді. Осы заттар сумен А және G газдар қоспасын түзеді және оларды оттегінде жаққан кезде С, D заттарының көп мөлшерде және Е заты түзіледі. Қандай заттар туралы айтылған және реакция бағытын түсіндіріңіздер.
Шешуі: А газы- сутегі. В және Ғ заттарының - гидридтер, ал С- су екендігі айқын көрініп тұр. Ал молярлық массаларында бір-екі бірлікке айырмашылық болғандығы С,D және Е заттары-+сутектің әр түрлі изотоптарынан тұратын оксидтер (H2O, HDO, D2O) деген ойға әкеледі. реакция теңдеулері:
NaD(B)+H2O=HD(A)+NaOH; (1)
4HD(A)+2O2=H2O(C)+2HDO(D)+D2O(E); (2)
HD(A)+2Na=NaH(F)+NaD(D); (3)
NaH(F)+NaD(D)+2H2O=H2(G)+HD(A)+2NaOH; (4)
HD(A)+H2(G)+O2=H2O(C)+HDO(D)+D2O(E); (5)
(2) HDO артық мөлшерде болуы стастикалық фактормен түсіндіріледі: кез келген су алу механизмінде HDO түзілу мүмкіндігі жоғары. Ракция өнімдерінде D2O аз мөлшерінің түзілуі де осы себептен.
38
№4. Химияның көптеген салаларында қолданыс тапқан және атауы қосылыстарының ерекшеліктеріне байланысты Х химиялық элементі бар. А қосылысының құрамында 41,3% Х эленті, 11,1% азот, 3,2% сутек және 44,4% оттегі бар. А қосылысын қыздырған кезде тез ыдырайды және су, газ тәрізді В заты мен қатты С қалдығы түзіледі. Осы зат жай Х затының хлормен реакциясы кезінде де түзіледі. D затының сулы ерітіндісінен Е заты кристалданады және осы заттың массалық үлесі бойынша құрамы: 40,57% су, 39,32% хлор және 19,51% Х элементі, бөліну жағдайларына байланысты Е затының түсі әр түрлі болады. Қандай элемент және қандай қосылыстар туралы сөз қозғалғандығын анықтаңыздар
Реакция теңдеулерін жазыңыздар.
Шешуі: Х элементін D тұзының кристаллогидраты- Е қосылыс арқылы анықтау ыңғайлы. Е қосылысының құрамы: XCl6×bH2O. Есеп шарты бойынша 19,51/Х: 39,2/35,5=1:б, осыдан Х=17,33б; егер б =3,Х=52, бұл элемент -хром. Яғни, тұзы - CrCl3E-CrCl3×6 H2O (су молекуласының санын жоғарыдағы әдіспен табуға болады).
Қосылыстың формуласы N2H8Cr2O7, (NH4)2 Cr2O7; N:H:O:Cr= =11.1/14:3,2/1:44.4/1:41.3/52=2:8:7:2
Реакция теңдеулері:


 (NH4)2Cr2O7
N2 +4H2O +Cr2O3;
(NH4)2Cr2O7
N2 +4H2O +Cr2O3;
 Cr2O3+3C+3Cl2
2CrCl3+3CO ;
Cr2O3+3C+3Cl2
2CrCl3+3CO ;
C
 rCl3+6H2O
CrCl3×6H2O.
rCl3+6H2O
CrCl3×6H2O.
№5. Ұшқыш А сұйықтығының буларын қыздырылған құбыр арқылы өткізеді. Құбырда массасы 58,7 мг жай Х затының жылтыр қағы қалады және көлемі 89,6 мл (қ.ж) болатын В газы түзіледі. В газы екі элементтен тұрады және оның сутегі бойынша салыстырмалытығыздығы 44. В газының қышқыл ортада гидролизінің нәтижесінде С және D қышқылдарының қоспасы түзіледі. Д қышқылының осы мөлшерін CaCl2 ерітіндісінің артық мөлшерімен өңдеген кезде 468 мг тұнба түзіледі. D қышқылының осы мөлшерін титрлеуге концентрациясы 0,1 моль/л 120 мл КОН ерітінді жұмсалады. А,В,С, D және Х заттарын анықтаңыздар. Алынған С қышқылының ерітіндісін бейтараптау үшін дәл жоғарыдай концентрациялы КОН ерітіндісінің қандай мөлшері керек?
Шешуі: Концентрациясы 0,1 моль/л 120мл КОН ерітіндісінде 12 ммоль КОН бар. Яғни, гидролиз нәтижесінде 12 ммоль-экв. D түзіледі.
39
Белгісіз D қышқылының формуласы HY болсын. CaCl2-мен реакция теңдеуін жазайық:
 2HY+CaCl2
CaY2+HCl;
2HY+CaCl2
CaY2+HCl;
468 мг тұнбаның мөлшері 6 ммоль, 1 ммольдің массасы-78 мг; кальцийдің үлесіне 40 мг келетіндіктен, Y массасы-19. яғни, бұл-фтор, ал D-HF.
B газының гидролиздену теңдеуі:
 B C+HF(су қатысында).
B C+HF(су қатысында).
 Осы теңдеуден, 89,6 мл В газы 4 ммоль
12 ммоль HF. Яғни, В затының формуласы-ЭҒ3, оның
молярлы массасы М=88г/моль; Э - фосфор (Ar=31).
B-PF3, C-H3PO3. гидролиз
теңдеуі:
Осы теңдеуден, 89,6 мл В газы 4 ммоль
12 ммоль HF. Яғни, В затының формуласы-ЭҒ3, оның
молярлы массасы М=88г/моль; Э - фосфор (Ar=31).
B-PF3, C-H3PO3. гидролиз
теңдеуі:
PF3+ 3H2O= H3PO3+ 3 HF; X- металл болуы керек, А затының формуласы- Х(PF3)n, ал оның ыдырау теңдеуі:
Х(PF3)n=X+nPF3.
4 ммоль PF3 түзілді. n мәніне байланысты Х атомдық массасы Ar= 58,7 n/4 теңдеуімен анықталады. n=4 болған кезде Х-никель. А затының формуласы- Ni(PF3)4. оның термиялық ыдырау теңдеуі:
 Ni(PF3)4
Ni+4PF3.
Ni(PF3)4
Ni+4PF3.
H3PO3 қышқылы екі негізді және оны титрлеу үшін 4 ммоль×2=8 ммоль КОН немесе осы ерітіндінің 80 мл жұмсалады.
№6. Ыдыста А жай затының 0,18г үлгісін концентрлі күкірт қышқылының артық мөлшерімен қыздырады. Реакцияның газтәрізді өнімдерін кальций гидроксидінің артық мөлшері арқылы өткізген кезде 5,1 г тұнба түзіледі. А затын анықтаңыздар және жауабыңызды сәйкес реакция теңдеулері және есептеулермен дәлелдеңіздер.
Шешуі: Ізбес суымен тұнбаны концентрлі күкірт қышқылының активтілігі аз металдарға немесе бейметалдарға әсерінің нәтижесінде бөлінетін күкірт (IV)оксиді түзуі мүмкін:
 Ca(OH)2+SO2=CaSO3 +
H2O;
Ca(OH)2+SO2=CaSO3 +
H2O;
Активті металдармен концентрлі күкірт қышқылы әрекеттескен кезде күкіртсутек бөлінуі мүмкін, бірақ × x(CaSO3)=5,1/120=0,0425 моль.
40
Бір валентті металл үшін реакция теңдеуі:
 2A+2H2SO4=A2SO4+SO2
+2H2O.
2A+2H2SO4=A2SO4+SO2
+2H2O.
Осы теңдеуден А металының молярлы массасын есептейік: 0,18/(0,0425×2)=2,12 г/моль. Екі-, үш-, төртвалентті металдар үшін сәйкесінше алынған мәліметтер: 4,24,6,36,8,48г/моль.
Осы молярлық массаларға сәйкес металдар жоқ, яғни А-бейметалл. Оның күкірт қышқылымен тотығу реакциясының өнімі-ізбес суымен тұнба түзетін газ. А заты- күкірт немесе көміртек болуы мүмкін:
Күкірт үшін реакция теңдеуі:
S+2H2SO4=3SO2+2H2O;
x(S)=0,18/32=0.056моль;
x(SO2)=0,056×3=0,0168 моль;
m(CaSO3)=0,0168×120=2,04г, бұл 5,1г кем.
Көміртек үшін реакция теңдеуі:
C+2H2SO4=CO2+SO2+2H2O;
x(CaCO3)=0,015×100=1,5г;
x(CaSO3)=x(SO2)=0,03 моль;
m(CaSO3)=0,03×120=3,06г.
Тұнбалардың жалпы массасы: 1,5+3,6= 5,1г. Бұл есеп шартына сәйкес.
Сонымен, А заты-көміртек.
№7. Ақ кристалды Х заты келесі қасиеттерге ие:
1)Бунзен шамының жалынын қаныққан сары түске бояйды;
2)Х затының сулы ерітіндісі бейтарап және сол ерітіндіге күкіртті қышқылын (SO2 ерітіндісі) тамшылатып қосса, онда қара-қоңыр түсті,күкіртті қышқылдың артық мөлшерінен түссізденетін А ерітіндісі түзіледі;
3)Егер түссізденген ерітінді (2 пункте алынған) азот қышқылымен қышқылдап, AgNO3 ерітіндісін қосса, натрий цианидінің NaCN немесе натрий тиосульфатының Na2S2O3 ерітінділерінде еритін, бірақ аммиактың сулы ерітінділерінде ерімейтін сары тұнба түседі;
1) Күкірт қышқылымен қышқылдандырылған NaI ерітіндісін Х затының сулы ерітіндісіне қосқан кезде А затының дәл сол қара-қоңыр ерітіндісі түзіледі және ол күкіртті қышқыл немесе Na2S2O5 әсерінен түссізденеді;
41
2)0,1 г Х заты бар сулы ерітіндіге 0,5г калий йодиді KI мен сұйылтылған күкірт қышқылының бірнеше миллилитрін қосады. түзілген қара-қоңыр ерітіндіні толық түссіздендіру үшін 0,1 M Na2S2O3 ерітіндісінің 37,40 мл қажет болды
A)Х затының құрамына қандай элементтер кіреді? Жауабыңызды дәлелдеңіз.
Б) 1-4 пунктерде реакция нәтижесінде қандай өнімдер түзіледі?
В) Барлық реакция теңдеулерін жазыңыздар (2-4 пунктерде айтылған реакция теңдеулері);
Г) 5 пункте көрсетілген сандық мәліметтерді қолдана отырып, Х затының формуласын анықтаңыздар.
Шешуі: А) Х кристалды затының құрамында Na( Бунзен шамындағы сары жалын-қосылыстың құрамында натрийдің бар екендігінің дәлелі) және І(натрий цианидінің NaCN немесе натрий тиосульфатының Na2S2O3 ерітінділерінде еритін тұнба-AgI ) бар. Құрамындатек натрий мен йоды бар Х заты натрий йодиді болуы мүмкін емес, себебі ол 2,4 және 5 тәжірибелерге сай келмейді. мүмкін Х затының құрамында оттегі бар және оның формуласы NaIO4(тұрақты тұздарға NaIO3, NaIO4 жатады; олар гидролизге ұшырайды және ерітінділері бейтарап).
Б) X затымен (NaIO4) реакция жүру сызбанұсқасы:
2
 )
2NaIO4+SO2+H2O
Na2SO4+I2+H2SO4;
)
2NaIO4+SO2+H2O
Na2SO4+I2+H2SO4;
I2+SO2+2H2O=H2SO4+2HI;
3

 )HI+AgNO3 AgI +
HNO3;
)HI+AgNO3 AgI +
HNO3;
AgI+2NaCN=Na[Ag(CN)2]+NaI;
AgI+2Na2S2O3=Na3[Ag(S2O3)2]+NaI;
4
 )NaIO4+NaI+H2SO4
Na2SO4+I2+H2O;
)NaIO4+NaI+H2SO4
Na2SO4+I2+H2O;
I2+SO2+2H2O=H2SO4+2HI;
I2+2Na2S2O3=Na2S4O6+2NaI.
B) және Г) Есеп шартында қандай зат туралы сөз қозғалғандығын табу үшін, IO3- және IO4- иондары қатысатын реакция теңдеулерін жазайық:
2) 2IO3-+5SO2+4H2O=I2+5SO42-+8H+
2IO4-+7SO2+6H2O=I2+7SO42-+12H+
I2+SO2+2H2O=SO42-+2I-+4H+
3
 )I-+Ag+=AgI
)I-+Ag+=AgI
AgI+2CN-=[ Ag(CN)2]-+I- 42
AgI+2S2O32-=[Ag(S2O3)2]3-+I-
4)IO3-+I-+6H+=3I2+3H2O (1)
IO4-+I-+8H+=3I2+4H2O (2)
I2+2S2O32-=S4O62-+2I- (2a)
Концентрациясы 0,1 М Na2S2O3 ерітіндісінің 37,4 мл көлеміндегі натрий- тиосульфатының Na2S2O3 моль саны:
x1=0,1×0,0374=3,74×10-3(моль Na2S2O3).
0,1 г Х затына 3,7410-3 моль S2O32- келеді.
Бірінші болжам: Х заты - NaIO3(M=198г/моль).
Тәжірибеге 0,1/198
 5×10-4
моль алынады.
5×10-4
моль алынады.
5×10-4моль NaIO3-3,7410-3моль S2O32- сәйкес келсе,
1 моль NaIO3 - 7,48 моль S2O32- сәйкес келеді. Бұл (1) және (2a) химиялық реакция теңдеулерімен сәйкес келмейді.
Екінші болжам: Х заты -NaIO4(M=214г/моль).
Калий йодидімен химиялық реакцияға 0,1/214=4,67×10-4 моль NaIO4 қатысады.
4,67×10-4 моль NaIO4-3,7410-3моль S2O32-
1 моль NaIO4-8 моль S2O32- сәйкес келеді, ол (2) және (2a) теңдеулерін қанағаттандырады. Яғни, белгісіз зат- NaIO4.
2 жолы:
NaIOy тұзының (M=150+16у) натрий йодидімен қышқыл ортада өтетін реакциясы:
N
 aIOy+(2у-1)NaI+уH2SO4
yNa2SO4+yI2+yH2O;
(3)
aIOy+(2у-1)NaI+уH2SO4
yNa2SO4+yI2+yH2O;
(3)
NaIOy затының толық тотықсыздануын қамтамасыз ету үшін KI(0,5г) артығымен алынған. Бөлінген йодты натрий тиосульфатымен Na2S2O3 титрлейді.
I2+2Na2S2O3=Na2S4O6+2NaI. (4)
Титрлеуге 0,1 M Na2S2O3 ерітіндісінің 37,4 мл жұмсалады. Яғни, x1=0,1×0,0374=3,74×10-3(моль Na2S2O3 )
(4) теңдеу бойынша натрий тиосульфатының Na2S2O3 осы мөлшерімен әрекеттеседі: х2=0,5×3,74×10-3=1,8710-3(моль I2)
43
(3)реакция теңдеуі юойынша:
х3=0,1/(150+16y)моль NaIOy тұзы бөлінеді.
х4=y×x3=0,1y/(150+16y)=1,87×10-3(моль Na2S2O3) (5)
осы (5) теңдеуден у=4;x= NaIO4.
№8. А және В жай заттары өзара реакцияласып, С затын түзеді және А мен В ауада жана отырып, сәйкесінше D және Е заттарын түзеді. Жану өнімдері өзара әрекеттеседі және судың қатысында D және Е заттары әрекеттескен кезде тек қана Ғ заты алынады. Осы Ғ заты С затын тотықтыру арқылы да алынады. Есеп шартына жауап беретін А және В заттарын анықтаңыздар.
Шешуі: Жай заттардан(A)-металдардан-Li,Be,Mg,Ca шарттарға жауап береді(Na,K,Sr,Ba жанған кезде пероксидтерді түзеді).
Жай заттардан (B)-бейметалдардан - төмендегілер есеп шартына жауап бермейді:
а)күкірт, себебі SO2 (E заты) металл оксидімен (D заты ) әрекеттескен кезде сульфит (F заты) түзіледі, ал сульфидті тотықтырған кезде (C заты ) сульфат түзіледі;
b)азот пен көміртек, себебі нитрид пен нитратта, карбид пен карбонатта металл мен азоттың, көміртек пен металдың қатынастары әр түрлі. Бейметалдардан, мысалға, фосфор сәйкес келеді. Онда есеп шартында айтылған айналымдар келесі теңдеулермен жазылады:
3Li(A)+P(B)=Li3P(C);
4Li+O2=2Li2O(D);
4P+5O2=2P2O5(E);
3Li2O+P2O5=2Li3PO4;
Li3P+2O2=Li3PO4(F).
№9. Жай зат болып табылатын А газы катализатор қатысында сутегімен әрекеттесіп, В затын түзеді. В заты бірнеше сатыда қышқылдық қасиетке ие, түссіз С сұйықтығына айналдыруға болады. В затының артық мөлшері мен С сұйықтығы өзара әрекеттескен кезде қатты, ақ D заты түзіледі және соңғысын қыздырған кезде (~1500C) E газын бөле отырып ыдырайды. Б заты мен металдық натрий әрекеттескен кезде бөлінген өнім-Ғ заты және Е газы әректтесіп, құрамында 64,6 % азоты бар, суда жақсы еритін G тұзын түзеді. Осы заттарды анықтаңыздар және реакция теңдеулерін жазыңыздар.
Шешуі: Заттар: A-N2, B-NH3, C-HNO3, D-NH4NO3, E-N2O, F-NaNH2, G-NaN3.
Реакция теңдеулері:

 N2+3H2
2NH3(катализаторлар қатысында);
N2+3H2
2NH3(катализаторлар қатысында);
4NH3+5O2=4NO+6H2O; 44
2NO+O2=2NO2;
4NO2+O2+2H2O=4HNO3;
NH3+HNO3=NH4NO3;
NH4NO3=N2O+2H2O( температура әсерінен);
2Na+2NH3=2NaNH2+H2;
NaNH2+N2O=NaN3+H2O.
Натрий азидіндегі азоттың массаслық үлесі NaN3
 (N)=14*3/(14*3+23)=0,646
немесе 64,6%, бұл есеп шартына сәйкес.
(N)=14*3/(14*3+23)=0,646
немесе 64,6%, бұл есеп шартына сәйкес.
№10. Қатты қыздырылған А затының үстінен су буларының артық мөлшеріш өткізген кезде 4г В заты мен 1,235л С газы бөлінеді. Газ көлемі 20
 мен 740мм.сын.бағ. кезінде өлшенген. А затының бастапқы
үлгісінің сұйылтылған судағы ерітіндісі 1,235 л С газын жұта
алады және 8,4г D заты түзіледі. Түзілген ерітіндіні қайнап
жатқан су моншасында буландырған кезде А затының бастапқы,
бірінші реакцияға алынған мөлшері түзіледі. А- D заттарын
атаңыздар және реакция теңдеулерін жазыңыздар.
мен 740мм.сын.бағ. кезінде өлшенген. А затының бастапқы
үлгісінің сұйылтылған судағы ерітіндісі 1,235 л С газын жұта
алады және 8,4г D заты түзіледі. Түзілген ерітіндіні қайнап
жатқан су моншасында буландырған кезде А затының бастапқы,
бірінші реакцияға алынған мөлшері түзіледі. А- D заттарын
атаңыздар және реакция теңдеулерін жазыңыздар.
Шешуі: Газ көлемін қалыпты жағдайға келтірейік:
V0=p1V1T0/T1p0=740×11,236×273/(293×760)=1,12(л).
Газ көлемі 0,05 мольге тең. Онда 1 моль газбен қатар А затынан 4/0,05 =80г еритін қатты өнім түзіледі. А затының 1 моль газды сіңіруі 8,4×22,4/1,235=168г D затын береді.
A
 +H2O B+C ;
+H2O B+C ;
A+C=D;
D
 A(температура қатысында).
A(температура қатысында).
Массалар айырмасы 168-80=88 г - С газының екі моліне сәйкес келеді. Су- В затының құрамына кіреді. Онда 1 моль С газы -44 г, бұл CO2. A заты - көмір қышқылының орта тұзы, себебі ол көмірқышқыл газын 1:1 қатынаста сіңіре алады. Орта тұздың бір молі 2 моль сілтіге немесе 80г сәйкес, ол - NaOH.
Барлық заттар анықталған: A-Na2CO3, B- NaOH, C-CO2, D- NaHCO3.
Реакция теңдеулері:

 Na2CO3+H2O(арт.) 2
NaOH+CO2 (500
Na2CO3+H2O(арт.) 2
NaOH+CO2 (500 );
(1)
);
(1)
Na2CO3+ CO2+ H2O=2NaHCO3; (2)

 2NaHCO3
Na2CO3+ CO2 + H2O
(100
2NaHCO3
Na2CO3+ CO2 + H2O
(100 )
(3)
)
(3)
45
Соңғы екі реакцияның қайтымды жүретіндігі белгілі, ал бірінші реакция көп жағдайда кері бағытта жазылады. Реакция шарттарын есте ұстау қажет- қақтау кезіндегі су буларының артық мөлшері. Бұл жағдайда CO2 реакция аймағынан алынып отырады және процесс аяғына дейін жүреді (1).
№11. Құрамында сутегісі бар бинарлы, тұзтәрізді заттың Х элементінің хлоридімен (XCl3) реакциясының нәтижесінде А газы түзіледі. Осы газ ұшақ отыны ретінде қолданылады. Ол бромды суды түссіздендіреді және оны буландырған кезде тек бір ғана құрғақ В - маңызды дәрілік заты түзіледі. В затының салыстырмалы молекулалық массасы 62. Буландырған кезде алынған конденсат- күміс тұздарымен тұнба беретін тағы да бір қосылыс. Тұнбаның құрамындағы күмістің массалық үлесі 57,45%. Осы заттарды анықтаңыздар. А қосылысымен сандық құрамы бірдей қосылыстар бар ма? Бромды сумен реакциясының өнімдер қоспасының құрамы бромның концентрациясына тәуелді болады ма? А қосылысының тығыздығы 1,25г/л .
Шешуі: берілген мәліметтер арқылы бор гидроксидінің массасын есептейміз: М = 1,25×22,4=28г/моль, яғни ол диборанның формуласына сәйкес келеді- B2H6. Енді В қосылысын анықтайық. Оның салыстырмалы молекулалық массасы 62 ғана болғандықтан, оның құрамында бром жоқ. Ол боранның сулы ерітіндісінен түзілгендіктен, оның сапалық құрамын болжай аламыз: бор, оттегі, сутек.Медицинада қолданылатындықтан ол-бор қышқылы H3BO3(M=62г/моль).
Тұнба - күміс бромиді болса, онда конденсатта бромның диборанға әсерінің нәтижесінде түзілген бромсутек болғаны.
Реакция теңдеулері:
6MH+2BCl= B2H6+6MCl;
B2H6+6Br2+6H2O=2H3BO3+12HBr;
AgNO3+HBr=AgBr+HNO3.
B2H6-дан басқа бордың басқа да гидридтері болуы мүмкін, мысалы: B4H10. Бромды судың концентрациясы аз болған кезде басқа да реакциялар жүруі мүмкін:
B2H6+6 H2O=2H3BO3+H2.
46
№12. Х тұзының құрамына үш элемент кіреді және сол элементтердің бірі-оттегі және оның қосылыстағы массалық үлесі 25%. Сонымен қосылыс құрамына кіретін тағы да екі элементтің молярлық қатынасы 1:1. Тұз - жасыл түсті және ол суда ерімейді. Х затын концентрлі тұз қышқылымен өңдеген кезде өткір иістім Y газы және бір ерітіндінің түзілуіне әкеледі. Осы ерітіндіге сілті құйған кезде тотықтырғыштар әсерінен қараятын, ақ тұнбаның түзілуіне әкеледі.Егер хлорда Х заты ерігеннен кейінгі ерітіндіге күкірт қышқылымен әсер еткен кезде ақ тұнба түзіледі. Осы аталған заттарды анықтаңыздар және реакция теңдеулерін жазыңыздар.
Шешуі: Осы есепті шешудің бірнеше жолы бар. Ең алдымен тұздың формуласын BCOn деп белгілейік. Есеп шарты бойынша
 (O)=0,25, сол себепті 16n=0,25(M(B+C)=16n). Кейін тұздың
құрамына суда аз немесе мүлдем ерімейтін сульфат болуы мүмкін
(Ba, Sr, Pb). n=4 болған кезде В және С элементтерінің молярлық
массаларының қосындысы-192. Егер элементтердің бірін барий деп
алсақ, онда екінші элементтің молярлық массасы 55,
бұл-марганец. Х тұзы - BaMnO4.
(O)=0,25, сол себепті 16n=0,25(M(B+C)=16n). Кейін тұздың
құрамына суда аз немесе мүлдем ерімейтін сульфат болуы мүмкін
(Ba, Sr, Pb). n=4 болған кезде В және С элементтерінің молярлық
массаларының қосындысы-192. Егер элементтердің бірін барий деп
алсақ, онда екінші элементтің молярлық массасы 55,
бұл-марганец. Х тұзы - BaMnO4.
Басынан бастап, Х тұзының құрамында тотықтырғыш тұз қышқылын хлорға дейін тотықтыра алатын элементтің бар екен деп ойлауға болады. Және де егер манганаттар жасыл түсті болатындығын ескерсек, онда оттегінің массалық үлесі екінші белгісіз элемент- барий екендігін, стронций ( қорғасын PbCl2 тұнбасын беруші еді) емес екендігін анықтау үшін ғанаи қажет болар еді. Бірақ бұл кезде өткір иісті газ бөліну мүмкіндігі алмасу (мысалы SO2) реакциясының салдарынан жойылушы еді. Х тұзы мен тұз қышқылының әрекеттесу жолын, одан кейінгі күкірт қышқылымен де әрекеттесуін ескермей,оттегінің массалық үлесі 25% болатын, элементтерінің және осы мәндердегі элементтер - барий мен марганец.
BaMnO4+8HCl=BaCl2+MnCl2+4H2O;
Mn2++2OH-=Mn(OH)2;
Mn(OH)2+NaOCl=H2MnO3(MnO2×H2O)+NaCl;
Ba2++SO42-=BaSO4.
№13. Массасы 2,713 г болатын А заты массасы 6,872г болатын В ерітіндісінің әрекеттесуі нәтижесінде тек жалғыз ғана, массасы 9,585 г болатын кристалдық В заты түзіледі. С затын қатты қақтау кезінде массасы 2,713 болатын А затын, су және екі газ қоспасы түзіледі және судың массасы 4,2г болады. С затының формуласын анықтаңыздар (A-суда ерімейтін зат). Шешімнің бірмәнділігін негіздеңіз.
47
Шешуі: Ең алдымен есеп шартын талқылайық. А заты мен В ерітіндісінің әрекеттесу нәтижесінде тек жалғыз ғана С өнімі түзілуі мүмкін бе? Ал су қайда кетеді? Су А затымен әрекеттесуі мүмкін, әйтпесе С кристаллогидрат болып табылады. Есеп шартының бір бөлігін көптеген заттар қанағаттандырады, мысалы оксидтер: CaO+H2O+xCa(OH)2=(x+1)Ca(OH)2. Бірақ бұндай оксидтердің өздері сумен әрекеттеседі, бұл есеп шартына сай келмейді. Сондай-ақ А заты гидроксид емес екендігін де оңай дәлелдеуге болады. Бір ерекшелігі: С заты ыдырағаннан кейінгі түзілген А затының массасы бастапқы А затының массасына тең. Сол себепті тұздардың қышқылдармен және негіздермен қышқылдық және негіздік тұздарды түзетін реакцияларын ескермеуге болады. Тағы да бір нұсқа: металл оксиді қышқыл ерітіндісімен әрекеттеседі және реакция нәтижесінде тұздың кристаллогидраты түзіледі және осы кристаллогидрат қатты қыздырған кезде бастапқы оксидті түзеді. Енді тек қандай оксид алынғандығын табу керек. Бізге С затын қақтаған кездегі бөлінген судың массасы белгілі болғандықтан А және В әрекеттескен кездегі массасын есептеуге болады. В ерітіндісіндегі судың массасы 3,6 г, яғни Вт мен массасы 2,713 г А заты әрекеттескен кезде 0,6 г H2O түзіледі.
1 моль H2O-81,4 г А затынан түзіледі. Егер оксидтегі металл екі валентті болса, оныңатомдық массасы
 65.
(1 және 3 валенттіліктер үшін есеп шартын қанағаттандыратын
мәнді жауап ала алмаймыз.) Сонымен, A-Zn. Эквиваленттер заңын
қолдана отырып, қышқылдық эквивалентті массасын табуға болады
және осы кезде 49 г/моль мәнін аламыз. Сонда
В-H2SO4. Кейін түзілген ZnSO4
мен H2O массаларын салыстыра отырып, С заты-
ZnSO4×7 H2O, яғни мырыш купоросы
екендігін аламыз.
65.
(1 және 3 валенттіліктер үшін есеп шартын қанағаттандыратын
мәнді жауап ала алмаймыз.) Сонымен, A-Zn. Эквиваленттер заңын
қолдана отырып, қышқылдық эквивалентті массасын табуға болады
және осы кезде 49 г/моль мәнін аламыз. Сонда
В-H2SO4. Кейін түзілген ZnSO4
мен H2O массаларын салыстыра отырып, С заты-
ZnSO4×7 H2O, яғни мырыш купоросы
екендігін аламыз.
ZnO+ H2SO4+6H2O= ZnSO4×7 H2O.
№14. А затының түссіз сулы ерітіндісін әлсіз қыздыра отырып, В затының түссіз ерітіндісін құяды. Түзілген С затының ерітіндісі қышқыл орта береді және В затының ерітіндісін ары қарай құюды жалғастырған кезде белгілі бір түске ие болған D затының ерітіндісі түзіледі.Егер С затының ерітіндісіне В затының ерітіндісінің артық мөлшерін және оны салқында қосса, онда түстің қанықтылығы төмендейді, қыздырған кезде түс қанықтырақ болады. D затының ерітіндісін буландыру мүмкіндігі боялған булардың түзілуіне әкеледі. Жоғарыда аталған ерітінділердің бәрі күміс нитратымен тұнба береді. Осы заттары анықтаңыздар. Жауаптарыңызды негіздеңіздер. Реакция теңдеулерін жазыңыздар.
48
Шешуі: Есеп шарты бойынша барлық ерітінділер күміс нитратының ерітіндісімен тұнба береді. Ол галогенидтердің қасиеттеріне тән. D затының ерітіндісі боялған, оны буландыру мүмкін емес, себебі оның булары боялған. Осыдан, D - йод ерітіндісі екендігі табылады. С ерітіндісінің артық мөлшерін суықта қою- түстің қанықтылығы төмендейді, температураның жоғарылауы- түстің қанығуына әкеледі. Яғни, келесі тепе-теңдік орын алады:
KI+I2
 KI3(суықта тура бағытта реакция жүрсе, жылыда-кері
реакция жүреді).
KI3(суықта тура бағытта реакция жүрсе, жылыда-кері
реакция жүреді).
Осыдан, С немесе В- калий йодидінің ерітіндісі болуы мүмкін; артық мөлшерде В ерітіндісі алынатындықтан, сол ерітіндінің құрамында калий йодиді бар.
С ерітіндісі тотықтырғыш. Ерітіндіден жай зат-йод бөлінеді. А ерітіндісіне В ерітіндісін құған кезде С ерітіндісі түзілетіндіктен, С заты-құрамында йоды бар тотықтырғыш.
С затының ерітіндісі қышқыл орта береді және әлсіз қыздыру нәтижесінде түзіледі. Осының бәрі А ерітіндісінің хлорлы су болу мүмкіндігі негіздейді.
Реакция теңдеулері.
3Cl2+KI+3H2O=KIO3+6HCl;
KIO3+5KI+6HCl=6KI+3I2+3H2.
№15. Бір жай зат пен металл оксидінің қатты стехиометриялық қоспасын құбырлы пешке орналастырып, 100
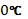 кезінде қатты фаза толығымен жойылғанша хлор жібереді. Хлордың
артық мөлшерін бөліп алғаннан кейін қалған газдар қоспасында А,
В және С заттары бар және қоспаның салыстырмалы тығыздығы 39,9.
Қоспаны 600
кезінде қатты фаза толығымен жойылғанша хлор жібереді. Хлордың
артық мөлшерін бөліп алғаннан кейін қалған газдар қоспасында А,
В және С заттары бар және қоспаның салыстырмалы тығыздығы 39,9.
Қоспаны 600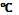 дейін суытып, сутегі бойынша тығыздығы 43,9 болатын В және С
газдарының қоспасы түзіледі. 25
дейін суытып, сутегі бойынша тығыздығы 43,9 болатын В және С
газдарының қоспасы түзіледі. 25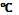 дейін салқындатқан кезде сутегі бойынша тығыздығы 14 болатын,
қалыпты жағдайда сілтімен әрекеттеспейтін қатты қалдық- С газы
ғана қалады. Осы берілген температурада газ қоспаларының
көлемдік құрамдарын (%) анықтаңыздар. Бастапқы қоспаның сандық
және сапалы құрамдарын анықтаңыздар және реакция теңдеулерін
жазыңыздар. Қандай жағдайларды және қалай С газы сілтімен
әрекеттеседі?
дейін салқындатқан кезде сутегі бойынша тығыздығы 14 болатын,
қалыпты жағдайда сілтімен әрекеттеспейтін қатты қалдық- С газы
ғана қалады. Осы берілген температурада газ қоспаларының
көлемдік құрамдарын (%) анықтаңыздар. Бастапқы қоспаның сандық
және сапалы құрамдарын анықтаңыздар және реакция теңдеулерін
жазыңыздар. Қандай жағдайларды және қалай С газы сілтімен
әрекеттеседі?
Шешуі: Жалпы түрдегі реакция теңдеуі:
M2Ox+xC+xCl2=xCO+2VClx;
2MClx
 M2Cl2x.
M2Cl2x.
Яғни, 1000
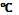 кезінде А, В және С заттарының қоспасы-бұл MClx,
M2Cl2x, CO.
кезінде А, В және С заттарының қоспасы-бұл MClx,
M2Cl2x, CO.
600
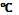 кезінде В және С заттарының қоспасы - бұл димер мен CO, сутегі
бойынша салыстырмалы тығыздығы 43,9. 49
кезінде В және С заттарының қоспасы - бұл димер мен CO, сутегі
бойынша салыстырмалы тығыздығы 43,9. 49
Қоспаның молекулярлық массасы
M=2×43,9=87,8 г/моль. Теңдеу бойынша 1 моль димерден Х моль СО түзіледі, сонда:
28Х/(1+X)+(2Ar(M)+71X)/(1+X)=87,8
Осыдан металдың салыстырмалы атомдық салмағы:
Ar(M)=43,9-5,6X
X мәндер бере отырып, X=3 болған кезде Ar(M)=27,1-алюминий екендігі анықталады. Газ қоспасының көлемдік үлесі бойынша құрамы: ц(CO)=3/4×100=75%, ц(Al2Cl6)=25%.
1000
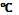 кезіндегі газдар қоспасының құрамын анықтайық. Бұл жағдайда
алюминий хлоридінің димері де, мономері де түзіледі және (5-6)
моль газдар түзіледі. Реакция теңдеуін жазсақ:
кезіндегі газдар қоспасының құрамын анықтайық. Бұл жағдайда
алюминий хлоридінің димері де, мономері де түзіледі және (5-6)
моль газдар түзіледі. Реакция теңдеуін жазсақ:
Al2O3+3C+3Cl2=3CO+бAl2Cl6+(2-2б)AlCl3;
б-ны есептейік:
3×28/(5-б)+267/(5-б)+(2-2б)133,5/(5-б)=79,8 Осыдан
б=0,6.
Қоспа құрамы:
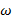 (CO)=3/4,4×100=68,2%,
(CO)=3/4,4×100=68,2%,
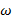 (Al2Cl6)=13,6%,
(Al2Cl6)=13,6%,
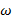 (AlCl3)=18,2%
(AlCl3)=18,2%
Енді бастапқы қатты қоспаның құрамын анықтайық. Реакция теңдеуі: Al2O3+3C. Көміртектің массалық үлесі:
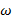 (C)=12×3/(212×3+102)×100%=26,1%,
(C)=12×3/(212×3+102)×100%=26,1%,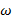 (Al2O3)=73,9%.
(Al2O3)=73,9%.
Реакция теңдеулері:
Al2O3+3C+3Cl2=3CO+2AlCl3;
Al2O3+3C+3Cl2=3CO+Al2Cl6;
CO+NaOH
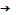 HCOONa(t,p).
HCOONa(t,p).
№16. Жай А және Б заттары өзара әрекеттесіп газтәрізді В қосылысын түзеді. А және Б заты сияқты, олардың И қосылысы да табиғатта кең тараған Г газымен катализаторсыз, 1000
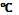 -
ден төмен температурада әрекеттесіп Д, Е қосылыстарын немесе Д
мен Е қоспасын түзеді. Басқа жағдайларда В мен Г әрекеттескенде
Б және Е қосылыстарының, немесе Е және Ж қосылыстарының қоспасы
түзілуі мүмкін. Сонымен қатар, Е және Ж қосылыстары өзара
экзотермиялық реакцияға түсіп, жалғыз ғана 3 қосылысын түзеді.
3 қосылысы-өндірістік маңызы зор қосылыс және ол өте көп
мөлшерде шығарылады. Сондай-ақ, Г және Д қосылыстарының
қоспасынан белгілі бір жағдайда Ж қосылысын алуға болады. 50
-
ден төмен температурада әрекеттесіп Д, Е қосылыстарын немесе Д
мен Е қоспасын түзеді. Басқа жағдайларда В мен Г әрекеттескенде
Б және Е қосылыстарының, немесе Е және Ж қосылыстарының қоспасы
түзілуі мүмкін. Сонымен қатар, Е және Ж қосылыстары өзара
экзотермиялық реакцияға түсіп, жалғыз ғана 3 қосылысын түзеді.
3 қосылысы-өндірістік маңызы зор қосылыс және ол өте көп
мөлшерде шығарылады. Сондай-ақ, Г және Д қосылыстарының
қоспасынан белгілі бір жағдайда Ж қосылысын алуға болады. 50
1)А-З заттарын атап, реакция теңдеулерін жазыңыздар. Керек жерде айналу шарттарын жазыңыздар.
2)Неге А заты Жерде бос күйінде мүлде аз кездеседі?
Шешуі:
Реакция айналуларының сызбанұсқасын құрастырайық:
А+Б
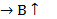 Б+Г
Б+Г Д
А+Г
Д
А+Г Е
Г+Д
Е
Г+Д Ж
Ж
В+Г
 Д+Е
немесе Б+Е, немесе Е+Ж
Д+Е
немесе Б+Е, немесе Е+Ж З
З
Есептің шартынан А,Б және Г заттары металл бола алмайтыны көрінеді, себебі В(А мен Б қосылыстарының реакция нәтижесі)газтәрізді қосылыс. В- екі бейметаллдың қосылысы болғандықтан, газтәрізді Г затымен әрекеттесіп, А және Б заттарының әрқайсысы беретін өнімді бере алады. Г элементі- электртерістілігі жоғары бейметалл, себебі ол А және Б заттарын да тотықтыра алады. Г бейметалы табиғатта кең тарағандықтан, ол тек оттек болуы мүмкін. Сонда Е-А элементінің оксиді, ао Д және Ж-Б элементінің оксидтері, және реакция теңдеуінен көрініп тұрғандай, Ж қосылысында Б элементінің тотығу дәрежесі жоғарырақ.
Егер бейметалл оксидтерінің өзара әрекеттесуі нәтижесінде өндірістік маңызы зор қосылысалынса, оксидтердің біреуі- су (бұл оксид Ж бола алмайды, себебі Б элементінің бірнеше оксиді бар, яғни бұл Е) болуы мүмкін. Сонда 3- белгілі бір қышқыл. Есеп шартын күкірт, азот, фосфор қышқылдары қанағаттандырады. Сол себепті Б заты- күкірт, азот немесе фосфор болуы мүмкін. Азот оттегімен 1000
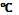 -ден
төмен температурада әрекеттеспейді, ал фосфор оттекпен
әрекеттескенде түзіле алмайтындықтан, күкірт қана қалады.
-ден
төмен температурада әрекеттеспейді, ал фосфор оттекпен
әрекеттескенде түзіле алмайтындықтан, күкірт қана қалады.
Сонымен: А- сутек; Б-күкірт; В-күкіртсутек; Г-оттек; Д-SO2; Е-H2O; Ж- SO3; З- H2SO4.
Реакция теңдеулері:
H2+S=H2S; 2H2+O2=2H2O; S+O2=SO2;
2H2S+2O2=2H2O+SO2 (қалыпты жағдайдағы жану);
2H2S+O2=2H2O+ S
(оттек жетіспеген кездегі жану немесе жану аймағын суытқан кезде)
2H2S+4O2=2H2O+2SO3 (катализатор, мысалы V2O5)
H2O+SO3=H2SO4; 2S+3O2=2SO3(катализатор, мысалы V2O5)
-
Күкірт (ІV) оксидің күкірт қышқылынан алу үшін, мысалы, концентрлі күкірт қышқылын мыспен әрекеттестіру керек:
51
Cu+2H2SO4(конц)=CuSO4+SO2
 +2H2O
+2H2O
3)Сутек Жерде бос күйінде кездесе бермейтін себебі, ол оттегі бар атмосферада сақтала алмаған.
Бейорганикалық реакциялар тізбектерін немесе химиялық өзгерістер тізбектерін шешу.
1.Ашық тізбектер
H2
 CaH2
CaH2 Ca(OH)2
Ca(OH)2 CaCO3
CaCO3 Ca(HCO3)2
Ca(HCO3)2
1)Ca+H2CaH2 500-700
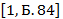
2) CaH2+2H2OCa(OH)2
 +2H2
+2H2

3) Ca(OH)2+ CO2 CaCO3+H2O
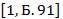
4) CaCO3+ CO2+H2OCa(HCO3)2

H2
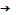 HCl
HCl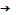 KNO3
KNO3 O2
O2 NO2
NO2
1) H2+Cl22HCl

2)2HCl(конц)+3KNO22КCl+2KCl+2KNO3+2NO
 +H2O
+H2O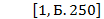
3)2KNO3==2KNO2+O2 400+520

4)N2+O22NO 2000
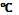 ,кат.Pt/MnO2
,кат.Pt/MnO2
2NO+O22NO2 бөлме,өте жылд.

HNO3
 NO2
NO2 KNO2
KNO2 KNO3
KNO3 P2O5
P2O5
1)4HNO34NO2+2H2O+O2

2)2KOH(суық)+NO+NO22KNO2+2KNO2+H2O

3)2KNO2+2HNO32KNO3+NO2
 +NO
+NO +H2O
+H2O
4)2KNO32KNO2+O2
5O2+4P(қызыл)P2O5 240-400
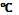
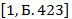
Жабық тізбектерге арналған қиындатылған тапсырмалар
H2S
 X1
X1 X2
X2 X3
X3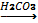 Ca(HCO3)2
Ca(HCO3)2
X1 - H2O;X2 - Ca(OH)2;X3 - CaCO3
CaOCl2
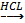 X1
X1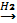 X2
X2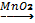 X3
X3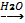 HClO
HClO
X1-Cl2; X2 -HCl; X3 - Cl2
KNO
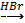 X1
X1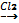 X2
X2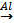 x3
x3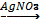 AgBr
AgBr
X1 - KBr; X2 - Br2;X3 - AlBr3 52
Қолданылған әдебиеттер:
-
П.Н.Протасов, И.К.Цитович «Методика решения расчетных задач по химии», Москва, «Просвещение», 1988
-
Г.П.Хомченко «Пособие по химии для поступающих в ВУЗы»,
Москва, Новая волна, 2012
-
Г.П.Хомченко, И.Г.Хомченко «Сборник задач по химии для поступающих в ВУЗы» Москва, Новая волна, 2012
-
А.Толеков, Қ.Бекішев «Химиялық формула табу есептері» Алматы:ААҚ «Өрлеу»2013
-
«Химия есептері» Қ.Бекішев, Алматы, «Білім»2007
-
Қ.Бекішев, Р.Рысқалиева, А.Солтанбекова, «Жалпы химия есептері мен жаттығулары» Алматы, «Қазақ университеті»2009
-
Қ.Бекішев, Н.Досаханова, С.Сантаева «Химия:ҰБТ есептері» (2010-2011) Алматы, «Білім» 2013
-
Ә.Е.Темірболатова, «Есептер мен жаттығулар жинағы» 8,9,10,11 класс, Алматы, «Мектеп» 2009
-
А.Сағымбай, А.Тоқтасынов «Бейорганикалық реакциялар тізбектері» Алматы, АОМКДИ, 2009
10.С.Чуранов «Химические олимпиады в школе» Москва,
«Просвещение» 1982
11.Қ.Бекішев, «Аудандық, облыстық химиялық олимпиада
есептері», Алматы 2013
12.В.Дайнеко «Как научить школьников решать задачи по
химии» Москва, «Высшая школа» 1987
13. Н.Е.Кузьменко «500 задач по химии» Москва, «Образование»
2002
14. Х.Молдағалиев «Жоғары оқу орындарына түсушілерге арналған
химия оқу құралы» Алматы ,1981

-