- Учителю
- Урок по теме: «Скорость химических реакций. Химическое равновесие
Урок по теме: «Скорость химических реакций. Химическое равновесие
Министерство общего и профессионального образования
Ростовской области
Государственное бюджетное профессиональне образовательное учреждение Ростовской области
«Ростовский - на - Дону строительный колледж»
Цикловая комиссия естественнонаучных дисциплин
методическое обеспечение
урока-исследования
по дисциплине «Химия»
на тему: «Скорость химических реакций. Химическое равновесие»
для специальности
08.02.01 - Строительство и эксплуатация зданий и сооружений
Преподаватель Куринная Н.А.
Ростов - на - Дону
2016
на заседании цикловой комиссии
естественнонаучных дисциплин
Протокол № __от___________
Председатель ЦК
Хараева О.М. ______________
Заместитель директора по учебной работе
Сухаревская О.В. __________
Составитель: преподаватель естественнонаучных дисциплин Куринная Н.А.
Содержание
-
Место урока в образовательном процессе
-
Цели урока
-
Основные методы обучения
-
Предварительная подготовка к уроку
-
Обеспечение занятия
-
Структура и хронометраж урока
-
Программа урока
-
Контроль знаний и выставление оценок
-
Список литературы
-
Приложения
1 МЕСТО УРОКА В ОБРАЗОВАТЕЛЬНОМ ПРОЦЕССЕ
Тип занятия: урок изучения нового материала.
Вид занятия: урок - исследование.
Федеральные государственные образовательные стандарты среднего профессионального образования (ФГОС СПО) предполагают широкое применение активных методов обучения, позволяющих:
• активизировать и развивать познавательную и творческую деятельность учащихся;
• повышать результативность учебного процесса;
• формировать и оценивать общие и профессиональные компетенции, особенно в части организации и выполнения коллективной работы.
В ГБПОУ РО «РСК» в первый год обучения обучающиеся получают общеобразовательную подготовку, которая позволяет приступить к освоению ППСЗ СПО. Знания, полученные обучающимися при изучении общеобразовательной дисциплины «Химия», углубляются в процессе изучения учебных дисциплин и профессиональных модулей основной профессиональной образовательной программы среднего профессионального образования.
Занятие по теме «Скорость химических реакций. Химическое равновесие» проводится для обучающихся специальности 08.02.01 Строительство и эксплуатация зданий и сооружений.
и реализует межпредметные связи со следующими учебными дисциплинами и профессиональными модулями:
-
«Физика»
-
«Биология»
-
«Экологические основы природопользования»
-
«Материаловедение»
-
«Общая технология строительных материалов»
-
ПМ 01 «Производство неметаллических строительных изделий и конструкций».
Занятие по данной теме расширяет знания о закономерностях протекания химических реакций и подготавливает обучающихся к усвоению нового материала.
Обучение химии невозможно без широкого применения активных методов обучения, таких как метод проектов. Именно поэтому урок-исследование по теме: «Скорость химических реакций. Химическое равновесие» проводится в курсе изучения дисциплины «Химия» для студентов первого курса колледжа специальности 08.02.01 Строительство и эксплуатация зданий и сооружений.
На уроке-исследовании обучающиеся овладевают методикой научного исследования, усваивают этапы научного познания. В структуре урока-исследования выделяют следующую последовательность действий:
1) актуализация знаний;
2) мотивация;
3) создание проблемной ситуации;
4) постановка проблемы исследования;
5) определение темы исследования;
6) формулирование цели исследования;
7) выдвижение гипотезы;
8) проверка гипотезы (проведение эксперимента, лабораторной работы, чтение литературы, размышление, просмотр фрагментов учебных фильмов и т.д.);
9) интерпретация полученных данных;
10) вывод по результатам исследовательской работы;
11) применение новых знаний в учебной деятельности;
12) подведение итогов урока;
13) домашнее задание.
Исследовательская деятельность обучающихся на уроке начинается с накопления информации. Далее необходимо сформулировать цели исследования, т.е. ответить на вопрос: что нужно сделать для решения поставленной проблемы? Следующий шаг - выдвижение гипотезы - мысленное представление основной идеи, к которой может привести исследование, предположение о результатах исследования. Проверка гипотезы заключается в определенных действиях по разработанному алгоритму. Полученные в результате этих действий данные обучающиеся должны интерпретировать («Анализ данных показывает, что...»). В заключение необходимы оценка, оформление результатов работы и вывод из нее.
Включение в образовательный процесс урока-исследования обусловлено требованиями ФГОС СПО и помогает актуализировать знания, умения и элементы общих компетенций будущего специалиста:
Знания:
- научно-технические достижения и опыт организации строительного производства;
- основные термины и определения, используемые при формировании документов в области научно-исследовательской деятельности;
- способы поиска и накопления необходимой научной информации, ее обработки и оформления результатов;
- методы научного познания;
- общую структуру и научный аппарат исследования
Общие компетенции:
ОК 1. Понимать сущность и социальную значимость своей будущей профессии, проявлять к ней устойчивый интерес.
ОК 2. Организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их эффективность и качество.
ОК 3. Принимать решения в стандартных и нестандартных ситуациях и нести за них ответственность.
ОК 4. Осуществлять поиск и использование информации, необходимой для эффективного выполнения профессиональных задач, профессионального и личностного развития.
ОК 6. Работать в коллективе и в команде, эффективно общаться с коллегами, руководством, потребителями.
ОК 8. Самостоятельно определять задачи профессионального и личностного развития, заниматься самообразованием, осознанно планировать повышение квалификации.
ОК 9. Ориентироваться в условиях частой смены технологий в профессиональной деятельности.
2 ЦЕЛИ УРОКА
Обучающая цель:
-
изучить понятие «скорость» в химии, влияние температуры, катализатора, концентрации, природы вещества, площади поверхности реагирующих веществ как факторов на изменение скорости протекания химических реакций;
-
сформировать умение пользоваться технологической картой как алгоритмом поисково-самостоятельной деятельности;
-
познакомить обучающихся с особенностями процесса научного познания, ступенями исследовательской деятельности; научить формулировать и отбирать полезные гипотезы, интерпретировать данные, делать выводы;
-
закрепление знаний о классификации реакций по признаку обратимости;
-
Углубление и обобщение знаний о состоянии химического равновесия как динамического состояния реагирующей системы;
-
Закрепление знаний о способах смещения равновесия на основе принципа Ле-Шателье;
-
Формирование представлений о константе химического равновесия, умений записывать выражения константы равновесия для гомогенных и гетерогенных реакций;
-
Выявление единства и взаимосвязи химических превращений в реакциях между неорганическими и органическими веществами, их познаваемость, возможность управления химическими реакциями;
Развивающая цель:
-
развить память, мышление (способностей сравнивать, устанавливать причинно-следственные связи);
-
развить интеллектуальные, творческие способности обучающихся.
-
применить интегрированный подход в формировании информационного поля изучения темы на основе межпредметных связей с физикой, математикой и биологией;
Воспитательная цель:
-
заинтересовать обучающихся исследовательской деятельностью, поиском новых проблем;
-
вызвать интерес к решению производственных задач;
-
вызвать устойчивый интерес к будущей профессии.
3 ОСНОВНЫЕ МЕТОДЫ ОБУЧЕНИЯ
Урок-исследование проводится с использованием таких методов обучения, как метод проектов, проблемно-поисковый, исследовательский и эвристический методы.
Метод проектов относится к активным методам обучения, он ориентирован на самостоятельную деятельность обучающихся - индивидуальную, парную, групповую, выполняемую в течение определённого отрезка времени. Метод проектов всегда предполагает решение какой-либо проблемы. В основе метода проектов лежит развитие познавательных навыков обучающихся, умений самостоятельно конструировать свои знания, умения ориентироваться в информационном пространстве, развитие критического и творческого мышления.
Проблемно-поисковый метод отличается постановкой перед обучающимися вопроса (проблемы), на который они самостоятельно ищут ответ, сами создают для них новые знания, «делают открытия», формулируют теоретические выводы. Проблемно-поисковый метод требует активной мыслительной деятельности обучающихся, творческого поиска, анализа собственного опыта и накопленных знаний, умения обобщать, делать частные выводы.
Исследовательский метод занимает центральное место в проблемном обучении, предполагает построение процесса обучения наподобие процесса научного исследования, осуществление основных этапов исследовательского процесса, в упрощенной, доступной обучающимся форме: выявление неизвестных (неясных) фактов, подлежащих исследованию (ядро проблемы); уточнение и формулировка проблемы; выдвижение гипотез; составление плана исследования; осуществление исследовательского плана, исследование неизвестных фактов и их связей с другими, проверка выдвинутых гипотез; формулировка результата; оценка значимости полученного нового знания, возможностей его применения.
Эвристический или частично-поисковый метод - это организация поисковой, творческой деятельности на основе теории поэлементного усвоения знаний и способов деятельности. Целостная задача требует следующих умений: анализировать её условие; преобразовывать основные проблемы в ряд частных, подчинённых главной, проектировать план и этапы решения, формулировать гипотезу, синтезировать различные направления поисков, проверять решение и т.д. Система специально разработанных учебных задач помогает учащемуся овладеть умением самостоятельно выполнять каждый из этапов решения.
4 ПРЕДВАРИТЕЛЬНАЯ ПОДГОТОВКА К УРОКУ
На этом этапе преподаватель проводит логический отбор учебного материала, формулирует проблемы.
Предварительная подготовка участников урока-исследования по данной теме включает в себя:
-
лекционное изложение материала по теме «Классификация химических реакций» (Приложение 1).
-
повторение правил техники безопасности при работе в химической лаборатории (Приложение 2).
5 ОБЕСПЕЧЕНИЕ ЗАНЯТИЯ
1. Дидактический материал:
-
мультимедийная презентация,
-
таблица «Ряд активности металлов» (Приложение 5).
2. Раздаточный материал:
-
технологические карты,
-
алгоритм проведения эксперимента.
3. Технические средства обучения:
-
мультимедийный проектор,
-
экран,
-
ноутбук,
-
мультимедийная презентация,
-
доска,
4. Оборудование:
-
цинк, магний, соляная кислота(1:2), карбонат кальция (порошок, кусочек), перекись водорода, оксид марганца (IV), пробирки, штатив, пробиркодержатель, спиртовка, лучина
5.Литература для студентов:
-
Габриелян О.С. Химия: учеб. для студ. сред. проф. учеб. заведений / О.С. Габриелян, И.Г. Остроумов. - М., 2008.
-
Габриелян О.С. Химия в тестах, задачах, упражнениях: учеб. пособие для студ. сред. проф. учебных заведений / О.С. Габриелян, Г.Г. Лысова - М., 2010.
-
Габриелян О.С. Практикум по общей, неорганической и органической химии: учеб. пособие для студ. сред. проф. учеб. заведений / Габриелян О.С., Остроумов И.Г., Дорофеева Н.М. - М., 2009.
6 ПРОГРАММА УРОКА
Организационная часть
В начале урока преподаватель проводит организационный этап, обосновывая тему и цели урока-исследования, устанавливает внутрипредметные и междисциплинарные связи.
«Здравствуйте, ребята. Сегодня мы продолжаем изучение раздела «Химические реакции» и тема нашего сегодняшнего занятия: «Скорость химической реакции. Химическое равновесие». Эта тема связана с изучением таких предметов, как «Физика», «Биология», «Экологические основы природопользования» и пригодится вам в будущем для изучения профессиональных дисциплин «Материаловедение», «Общая технология строительных материалов», «Производство строительной керамики».
Основная цель сегодняшнего занятия - изучить понятие «скорость химической реакции», влияние температуры, природы вещества, площади поверхности реагирующих веществ как факторов, изменяющих скорость протекания химических реакций и научиться проводить научное исследование.
Исследование - это один из видов профессиональной деятельности человека. Ученый, рабочий, препоаватель - человек любой профессии при грамотном подходе к делу использует элементы исследовательской работы.
В любом исследовании принято выделять такие этапы работы, как:
1) постановка проблемы;
2) определение темы;
3) формулирование цели;
4) выдвижение гипотезы;
5) проверка гипотезы (проведение эксперимента, лабораторной работы, чтение литературы, размышление, просмотр фрагментов учебных фильмов и т.д.);
6) интерпретация полученных данных;
7) вывод по результатам исследовательской работы.
Сначала мы вспомним, что такое скорость с точки зрения физики, затем сформулируем проблему, тему, цель и гипотезу исследования. После этого вы разделитесь на 4 группы (у каждого будет своя роль) и проведёте по 1эксперименту, подтверждающих гипотезу. Далее, вы дадите ответ на 2 вопроса, связанных с применением полученных знаний в вашей будущей профессии. После этого я оценю вашу работу. Приступаем к проведению исследования.
Проведение исследования
Преподаватель помогает обучающимся сформулировать проблему: «С чего начинается любое исследование? С накопления информации, постановки проблемы. И мы сейчас ее вместе сформулируем. Ежедневно мы встречаемся с химическими реакциями и каждая из них протекает со своей скоростью. Золотые украшения сохраняют свою красоту и блеск веками. А вот брошенный на улице старый автомобиль спустя несколько лет превращается в груду ржавого металлолома. Долька яблока уже через несколько часов покрывается бурой пленкой, петарда, брошенная в костер, оглушительно взрывается. На уроках физики вы изучали понятие скорости.
Что такое скорость?».
Прогнозируемый ответ обучающихся: Скорость - это изменение какой-либо физической величины во времени.
-Какое определение можно дать скорости реакции?
Прогнозируемый ответ обучающихся: скорость реакции - это число столкновений или число элементарных актов реакции в единицу времени.
Преподаватель обобщает ответы обучающихся. Скорость химической реакции - это изменение концентрации одного из реагирующих веществ или одного из продуктов реакции в единицу времени V= C/ T
Итак, возникает проблема: скорость химических реакций различна, от чего она зависит? Знание скоростей химических реакций имеет большое научное и практическое значение. Например, в химической промышленности при производстве того или иного вещества от скорости реакции зависят размеры и производительность аппаратуры, количество вырабатываемого продукта, его стоимость и оплата труда сотрудников.
Преподаватель формулирует тему, цель исследования, выдвигает гипотезу:
Тема нашего первого исследования - влияние различных факторов на скорость химических реакций.
Цель исследования - выяснить, от каких факторов зависит скорость химических реакций.
Гипотеза - предположительно, факторами, от которых зависит скорость химических реакций являются: катализатор, температура, природа реагирующих веществ.
Переходим к следующему этапу исследования - вам необходимо подтвердить гипотезу проведением эксперимента. Преподаватель делит обучающихся на 4 группы. «Сегодня вы являетесь учёными-химиками и вам нужно исследовать проблему: «От чего зависит скорость химической реакции?». Вы должны провести 1 эксперимента и дать ответ на 2 вопроса, связанных с применением полученных знаний на практике. Вы разделены на 4 исследовательские группы, каждая группа - «научная лаборатория», где у каждого своя роль:
-
«научный руководитель», отвечает за работу группы, делает доклад о результатах исследования;
-
2 исследователя, ответственных за проведение эксперимента;
-
теоретик, который отвечает за правильность оформления технологической карты и даёт ответ на поставленный вопрос;
-
инженер по технике безопасности.
Каждой группе выдаются бэйджи, комплект реактивов и пакет документов, в состав которого входят:
-
технологические карты (Приложение 6)
-
правила техники безопасности (Приложение 2)
-
таблица «Ряд активности элементов» (Приложение 5)
-
алгоритм проведения исследования (Приложение 7)
-
сигнальные карточки (Приложение 3)
Приступаем к проведению эксперимента. Ознакомьтесь с пакетом документов. Под руководством преподавателя, опираясь на алгоритм, группы проводят исследование.
Опыт 1(1 группа)
Вносим в первую пробирку порошок мела (СаСО3), во вторую кусочек мела. Наливаем в каждую пробирку по 2 мл соляной кислоты (НСl).
Что наблюдаете? Объясните свои наблюдения.
Прогнозируемая деятельность обучающихся. В первой пробирке реакция идет быстрее, потому что мел измельчен. Наблюдения обучающиеся записывают в таблицу.
Вывод. Скорость зависит от степени измельчения, т.е. от площади соприкосновения реагирующих веществ. По признаку выделения углекислого газа определяют химическую реакцию, о времени протекания реакции судят о её скорости.
Вопрос: Почему цемент, используемый при строительстве, всегда имеет порошкообразную консистенцию?
Опыт 2 (2 группа)
Наливаем в две пробирки по 1-2 мл раствора соляной кислоты (НСl). Опускаем в первую пробирку металл цинк, во вторую магний. Найдите эти элементы в ряду напряжения металлов, сравните их по химической активности. По объёму выделившихся пузырьков водорода определите скорость химической реакции.
Прогнозируемая деятельность обучающихся. В первой пробирке реакция идет быстрее, потому что Mg более активный металл, чем Zn. Наблюдения обучающиеся записывают в таблицу.
Вывод: Скорость реакций зависит от природы реагирующего вещества.
Вопрос: Почему купола храмов при строительстве покрывают сусальным золотом, а не медью, которая значительно дешевле?
Опыт 3 (3 группа)
В 2 пробирки налейте раствор HCl, в первую добавьте не много воды. В каждую пробирку поместите одинаковые гранулы Zn. По объёму выделившихся пузырьков водорода определите скорость химической реакции.
Прогнозируемая деятельность обучающихся. Во второй пробирке реакция идет быстрее, потому что концентрация кислоты больше, чем в первой пробирке.
Вывод: Скорость реакций зависит от концентрации вещества.
Вопрос: Почему для чистки сильных загрязненных поверхностей в домашних условиях концентрированные средства более эффективны при небольшом расходе?
Опыт 4 (4 группа)
В 2 пробирки насыпьте немного порошка CuO, добавьте 3-5мл раствора H2SO4 . Первую пробирку поставьте в штатив, вторую аккуратно нагрейте в пламени спиртовки. По изменению окраски раствора сделайте вывод о скорости протекания химической реакции.
Прогнозируемая деятельность обучающихся. Во второй пробирке реакция идет быстрее, потому что при повышении температуры скорость химической реакции увеличивается.
Вывод: При повышении температуры скорость химической реакции увеличивается.
Вопрос: Почему срок службы металлических конструкций в в южных регионах меньше, чем в северных?
Еще один фактор, влияющий на скорость химической реакции - это катализатор. (Студент представляет доклад с мультимедийной призентацией о видах катализа)
Подведение итогов по проведенному исследованию
Группы представляют вывод по результатам исследовательской работы, дают ответ на поставленный вопрос, обосновывают применение новых знаний в учебной деятельности.
Преподаватель анализирует ответы обучающихся, обращает внимание на ошибки
«Итак, сделаем вывод по проведённому исследованию. Вы справились с поставленной проблемой и экспериментально подтвердили наличие такой качественной характеристики химического процесса как скорость. Вы выяснили, что этот показатель зависит: от катализатора, температуры, природы реагирующих веществ, площади соприкосновения реагирующих веществ, концентрации. Вы дали ответы на поставленные вопросы, тем самым применили полученные знания для решения производственных задач, в вашей будущей профессии. Таким образом, вы достигли поставленных целей и подтвердили гипотезу нашего исследования и мы можем перейти к следующему вопросу нашего занятия.
Это химическое равновесие и способы его смещения.
Как следует из названия темы объектом изучения является такое важное свойство реакций как обратимость. Давайте вспомним какие реакции являются необратимыми, а какие обратимыми?
Прогнозируемый ответ обучающихся: Необратимые реакции идут только в одном направлении и сопровождаются образованием веществ, уходящих из сферы реакции. Необратимыми являются реакции горения, реакции ионного обмена, идущие с образованием осадка, газа или воды, некоторые реакции разложения.
Обратимые реакции - это реакции, которые одновременно протекают в прямом и обратном направлении.
2SO2 + O2 ↔ 2SO3
При протекании обратимой химической реакции концентрации исходных веществ постепенно уменьшаются, а продуктов реакции - увеличиваются. Следовательно, в соответствии с законом действующих масс, скорость прямой реакции уменьшаются, а скорость обратной реакции - увеличиваются. Через какое-то время эти скорости станут равными, и возникнет состояние, именуемое химическим равновесием.
До того как мы рассмотрим это понятие более подробно и детально с точки зрения химии, остановимся более подробно на самом понятии "равновесие".
Прежде чем рассмотрим это понятие более подробно и детально, остановимся более подробно на самом понятии "равновесие".
Вопрос: Какие примеры равновесия вы можете привести?
Прогнозируемый ответ обучающихся: Примером механического динамического равновесия может быть движение реки и рыбы в противоположных направлениях с равными скоростями, или движение человека, идущего по эскалатору в сторону, противоположную движению эскалатора, со скоростью, равной скорости эскалатора.
Рассмотренная выше реакция превращения сернистого газа в серный ангидрид используется в промышленности для получения серной кислоты. Если эта реакция обратима, то использовать ее крайне неэффективно, так как выход в данной реакции сернистого ангидрида весьма незначителен.
Рассмотрим факторы, влияющие на смещение равновесия в теоретическом и экспериментальном аспектах.
1 Влияние концентрации реагирующих веществ.
Если в равновесную систему вводится какое - либо из участвующих в реакции веществ, то равновесие смещается в сторону той реакции, при протекании которой данное вещество расходуется. Если из равновесной системы выводится какое - либо вещество, то равновесие смещается в сторону той реакции, при протекании которой данное вещество образуется.
2. Влияние температуры.
Прямая и обратная реакции имеют противоположные тепловые эффекты: если прямая реакция экзотермичес - кая, то обратная реакция эндотермическая (и наоборот).
При нагревании системы (т.е. повышении ее температуры) равновесие смещается в сторону эндотер - мической реакции; при охлаждении (понижении тем - пературы) равновесие смещается в сторону экзотерми - ческой реакции.
3 Влияние давления.
Давление влияет на равновесие реакции, в которых принимают участие газообразные вещества. Если внешнее давление повышается, то равновесие смещается в сторону той реакции, при протекании которой число молекул газа уменьшается. И наоборот, равновесие смещается в сторону образования большего числа газообразных молекул при понижении внешнего давления. Если реакция протекает без изменения числа газообразных веществ, то давление не влияет на равновесие в данной системе.
4 Влияние катализатора
Катализатор не влияет на смещение химического равновесия, т.к. он в одинаковой степени ускоряет прямую и обратную реакцию
Для закрепления изученного материала обучающимся предлагается выступить в роли технологов на химическом производстве, основой которого является обратимая химическая реакция. Им необходимо предложить условия для протекания данного химического процесса, чтобы сместить равновесие в сторону прямой реакции и увеличить производительность своего производства.
1 группа: N2 + 3H2 ↔ 2 NH3 + Q
2 группа: N2 + О2 ↔ 2 NО - Q
3 группа: С4Н10↔С4Н6 + 2Н2 - Q
4 группа: С2Н4 + Н2О ↔ С2Н5ОН + Q
Работ проверяется по эталону.
Для закрепления учебного материала преподаватель выдаёт домашнее задание.
Для оценки занятия обучающимся предлагается воспользоваться карточками (Приложение 3), показывая палец вверх или вниз:
1.На уроке я работал…
2.Своей работой на уроке я…
3.Урок для меня показался…
4.Мое настроение…
5.Домашнее задание мне кажется…
Все участники исследования награждаются сертификатами (Приложение 4).
Домашнее задание
Продолжите эксперимент по влиянию фактора на скорость химической реакции в домашних условиях:
1. Повторите в домашних условия опыт с перекисью водорода, но только в качестве катализатора используйте кусочек картофеля или моркови. Вы заметите бурное выделение кислорода, это работает биологический катализатор-фермент каталаза.
2. Внесите в пламя газовой горелки кусочек сахара. Он будет плавиться, но не гореть. Тогда посыпьте сахар пеплом сгоревшей бумажной салфетки и снова внесите в пламя. Сахар будет гореть. Какой фактор влияет на характер скорости горения данного органического вещества?
3. Химия: учеб. для студ. сред. проф. учеб. заведений / О.С. Габриелян, И.Г. Остроумов. §6.1 вопросы 1, 3, 4-6.
8 КОНТРОЛЬ ЗНАНИЙ И ВЫСТАВЛЕНИЕ ОЦЕНОК
Система оценки обучающихся строится на основе оценки групповой работы студентов.- уверенность, владение собой (1б),
-культура речи, поведения (1б),
-рациональная организация работы группы (1б),
-аргументированность ответа на поставленную проблему (1б).
2.
Исследователи
-правильность выполнения опытов (1б),
3.
Инженер по технике безопасности
-соблюдение правил техники безопасности в процессе эксперимента (1б),
4.
Теоретики
- правильность заполнения таблицы (1б)
5.
Качество ответов на поставленную проблему
-ответ полный и аргументированный (1б)
Максимальное количество баллов - 7
Оценка «Отлично» - 7-6 баллов;
Оценка «Хорошо» - 5-4 балла;
Оценка «Удовлетворительно» - 3 балла;
Оценка «Неудовлетворительно» - 2-0 баллов.
Эталон заполнения технологической карты 1:
№ опыта
Реагирующие вещества
Условия реакции
Скорость протекания реакции
Фактор, влияющий на скорость протекания реакции
1.
CaCO3 + HCI → CaCl2 +CO2 + H2O
CaCO3
(в порошке)
Быстрая
площадь соприкосновения реагирующих веществ
CaCO3(кусочек)
Медленная
2.
Mg + HCI → MgCl2 + H2↑
Обычные условия
Быстрая
природа реагирующего вещества
Zn + HCI → ZnCl2 + H2↑
Обычные условия
Медленная
3.
Zn + HCI → ZnCl2 + H2↑
Разбавленная HCI
Медленная
Концентрация реагирующих веществ
Концентрированная HCI
Быстрая
4.
CuO + H2SO4 →
CuSO4 + H2O
Без нагревания
Медленная
Температура
С нагреванием
Быстрая
Эталон заполнения технологической карты 2:
-
Для смещения химического равновесия в реакции:
N2 + 3H2 ↔ 2 NH3 + Q
необходимо
1. Температуру
понизить
2. Давление
повысить
3. Концентрацию N2
повысить
3. Концентрацию NH3
понизить
-
Для смещения химического равновесия в реакции:
N2 + О2 ↔ 2 NО - Q
необходимо
1. Температуру
повысить
2. Давление
Не влияет
3. Концентрацию NО
понизить
3. Концентрацию О2
повысить
-
Для смещения химического равновесия в реакции:
С4Н10↔С4Н6 + 2Н2 - Q
необходимо
1. Температуру
повысить
2. Давление
понизить
3. Концентрацию С4Н10
повысить
3. Концентрацию Н2
понизить
-
Для смещения химического равновесия в реакции:
С2Н4 + Н2О ↔ С2Н5ОН + Q
необходимо
1. Температуру
понизить
2. Давление
повысить
3. Концентрацию С2Н4
повысить
3. Концентрацию С2Н5ОН
понизить
9 СПИСОК ЛИТЕРАТУРЫ
-
Химия: учеб. для студ. сред. проф. учеб. заведений / О.С. Габриелян, И.Г. Остроумов. - М., 2008.
-
Габриелян О.С. Химия в тестах, задачах, упражнениях: учеб. пособие для студ. сред. проф. учебных заведений / О.С. Габриелян, Г.Г. Лысова - М., 2010.
-
Габриелян О.С. Практикум по общей, неорганической и органической химии: учеб. пособие для студ. сред. проф. учеб. заведений / Габриелян О.С., Остроумов И.Г., Дорофеева Н.М. - М., 2009.
-
Габриелян О.С. Химия. 10 класс. Базовый уровень: учеб. для общеобразоват. учреждений. - М., 2010.
-
Габриелян О.С. Химия. 11 класс. Базовый уровень: учеб. для общеобразоват. учреждений. - М., 2010.
-
Габриелян О.С., Остроумов И.Г., Остроумова Е.Е. Органическая химия в тестах, задачах и упражнениях. - М., 2008.
-
Габриелян О.С., Остроумов И.Г., Введенская А.Г. Общая химия в тестах, задачах и упражнениях. - М., 2008.
-
Кузьменко Н.Е., Еремин В.В., Попков В.А. Краткий курс химии. - М., 2000.
-
Пичугина Г.В. Химия и повседневная жизнь человека. - М., 2004.
Интернет-источники
www.auk-olymp.ru/doc.v?d=19courses.urc.ac.ru/eng/u6-7.html
courses.urc.ac.ru/eng/u6-7.html
www.ikt.ru
prepodavatel.narod.ru/modtechnology.html
www.akvt.ru/student/moup/obscheobrazovatelnye-discipliny
www.2.uniyar.ac.ru/projects/bio/SUBJECTS/subjects_main.htm
yuspet.narod.ru/disMeh.htm</</u>
ПРИЛОЖЕНИЕ 1
Лекция на тему: «Классификация химических реакций»
-
Классификация по числу и составу реагентов и конечных веществ
-
Классификация реакций по фазовым признакам
-
Классификация реакций по числу фаз.
-
Классификация реакций по типу переносимых частиц
-
Обратимые и необратимые химические реакции
Химические свойства веществ выявляются в разнообразных химических реакциях.
Превращения веществ, сопровождающиеся изменением их состава и (или) строения, называются химическими реакциями. Часто встречается и такое определение: химической реакцией называется процесс превращения исходных веществ (реагентов) в конечные вещества (продукты).
Химические реакции записываются посредством химических уравнений и схем, содержащих формулы исходных веществ и продуктов реакции. В химических уравнениях, в отличие от схем, число атомов каждого элемента одинаково в левой и правой частях, что отражает закон сохранения массы.
В левой части уравнения пишутся формулы исходных веществ (реагентов), в правой части - веществ, получаемых в результате протекания химической реакции (продуктов реакции, конечных веществ). Знак равенства, связывающий левую и правую часть, указывает, что общее количество атомов веществ, участвующих в реакции, остается постоянным. Это достигается расстановкой перед формулами целочисленных стехиометрических коэффициентов, показывающих количественные соотношения между реагентами и продуктами реакции.
Химические уравнения могут содержать дополнительные сведения об особенностях протекания реакции. Если химическая реакция протекает под влиянием внешних воздействий (температура, давление, излучение и т.д.), это указывается соответствующим символом, как правило, над (или "под") знаком равенства.
Огромное число химических реакций может быть сгруппировано в несколько типов реакций, которым присущи вполне определенные признаки.
В качестве классификационных признаков могут быть выбраны следующие:
1. Число и состав исходных веществ и продуктов реакции.
2. Агрегатное состояние реагентов и продуктов реакции.
3. Число фаз, в которых находятся участники реакции.
4. Природа переносимых частиц.
5. Возможность протекания реакции в прямом и обратном направлении.
6. Знак теплового эффекта разделяет все реакции на: экзотермические реакции, протекающие с экзо-эффектом - выделение энергии в форме теплоты (Q>0, ∆H <0):
С +О2 = СО2 + Q
и эндотермические реакции, протекающие с эндо-эффектом - поглощением энергии в форме теплоты (Q<0, ∆H >0):
N2 +О2 = 2NО - Q.
Такие реакции относят к термохимическим.
Рассмотрим более подробно каждый из типов реакций.
Классификация по числу и составу реагентов и конечных веществ
1. Реакции соединения
При реакциях соединения из нескольких реагирующих веществ относительно простого состава получается одно вещество более сложного состава:
A + B + C = D
Как правило, эти реакции сопровождаются выделением тепла, т.е. приводят к образованию более устойчивых и менее богатых энергией соединений.
Реакции соединения простых веществ всегда носят окислительно-восстановительный характер. Реакции соединения, протекающие между сложными веществами, могут происходить как без изменения валентности:
СаСО3 + СО2 + Н2О = Са(НСО3)2,
так и относиться к числу окислительно-восстановительных:
2FеСl2 + Сl2 = 2FеСl3.
2. Реакции разложения
Реакции разложения приводят к образованию нескольких соединений из одного сложного вещества:
А = В + С + D.
Продуктами разложения сложного вещества могут быть как простые, так и сложные вещества.
Из реакций разложения, протекающих без изменения
валентных состояний, следует отметить разложение кристаллогидратов,
оснований, кислот и солей кислородсодержащих кислот:
К реакциям разложения окислительно-восстановительного характера
относится разложение оксидов, кислот и солей, образованных
элементами в высших степенях окисления: 2AgNO3 = 2Ag +
2NO2 + O2,
(NH4)2Cr2O7 =
Cr2O3 + N2 + 4H2O.
Особенно характерны окислительно-восстановительные реакции разложения для солей азотной кислоты.
Реакции разложения в органической химии носят название крекинга:
С18H38 = С9H18 + С9H20,
или дегидрирования
C4H10 = C4H6 + 2H2.
3. Реакции замещения
При реакциях замещения обычно простое вещество взаимодействует со сложным, образуя другое простое вещество и другое сложное:
А + ВС = АВ + С.
Эти реакции в подавляющем большинстве принадлежат к окислительно-восстановительным:
2Аl + Fe2O3 = 2Fе + Аl2О3,
Zn + 2НСl = ZnСl2 + Н2,
2КВr + Сl2 = 2КСl + Вr2,
2КСlO3 + l2 = 2KlO3 + Сl2.
Примеры реакций замещения, не сопровождающихся изменением валентных состояний атомов, крайне немногочисленны. Следует отметить реакцию двуокиси кремния с солями кислородсодержащих кислот, которым отвечают газообразные или летучие ангидриды:
СаСО3+ SiO2 = СаSiO3 + СО2,
Са3(РО4)2 + ЗSiO2 = ЗСаSiO3 + Р2О5,
Иногда эти реакции рассматривают как реакции обмена:
СН4 + Сl2 = СН3Сl + НСl.
4. Реакции обмена
Реакциями обмена называют реакции между двумя соединениями, которые обмениваются между собой своими составными частями:
АВ + СD = АD + СВ.
Если при реакциях замещения протекают окислительно-восстановительные процессы, то реакции обмена всегда происходят без изменения валентного состояния атомов. Это наиболее распространенная группа реакций между сложными веществами - оксидами, основаниями, кислотами и солями:
ZnO + Н2SО4 = ZnSО4 + Н2О,
AgNО3 + КВr = АgВr + КNО3,
СrСl3 + ЗNаОН = Сr(ОН)3 + ЗNаСl.
Частный случай этих реакций обмена - реакции нейтрализации:
НСl + КОН = КСl + Н2О.
Обычно эти реакции подчиняются законам химического равновесия и протекают в том направлении, где хотя бы одно из веществ удаляется из сферы реакции в виде газообразного, летучего вещества, осадка или малодиссоциирующего (для растворов) соединения:
NаНСО3 + НСl = NаСl + Н2О + СО2↑,
Са(НСО3)2 + Са(ОН)2 = 2СаСО3↓ + 2Н2О,
СН3СООNа + Н3РО4 = СН3СООН + NаН2РО4.
5. Реакции переноса.
При реакциях переноса атом или группа атомов переходит от одной структурной единицы к другой:
АВ + ВС = А + В2С,
А2В + 2СВ2 = АСВ2 +АСВ3.
Например:
2AgCl + SnCl2 = 2Ag + SnCl4,
H2O + 2NO2 = HNO2 + HNO3.
Классификация реакций по фазовым признакам
В зависимости от агрегатного состояния реагирующих веществ различают следующие реакции:
1. Газовые реакции2. Реакции в растворах
NaОН(р-р) + НСl(p-p) = NaСl(p-p) + Н2О(ж)
3. Реакции между твердыми веществамиКлассификация реакций по числу фаз.
Под фазой понимают совокупность однородных частей системы с одинаковыми физическими и химическими свойствами и отделенных друг от друга поверхностью раздела.
Все многообразие реакций с этой точки зрения можно разделить на два класса:
1.Гомогенные (однофазные) реакции. К ним относят реакции, протекающие в газовой фазе, и целый ряд реакций, протекающих в растворах .
2.Гетерогенные (многофазные) реакции. К ним относят реакции, в которых реагенты и продукты реакции находятся в разных фазах. Например:
газожидкофазные реакции
CO2(г) + NaOH(p-p) = NaHCO3(p-p).
газотвердофазные реакции
СO2(г) + СаО(тв) = СаСO3(тв).
жидкотвердофазные реакции
Na2SO4(р-р) + ВаСl3(р-р) = ВаSО4(тв)↓ + 2NaСl(p-p).
жидкогазотвердофазные реакции
Са(НСО3)2(р-р) + Н2SО4(р-р) = СО2(r)↑ +Н2О(ж) + СаSО4(тв)↓.
Классификация реакций по типу переносимых частиц
1. Протолитические реакции.
К протолитическим реакциям относят химические процессы, суть которых заключается в переносе протона от одних реагирующих веществ к другим.
В основе этой классификации лежит протолитическая теория кислот и оснований, в соответствии с которой кислотой считают любое вещество, отдающее протон, а основанием - вещество, способное присоединять протон, например: К протолитическим реакциям относят реакции нейтрализации и гидролиза.
2. Окислительно-восстановительные реакции.
К таковым относят реакции, в которых реагирующие вещества обмениваются электронами, изменяя при этом степени окисления атомов элементов, входящих в состав реагирующих веществ. Например:
Zn + 2H+ → Zn2+ + H2↑,
FeS2 + 8HNO3(конц) = Fe(NO3)3 + 5NO↑ + 2H2SO4 + 2H2O,
Подавляющее большинство химических реакций относятся к окислительно-восстановительным, они играют исключительно важную роль.
3. Лиганднообменные реакции.
К таковым относят реакции, в ходе которых происходит перенос электронной пары с образованием ковалентной связи по донорно-акцепторному механизму. Например:
Cu(NO3)2 + 4NH3 = [Cu(NH3)4](NO3)2,
Fe + 5CO = [Fe(CO)5],
Al(OH)3 + NaOH = [NaAl(OH)4].
Характерной особенностью лиганднообменных реакций является то, что образование новых соединений, называемых комплексными, происходит без изменения степени окисления.
4. Реакции атомно-молекулярного обмена.
К данному типу реакций относятся многие из изучаемых в органической химии реакций замещения, протекающие по радикальному, электрофильному или нуклеофильному механизму.
Обратимые и необратимые химические реакции
Обратимыми называют такие химические процессы, продукты которых способны реагировать друг с другом в тех же условиях, в которых они получены, с образованием исходных веществ.
Для обратимых реакций уравнение принято записывать следующим образом:
А + В ![]() АВ.
АВ.
Две противоположно направленные стрелки указывают на то, что при одних и тех же условиях одновременно протекает как прямая, так и обратная реакция, например:
СН3СООН +
С2Н5ОН ![]() СН3СООС2Н5 + Н2О.
СН3СООС2Н5 + Н2О.
Необратимыми называют такие химические процессы, продукты которых не способны реагировать друг с другом с образованием исходных веществ. Примерами необратимых реакций может служить разложение бертолетовой соли при нагревании:
2КСlО3 → 2КСl + ЗО2↑,
или окисление глюкозы кислородом воздуха:
С6Н12О6 + 6О2 → 6СО2 + 6Н2О.
ПРИЛОЖЕНИЕ 2
Правила техники безопасности при работе в химической лаборатории
1. При проведении опытов надо быть внимательными и осторожными.
2. Твердые вещества берите из баночек только сухой ложкой или сухой пробиркой.
3. Наливайте жидкость и насыпайте твердые вещества в пробирку осторожно. Предварительно проверьте, не разбито ли у пробирки дно и не имеет ли она трещин.
4. При выяснении запаха веществ не подносите сосуд близко к лицу, ибо вдыхание паров и газов может вызвать раздражение дыхательных путей. Для ознакомления с запахом нужно его проверить движением руки от отверстия сосуда к носу.
5. Нагревая пробирку с жидкостью, держите ее так, чтобы открытый конец ее был направлен в сторону и от самого себя, и от соседей. Производите опыты только над столом.
6. В случае ожога, пореза или попадания едкой и горячей жидкости на кожу или одежду немедленно обращайтесь к учителю.
7. Не приступайте к выполнению опыта, не зная, что и как нужно делать.
8. После проведения химических опытов приведите рабочее место в порядок.
ПРИЛОЖЕНИЕ 3
Сигнальные карточки

ПРИЛОЖЕНИЕ 4
Таблица «Ряд активности металлов»
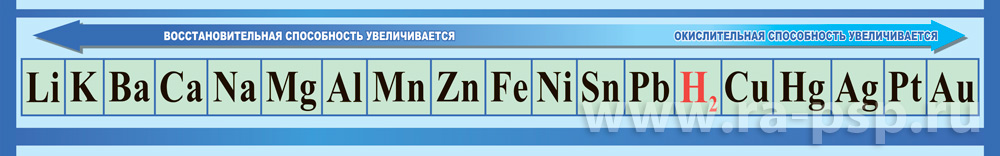
ПРИЛОЖЕНИЕ 5
Технологическая карта 1
№ опыта
Реагирующие вещества
Условия реакции
Скорость протекания реакции
Фактор, влияющий на скорость протекания реакции
1.
CaCO3
(в порошке)
CaCO3(кусочек)
2.
Обычные условия
Обычные условия
3.
Разбавленная HCI
Концентрированная HCI
4.
Без нагревания
С нагреванием
Ответы на вопросы
1.______________________________________________________________________________________________________________________________________________________________________________________________
2._______________________________________________________________________________________________________________________________________________________________________________________________
ПРИЛОЖЕНИЕ 6
Алгоритм проведения исследования
Группа 1
Вносим в первую пробирку порошок мела (СаСО3), во вторую кусочек мела. Наливаем в каждую пробирку по 2 мл соляной кислоты (НСl).
Что наблюдаете? Результат запишите в технологическую карту.
Дайте ответ на вопрос: Почему цемент, используемый при строительстве, всегда имеет порошкообразную консистенцию?
Группа 2
Наливаем в две пробирки по 1-2 мл раствора соляной кислоты (НСl). Опускаем в первую пробирку металл цинк, во вторую магний. Найдите эти элементы в ряду напряжения металлов, сравните их по химической активности. По объёму выделившихся пузырьков водорода определите скорость химической реакции. Результат запишите в технологическую карту.
Дайте ответ на вопрос: Почему купола храмов при строительстве покрывают сусальным золотом, а не медью, которая значительно дешевле?
Группа 3
В 2 пробирки налейте раствор HCl, в первую добавьте немного воды. В каждую пробирку поместите одинаковые гранулы Zn. По объёму выделившихся пузырьков водорода определите скорость химической реакции.
Дайте ответ на вопрос: Почему для чистки сильных загрязненных поверхностей в домашних условиях концентрированные средства более эффективны при небольшом расходе?
Группа 4
В 2 пробирки насыпьте немного порошка CuO, добавьте 3-5мл раствора H2SO4 . Первую пробирку поставьте в штатив, вторую аккуратно нагрейте в пламени спиртовки. По изменению окраски раствора сделайте вывод о скорости протекания химической реакции.
Дайте ответ на вопрос: Почему срок службы металлических конструкций в в южных регионах меньше, чем в северных?
ПРИЛОЖЕНИЕ 7
Роли обучающихся в «научной лаборатории»Буравцов Степан
«научный руководитель» - отвечает за работу группы, делает доклад о результатах исследования;
Звонарев Александр
теоретик - отвечает за правильность оформления технологической карты
Соломина Екатерина
теоретик - даёт ответ на поставленный вопрос
Арыхов Денис
2 исследователя - проводят эксперимент
Дурсунов Мурад
Абраамян Саргис
инженер по технике безопасности - следит за соблюдением правил техники безопасности при проведении эксперимента
Роли обучающихся в «научной лаборатории»
Роли обучающихся в «научной лаборатории»
Роли обучающихся в «научной лаборатории»Дрозд Иван
Доброквашин Николай
2 исследователя - проводят эксперимент
Шаталова Диана
Нальгиев Магомед
инженер по технике безопасности - следит за соблюдением правил техники безопасности при проведении эксперимента
ПРИЛОЖЕНИЕ 8
Технологическая карта 2Для смещения химического равновесия в реакции:
N2 + 3H2 ↔ 2 NH3 + Q
необходимо
1. Температуру
2. Давление
3. Концентрацию N2
3. Концентрацию NH3
Технологическая карта 2
-
Для смещения химического равновесия в реакции:
N2 + О2 ↔ 2 NО - Q
необходимо
1. Температуру
2. Давление
3. Концентрацию NО
3. Концентрацию О2
Технологическая карта 2
-
Для смещения химического равновесия в реакции:
С2Н4 + Н2О ↔ С2Н5ОН + Q
необходимо
1. Температуру
2. Давление
3. Концентрацию С2Н4
3. Концентрацию С2Н5ОН
Для смещения химического равновесия в реакции:
С4Н10↔С4Н6 + 2Н2 - Q
необходимо
1. Температуру
2. Давление
3. Концентрацию С4Н10
3. Концентрацию Н2
Технологическая карта 1