- Учителю
- Му ПО ЛАБОРАТОРНЫМ РАБОТАМ
Му ПО ЛАБОРАТОРНЫМ РАБОТАМ
ХИМИЧЕСКАЯ ПОСУДА, ПРАВИЛА РАБОТЫ
Химическая посуда по своему назначению делится на следующие виды:
- посуда общего назначения, без которой нельзя провести большинство работ (пробирки, воронки, химические стаканы, конические колбы Эрленмейера, плоскодонные колбы, кристаллизаторы, чашки Петри, бюксы и др.);
- посуда специального назначения, необходимая для одной определенной цели (пикнометры, ареометры, дефлегматоры, холодильники, круглодонные колбы, колбы Кьельдаля и др.);
- мерная посуда для измерения объема жидкостей -
точная
(пипетки, бюретки, мерные колбы) и неточная (мерные цилиндры,
мензурки, мерные стаканы, градуированные пробирки).
ПОСУДА ОБЩЕГО НАЗНАЧЕНИЯ
Посуда общего назначения представлена на рис. 1.
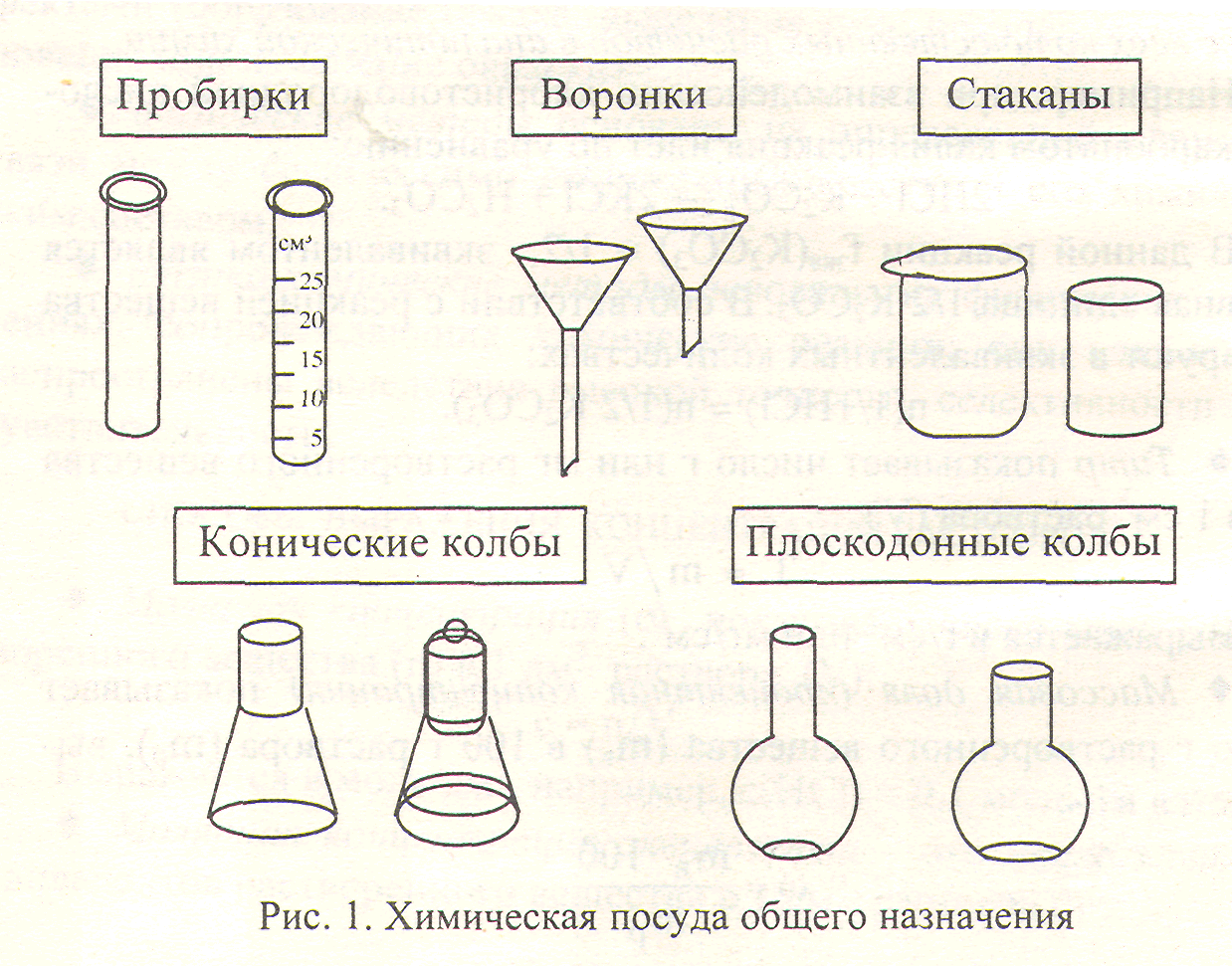
Пробирки - узкие цилиндрической формы сосуды с закругленным дном, применяются для аналитических и микрохимических работ. Градуированные пробирки предназначены для измерения объема жидкостей.
Воронки служат для переливания жидкостей, фильтрования, в титриметрическом анализе - для приготовления растворов и заполнения бюреток. В зависимости от назначения применяются воронки различного диаметра - от 35 до 300 мм.
Химические стаканы - тонкостенные цилиндры различной вместимости от 50 до 1000 см3. Стаканы, как и другую химическую посуду, изготавливают из термо- и химически стойкого стекла. Стаканы из термостойкого стекла маркируют специальным знаком - матовым прямоугольником или кругом. Такую посуду можно применять для нагревания.
Конические колбы Эрленмейера широко применяются при титровании. Они бывают различной вместимости (50 -1000 см3), узкогорлые и широкогорлые. Конические колбы, снабженные шлифами и пришлифованными пробками, применяются для установления йодного числа и при иодометрических определениях. Изготавливают колбы из тонкостенного или термостойкого стекла, о чем свидетельствует маркировка на колбе.
Плоскодонные колбы вместимостью 50 -2000 см3 изготавливают со шлифами и без них из обычного или специальных сортов стекла.
МЕРНАЯ ПОСУДА
Мерная посуда предназначена для измерения объема жидкостей. Различают точную и неточную мерную посуду.
К неточной мерной посуде относятся мерные цилиндры и мензурки (рис. 2), они непригодны для точного измерения объемов с требуемой в титриметрическом анализе точностью. Поэтому ее применяют для измерения объемов вспомогательных растворов, не принимаемых во внимание при расчете результатов анализа.
Мерные цилиндры - стеклянные толстостенные сосуды с нанесенными на внешней стенке делениями, указывающими вместимость (5 - 2000 см3).
Мензурки - сосуды конической формы, на стенке которых так же, как на мерных цилиндрах, нанесена шкала. Вместимость мензурок 50 - 1000 см3.

Для точных измерений и приготовления стандартных растворов служит точная мерная посуда (рис. 3).
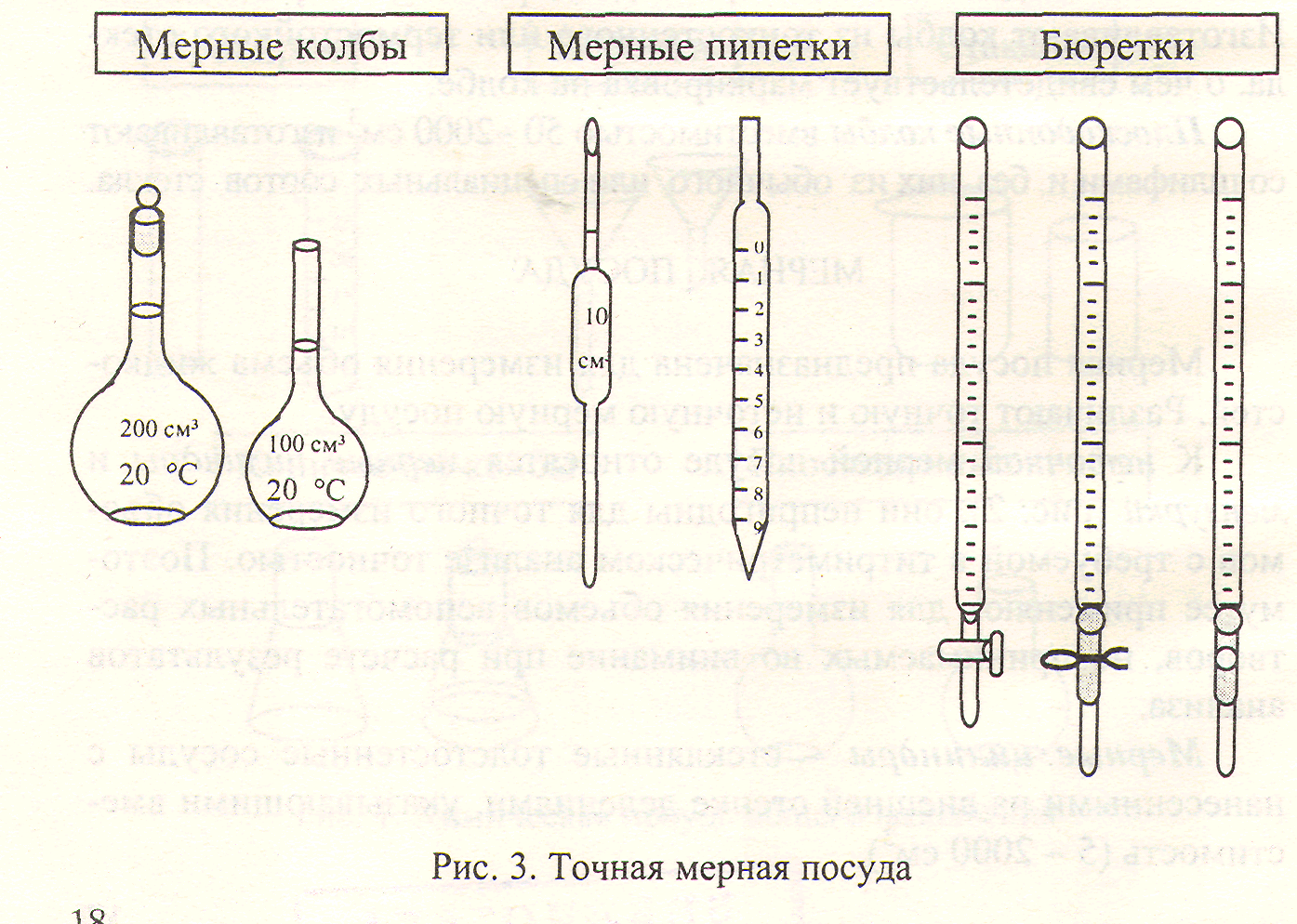
Мерные колбы - плоскодонные сосуды вместимостью 25,00 - 2000,0 см3 с узким длинным горлом и нанесенной на нем кольцевой меткой. Метка соответствует вместимости колбы, указанной на штампе, при 20 °С. Колбы изготавливают со шлифами (пришлифованная пробка).
Мерные колбы применяют для приготовления стандартных растворов и разбавления растворов с точной концентрацией до определенного объема.
Наполняют мерную колбу сначала через воронку, последние 1 - 2 см3 доливают осторожно капельной пипеткой, пока нижний мениск жидкости коснется кольцевой метки.
Нижний мениск жидкости должен располагаться строго на метке, глаза работающего при этом должны находиться на уровне метки мерной колбы (рис. 4).

Мерную колбу закрывают пробкой, раствор тщательно перемешивают.
Пипетка в переводе с французского "pipette" означает трубочка. Применяется для точного измерения определенного объема раствора и перенесения его из одного сосуда в другой. Мерные пипетки различают двух типов - пипетки Мора и градуированные. Пипетка Мора представляет собой стеклянную трубочку небольшого диаметра с расширением в средней части. Нижний конец пипетки слегка оттянут, и имеет диаметр около 0,1 мм. В верхней части пипетки нанесена одна кольцевая метка, соответствующая вместимости пипетки при 20 °С. Вместимость пипеток Мора 1,00-100,00 см3.
Градуированные пипетки - стеклянные трубки с нанесенными на внешней стенке делениями шкалы. В зависимости от вместимости пипеток (1,00-10,00 см3) цена деления различна (0,01-0,10 см3). Для точного измерения малых объемов применяются микропипетки вместимостью 0,10 и 0,20 см3.
Для наполнения пипетки нижний конец ее погружают в раствор и втягивают его с помощью резиновой груши или специальных насадок.
При отборе жидкости пипетка всегда должна находиться в строго вертикальном положении.
Пипетка должна находиться в правой руке, резиновая груша - в левой. Раствор набирают так, чтобы его уровень был на 2-3 см выше кольцевой метки. Затем вынимают грушу из отверстия пипетки, быстрым движением закрывают отверстие указательным (!) пальцем правой (!) руки, придерживая в то же время пипетку большим и средним пальцами.
Извлекая пипетку из раствора, слегка ослабляют нажим указательного пальца, в результате раствор медленно вытекает из пипетки. Как только нижний мениск жидкости окажется на одном уровне с меткой, указательный палец крепко прижимают (рис. 5).
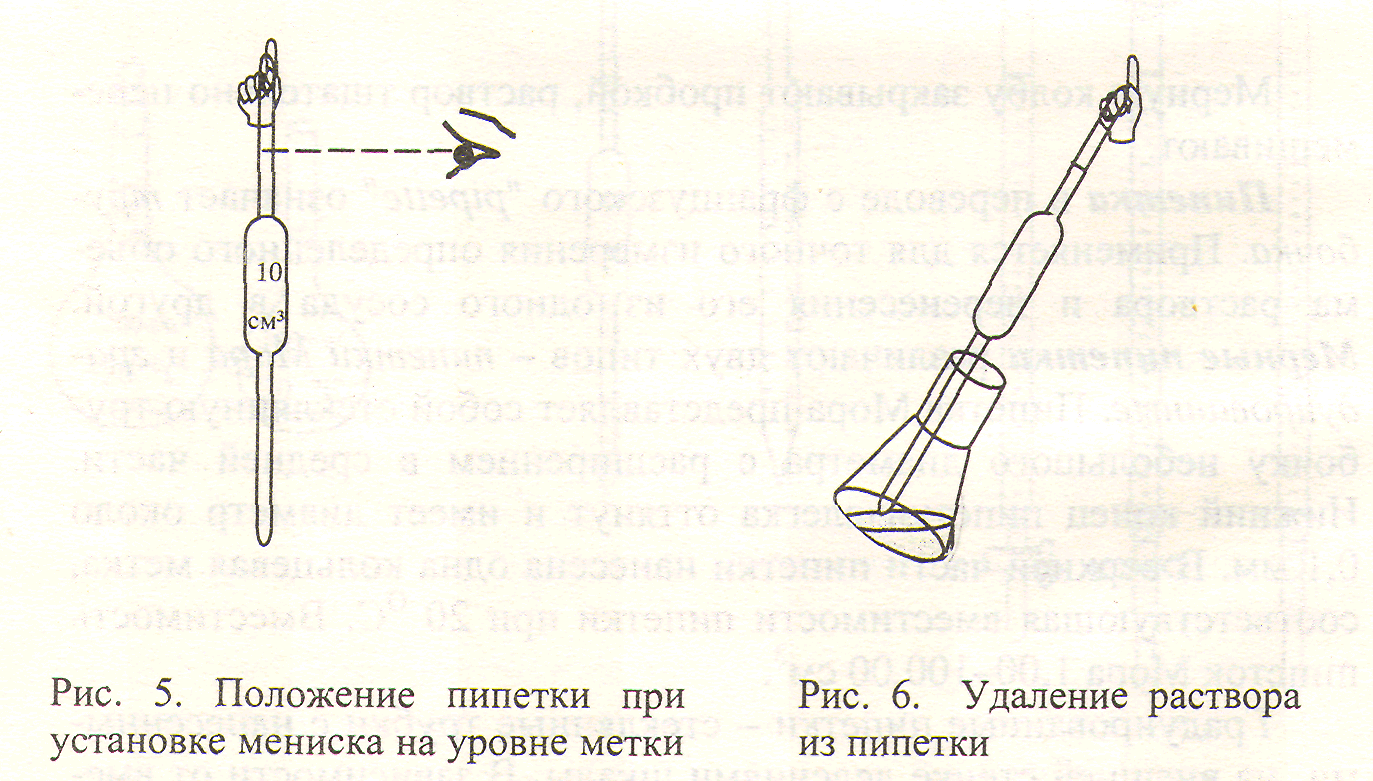
Глаза работающего должны находиться на уровне метки.
Аккуратно переносят содержимое пипетки в колбу, отнимают палец и дают раствору из пипетки стечь по стенке колбы. После того, как раствор вытечет из пипетки, колбу слегка наклоняют, открывая ее дно, и трижды касаются открытого дна «носиком» пипетки (рис. 6). Оставшуюся в «носике» часть раствора не удаляют из пипетки: градуирование пипеток рассчитано именно на такой способ удаления остатка раствора.
Объем раствора, вытекающего из пипетки, зависит от способа удаления остатка раствора. Поэтому не следует удалять остатки раствора из пипетки выдуванием или нагреванием рукой расширенной части пипетки.
Бюретки предназначены для измерения объема титранта. В переводе с французского "burette" значит склянка, графинчик. Бюретки представляют собой градуированные стеклянные трубки вместимостью 10,00 - 100,0 см3 с краном, зажимом или другим затвором. Основные деления нанесены, как правило, через каждый 1.0 см3, цена малого деления обычно составляет 0,10 см3, что позволяет измерять объем с точностью ±0,05 см3. Для измерения малых объемов растворов применяют микробюретки вместимостью 1,000 - 5,000 см3 с ценой деления 0,01 см3, точность отсчета при этом составляет ±0,005 см3.
Бюретки бывают с притертыми кранами и без крана с оттянутым нижним концом, к которому с помощью резиновой трубки присоединяют оттянутую в капилляр стеклянную трубку («носик»). При этом затвором является зажим Мора на резиновой трубке или стеклянная бусинка внутри нее (рис. 3). Если резиновую трубку, слегка нажав, оттянуть от бусинки, между ней и трубкой образуются небольшие каналы, через которые жидкость вытекает из бюретки.
Бюретки с кранами применимы для всех растворов, кроме щелочей, которые могут вызывать «заедание» притертых кранов. Для работы с растворами щелочей предназначены бюретки без крана с резиновыми насадками. При титровании растворами, которые могут разрушать резину (например, раствор йода), пользуются бюретками со стеклянными кранами.
При работе бюретки закрепляют на лабораторных штативах в «лапках». Необходимо следить за тем, чтобы бюретка располагалась без перекосов строго перпендикулярно поверхности стола.
Бюретки предназначены для ответственной работы - титрования, поэтому их следует содержать в особой чистоте. Из чистой бюретки жидкость вытекает равномерно, не оставляя на стенках капель. Вымытые бюретки не сушат, для удаления оставшейся коды их ополаскивают титрантом, предназначенным для данного титрования.
Наполняют бюретку с помощью воронки, затем воронку удаляют из бюретки, так как во время титрования из воронки может стекать раствор и измерение объема будет неточным.
При заполнении бюретки раствором необходимо следить, чтобы к ее нижней части не оставались пузырьки воздуха. Из бюретки с краном воздух удаляют быстрым спусканием раствора, (кран открывают полностью). Из бюреток без крана воздух удаляют, изогнув резиновую трубку с «носиком» так, чтобы она образовала с бюреткой сообщающийся сосуд, и кончик «носика» направлялся вверх в сторону от работающего и его соседей. Затем осторожно открывают зажим и вытесняют раствором весь воздух. Зажим закрывают, когда из «носика» вытекает жидкость.
После удаления из бюретки воздуха уровень раствора устанавливают на нуль. Бюретку заполняют так, чтобы уровень раствора был выше нулевого деления шкалы на 3 - 4 см. Затем, осторожно приоткрыв затвор, аккуратно устанавливают уровень жидкости, нижний мениск должен достигать нулевого деления.
При отсчете по бюретке глаза работающего должны находиться точно на уровне мениска (рис. 7).
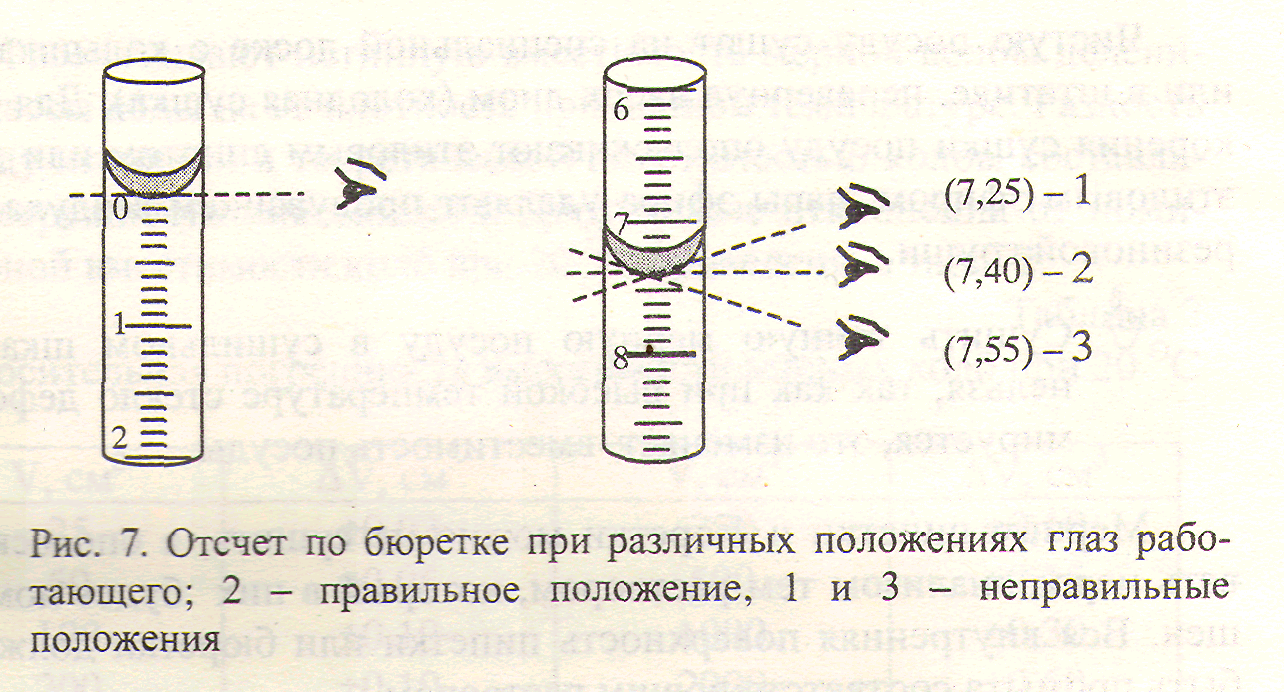
Уровень прозрачных растворов устанавливают по нижнему мениску, сильноокрашенных или непрозрачных - по верхнему.
Титрование проводится равномерно, скорость вытекания раствора из бюретки должна быть небольшой, чтобы раствор успевал стекать со стенок. По той же причине отсчет по бюретке не ранее, чем через 30 с после окончания титрования.
Перед каждым титрованием уровень раствора в бюретке устанавливают на нулевое деление шкалы, т. е. пользуются одной и той же частью бюретки.
СПОСОБЫ ПРИГОТОВЛЕНИЯ ТИТРОВАННЫХ РАСТВОРОВ
Точность титриметрических определений обусловливается точностью установления концентрации рабочего раствора (титранта). Точную концентрацию рабочего раствора находят с помощью стандартного раствора. Титрованные (с известным титром) растворы готовят следующими способами.
1. Приготовление титрованного раствора по точной навеске стандартного вещества. Рассчитывают массу навески стандартного вещества, необходимую для приготовления раствора заданной концентрации в заданном объеме раствора. Массу навески вещества, взятую на аналитических весах, количественно (полностью) переносят в мерную колбу заданной вместимости, растворяют в небольшом объеме воды, доводят до метки дистиллированной водой (рис. 10).
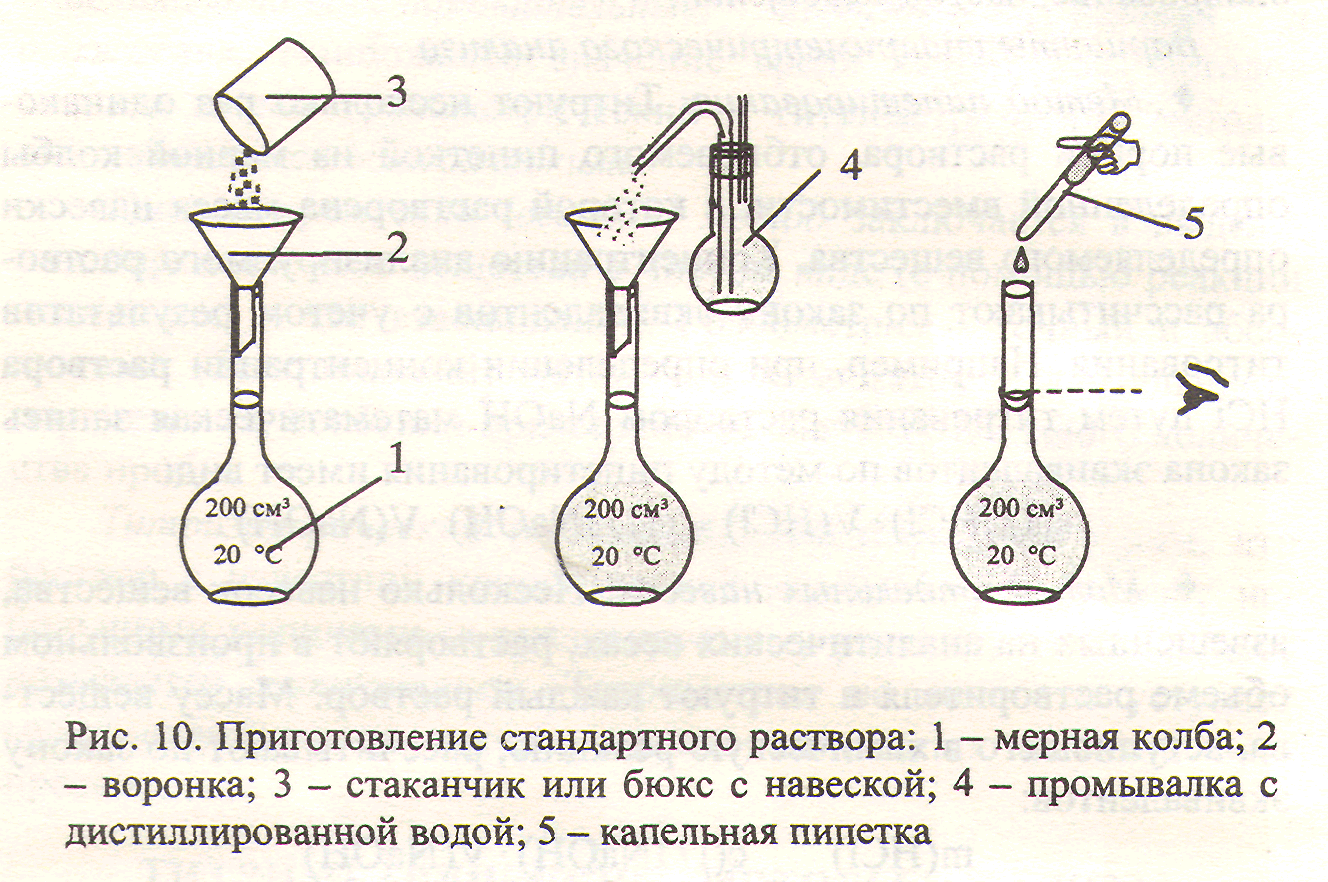
Приготовленный таким способом раствор называется стандартным или с приготовленным титром.
Так готовят растворы только из стандартных (исходных) веществ, отвечающих следующим требованиям:
- состав соединения должен точно соответствовать химической формуле, например Н2С2О4 • 2Н2О; Na2B4O7 • 10Н2О;
- вещество должно быть химически чистым (массовая доля примесей не выше 0,05 %) или должен быть известен простой способ очистки вещества от примесей;
- вещество должно быть химически устойчивым при хранении (не изменяться при высушивании, не быть гигроскопичным, не взаимодействовать с компонентами воздуха);
- вещество должно иметь по возможности большую молекулярную массу, чтобы уменьшить погрешность при взвешивании.
-
Приготовление рабочего раствора по неточной навеске (КОН, NaOH) или разбавлением более концентрированного раствора (НС1, Н2SО4, НNОз). При этом нет необходимости отбирать точную навеску вещества, так как при всей тщательности взвешивания из таких веществ нельзя получить раствор с точной концентрацией. Поэтому для приготовления рабочих растворов
навеску взвешивают на технических весах и применяют неточную мерную посуду. Для стандартизации рабочего раствора его титруют стандартным раствором. Такие растворы называют стандартизированными или с установленным титром.
-
Приготовление титрованного раствора из фиксанала.
Фиксанал - запаянная ампула, в которой находится точно известное количество вещества или раствора (0,1 моль-экв). Содержимое ампулы количественно переводят в мерную колбу заданного объема, разбивая ампулу о вложенный в воронку боек (рис. 11). Вторым бойком разбивают верхнее углубление ампулы, с помощью промывалки через отверстие тщательно промывают ампулу.
Для промывки рекомендуется не менее, чем 6-кратный объем воды (по сравнению с вместимостью ампулы). Раствор доводят до метки дистиллированной водой и перемешивают. Из фиксанала готовят как стандартные, так и рабочие растворы. Это быстрый и достаточно точный способ приготовления титрованных растворов.

ПРОГРАММА ДЛЯ ТЕСТИРОВАНИЯ
1. Укажите весы и мерную посуду для приготовления стандартного раствора.
1. Технические весы, мерный цилиндр.
2. Аналитические весы, мерный цилиндр.
3. Аналитические весы, мерная колба.
4. Технические весы, мерная колба.
2. Какова точность взвешивания на аналитических демпферных весах?
1. 0,0020.
2. 0,0001
3. 0,0002
4. 0,0010
3. Какая посуда неприменима для точного измерения объема?
1. Мерный цилиндр.
2. Мерная колба.
3. Пипетка.
4. Бюретка.
4. Какие весы и мерная посуда применяются для приготовления рабочего раствора?
1. Технические весы, мерная колба.
2. Аналитические весы, мерный цилиндр.
3. Аналитические весы, мерная колба.
4. Технические весы, мерный цилиндр.
5. Какова точность измерения объема по бюретке вместимостью 25 см3?
1. 0,01.
2. 0,05.
3. 0,10.
4. 1,00.
6. Какая посуда не относится к точной мерной посуде?
1. Пипетка Мора.
2. Бюретка.
3. Мерная колба
4. Мерный цилиндр.
7. Закончите определение: молярная концентрация показывает, сколько…
1. …граммов вещества содержится в 100 г раствора.
2. …граммов вещества содержится в 1 дм3 раствора.
3. … моль вещества содержится в 1 дм3 раствора.
4. …моль вещества содержится в 1 см3 раствора.
8. При отсчете по бюретке глаза работающего находились выше уровня мениска. Какой результат?
1. Правильный.
2. Заниженный.
3. Завышенный.
4. Положение глаз не имеет.
9. Какая посуда применяется для отбора пробы при тировании?
1. Бюретка.
2. Мерная колба.
3. Мерный цилиндр.
4. Пипетка.
10. Укажите правильный способ взвешивания гигроскопического вещества на аналитических весах.
1. В химическом стакане.
2. В закрытом бюксе.
3. На часовом стекле.
4. На кальке.
11. Укажите способ приготовления титрованного раствора.
1. Массу навески щавелевой кислоты взвешивают на аналитических весах и растворяют в мерной колбе.
2. Концентрированный раствор хлористоводородной кислоты отмеряют мерным цилиндром и разбавляют водой в мерной колбе.
3. Массу навески гидроксида натрия взвешивают на аналитических весах и растворяют в мерной колбе.
4. Массу навески тетрабората натрия взвешивают на аналитических весах и растворяют в мерном цилиндре.
12. Укажите ошибку при работе с мерной колбой.
1. Перед приготовлением раствора колбу ополоснули дистиллированной водой
2. Раствор готовили при 20 0С.
3. Уровень раствора отметили по верхнему мениску.
4. Мерную колбу применили для разбавления стандартного раствора.
13. Какое вещество применяется для стандартизации рабочего раствора гидроксида натрия?
1. СН3СООН.
2. Na2B4O7 ∙ 10Н2О.
3. Н2С2О4 ∙ 2 Н2О.
4. НСl.
14. Укажите правильную запись измерения объема раствора по бюретке вместимостью 25 см3.
1. 15,3.
2. 15,32.
3. 15,320.
4. 15,35.
15. Какие весы и посуда применяются для приготовления раствора с установленным титром?
1. Аналитические весы, мензурка.
2. Технические весы, мерный цилиндр.
3. Технические весы, мерная колба.
4. Аналитические весы, мерная колба.
16. Закончите определение: титром называется число…
1. …миллиграммов вещества, содержащееся в 1 дм3 раствора.
2. … граммов вещества, содержащееся в 1 дм3 раствора.
3. … граммов вещества, содержащееся в 1 см3 раствора.
4. … граммов вещества, содержащееся в 100 г раствора.
17. Как правильно приготовить титрованный раствор?
1. Массу навески перенести в мерную колбу, постепенно при перемешивании растворить и раствор довести до метки дистиллированной водой.
2. Массу навески перенести в мерный цилиндр, довести дистиллированной водой до требуемого объема.
3. Массу навески перенести в мерную колбу, раствор довести до метки дистиллированной водой.
4. Массу навески перенести в мензурку, добавить при перемешивании требуемый объем дистиллированной воды.
18. Закончите определение: титром называется раствор…
1. …приготовленный разбавлением более концентрированного раствора хлористоводородной кислоты.
2. …приготовленный из навески щавелевой кислоты, взвешенной на аналитических весах и растворенной в химическом стакане.
3. …приготовленный из навески хлорида натрия, взвешенной на технохимических весах и растворенной в мерной колбе.
4. …приготовленный разбавлением концентрированного раствора гидроксида натрия и оттитрованный раствором щавелевой кислоты.
Лабораторная работа №1.
Тема: Определение вязкости жидкостей.
Цель: Ознакомиться с вискозиметрическим методом определения вязкости. Экспериментально определить относительную вязкость глицерина.
Знать: вязкость жидкостей, ее зависимость от различных факторов.
Уметь: определять вязкость жидкостей вискозиметрическим методом, на основании опытных данных рассчитывать относительную вязкость.
Реактивы и оборудование: вискозиметр, секундомер, мерный цилиндр, химические стаканчики на 50 мл, дистиллированная вода, глицерин.
Теоретическое пояснение.
Вязкостью, или внутренним трением, называется сопротивление, возникающее при движении одних слоев жидкости относительно других. Величина сопротивления для разных жидкостей различна и зависит от химической природы жидкостей, т. е. от сил межмолекулярного взаимодействия.
Определение вязкости имеет большое значение при изучении свойств растворов белков, углеводов и жиров. От вязкости зависит скорость диффузии веществ в жидких средах, а следовательно, и скорость химических реакций в растворах.
Вязкость количественно характеризуется коэффициентом вязкости ђ. Под коэффициентом вязкости понимают силу, необходимую для перемещения слоя жидкости площадью 1 см2(м2) со скоростью в 1 см/сек (м/сек) по отношению к другому слою, расположенному на расстоянии 1 см (м) от первого. Вязкость измеряется в пуазах (ньютон . секунда/м2).
На практике обычно определяют относительную вязкость, т. е. отношение вязкости исследуемой жидкости к вязкости воды, принимая вязкость воды равной одному сантипуазу (спз).
Один из методов измерения вязкости основан на определении времени истечения жидкости из капиллярной трубки вискозиметра. Время истечения равных объемов воды и исследуемой жидкости определяется в секундах. На основании опытных данных рассчитывают относительную вязкость по формуле
ђж(H2О) = ђH2О . pж . tж / pH2О . tH2О
где ђж(H2О) - относительная вязкость исследуемой жидкости по воде;
ђH2О - коэффициент вязкости воды, равный 1 спз;
pж и pH2О - плотность исследуемой жидкости и воды;
tж и tH2О - время истечения исследуемой жидкости и воды.
Ход работы.
1. Заполнить вискозиметр водой.
Определить время истечения воды, объемом 5 мл.
Определение повторить 3 раза и найти средний результат, данные записать в таблицу.
-
t 1
t 2
t 3
t ср
2. Заполнить вискозиметр глицерином.
Определить время истечения глицерина, объемом 5 мл.
Определение повторить 3 раза и найти средний результат, данные записать в таблицу.
3. Вычислить относительную вязкость глицерина по формуле:
ђж(H2О) = ђH2О . pж . tж / pH2О . tH2О
p глицерина - 1,26 г/см3
p воды - 1 г/см3
Контрольные вопросы.
1. Что такое вязкость?
2. Как количественно характеризуют вязкость?
3. Что понимают под коэффициентом вязкости, в каких единицах он измеряется?
4. Как определяют относительную вязкость?
5. Что влияет на величину вязкости?
6. Почему с увеличением температуры вязкость жидкости уменьшается?
7. Почему в пищевых производствах необходимо учитывать такую физико-химическую характеристику жидкости, как вязкость?
Лабораторная работа № 2.
Тема: Определение относительного поверхностного натяжения жидкости.
Цель: Ознакомление со сталагмометрическим методом определения величины поверхностного натяжения жидкостей.
Знать: механизм возникновения поверхностного натяжения; факторы, влияющие на величину поверхностного натяжения.
Уметь: определять опытным путем поверхностное натяжение жидкостей.
Реактивы и оборудование: бюретка, химические стаканчики на 50 мл, мерные цилиндры, NaOH р-р.
Теоретическое пояснение.
Свободная энергия поверхности жидкости называется поверхностным натяжением и обозначается δ (сигма). Поверхностное натяжение может быть измерено той работой, которую нужно затратить на преодоление сил сцепления между молекулами для создания новой единицы поверхности.
δ = A / S ( Дж/м2, эрг/см²)
где А - сила действующая на единицу длины поверхности S.
Поверхностное натяжение жидкостей может резко изменяться при растворении в них различных веществ.
Вещества, значительно снижающие поверхностное натяжение, называются поверхностно-активными.
Вещества, повышающие поверхностное натяжении жидкости, называются поверхностно-неактивными.
Метод сталагмометрии (греч.''stalagma''- капля) (метод счета капель) основан на зависимости между числом капель, получаемых из данного объёма жидкости и поверхностным натяжением. Жидкость вытекает из сталагмометра по каплям. Каждая капля отрывается от нижнего конца трубки только тогда, когда масса ее преодолеет силу поверхностного натяжения, удерживающую каплю на конце трубки. Чем больше поверхностное натяжение, тем больше капля, следовательно, тем меньше капель получится из этого объема жидкости.
Ход работы.
-
Бюретку заполнить водой и выпустить 10 мл. воды, считая капли. Определение повторить 3 раза. Данные записать в таблицу, найти средний результат.
-
2) Бюретку заполнить 1H раствором NaОH и выпустить 10 мл. раствора, считая капли. Определение повторить 3 раза. Данные записать в таблицу, найти средний результат.
3) Обработку результатов провести по формуле.
δNaOH = δH2О . pNaOH . nср (H2О) / pH2О . nср( NaOH)
где p - плотность
δH2О = 72,75 эрг/см² p NaОH = 0,87 г/см³ p H2О = 1 г/см3
4) Сделать вывод о влиянии щелочи на величину поверхностного натяжения воды.
Контрольные вопросы.
1. Что называют поверхностным натяжением?
2. Объяснить механизм возникновения поверхностного натяжения.
3. В чем суть сталагмометрического метода определения поверхностного натяжения?
4. От чего зависит поверхностное натяжение чистых жидкостей, растворов?
5. Какие вещества по отношению к воде являются поверхностно-активными, поверхностно-неактивными?
Лабораторная работа № 3
Тема: Определение зависимости скорости химической реакции от концентрации и величины поверхности соприкосновения реагирующих веществ.
Цель: установить зависимость скорости реакции
-
от концентрации реагирующих веществ
-
от величины поверхности соприкосновения реагирующих веществ.
Должны знать: основные законы кинетики химических реакций, факторы, влияющие на скорость химической реакции.
Должны уметь: экспериментально определять зависимость скорости химических реакций от различных факторов.
Реактивы и оборудование: растворы тиосульфата натрия, серной кислоты, соляной кислоты, карбонат кальция, технохимические весы, секундомер.
Теоретическое пояснение
Скорость химической реакции определяется изменением концентраций реагирующих веществ в единицу времени.
Зависимость между скоростью и концентрацией реагирующих веществ определяется законом действующих масс: скорость реакции прямо пропорциональна произведению молярных концентраций реагирующих веществ в степенях их стехеометрических коэффициентов. Математически эта зависимость выражается кинетическим уравнением.
Для реакции nА+ mВ=dС+ fД , оно имеет вид U = k [А]n·[В]m
Скорость гетерогенных реакций зависит от величины поверхности соприкосновения реагирующих веществ.
ХОД РАБОТЫ
Опыт №1. Зависимость скорости реакции от концентрации реагирующих веществ.
-
В пять пробирок наливают равное количество раствора тиосульфата натрия Na2S2O3
(по 2мл.) разных концентраций, поочерёдно добавляют в каждую пробирку такое же количество серной кислоты.
2. Отсчитывают время от момента сливания веществ до выделения серы в каждой пробирке. Тиосульфат натрия разлагается в растворе серной кислоты по уравнению
Na2S2O3 + H2SО4 = S + Nа2 SО4 + SО2 + H2О
-
Результат опытов записывать в таблицу.
-
Концентрация
Na2S2O3 в моль/л.
Время (Т) до начала выпадения S
Скорость реакции в условных единицах
Uусл = 1/Т
1.
0,01
2.
0,02
3.
0,03
4.
0,04
5.
0,05
-
4.Изобразить в виде графика (по оси ординат -условную скорость реакции Uусл по оси абцисс-концентрацию Na2S2O3) зависимость скорости реакции разложения тиосульфата от его концентрации в растворе.
5.На основании проведённых опытов сделать вывод о влиянии концентрации реагирующих веществ на скорость химических реакций.
Опыт №2. Влияние поверхности соприкосновения реагирующих веществ на скорость гетерогенной реакции.
1. На технохимических весах взвешивают две навески по 0,5 г карбоната кальция
( можно взять кусочки мела ).
-
Одну навеску тщательно измельчают в ступке и переносят в сухую пробирку; вторую опускают в другую пробирку.
-
В обе пробирки одновременно вливают по 10 мл 2М соляной кислоты и включают секундомер. Отмечают время растворения карбоната кальция в каждом случае. Из-за вспенивания смеси кислоту следует вливать порциями.
-
Сделать вывод о влиянии величины поверхности соприкосновения реагирующих веществ на скорость реакции.
Контрольные вопросы
1. Как называется раздел химии, изучающий скорость и механизм химических реакций?
-
Что такое скорость химической реакции и в каких единицах она измеряется?
-
От каких факторов зависит скорость химической реакции?
-
Как зависит скорость химической реакции от концентрации реагирующих веществ? Напишите математические выражения для скоростей реакций, протекающих по уравнениям:
-
4 NH3 + 5 O2 = 4 NO + 6 H2O
-
2 H2S + SO2 = 3 S + 2 H2O
Лабораторная работа № 4
Тема: Тепловые явления при растворении.
Цель: Определить энтальпию растворения /знак теплового эффекта/ выданных веществ.
Знать: механизм растворения, гидратную теорию растворов Д.И. Менделеева.
Уметь: определять энтальпию растворения опытным путем и объяснять ее результаты.
Реактивы и оборудование: химические стаканы (или колбы) на 50-100 мл, термометр, мерные цилиндры, весы, стеклянные трубочки, Na CL, NaNO3, C12H22O11, CuSO4 (безводный), H2SO4 (раствор).
Теоретическое пояснение
Растворение различных веществ всегда сопровождается тепловыми эффектами. Под теплотой (энтальпией) растворения понимают количество тепла, которое выделяется или поглощается при растворении 1 моля вещества в таком объеме растворителя, дальнейшее прибавление которого не вызывает изменения теплового эффекта.
Тепловой эффект растворения твердых веществ состоит в основном из двух слагаемых:
∆ H раств.= ∆H1 + (-∆H2)
где ∆H1 - теплота, затрачиваемая на разрушение кристаллической решётки; ∆H2 - теплота гидратации, т. е. теплота, которая выделяется при химическом взаимодействии растворяемого вещества с растворителем. Следовательно, в зависимости от величины этих слагаемых тепловой эффект растворения может быть положительным и отрицательным.
∆ H раств. < 0 - растворение сопровождается повышением температуры раствора.
∆ H раств. > 0 - растворение сопровождается охлаждением системы.
Ход работы.
-
Налейте в 5 колб по 25 мл. воды. Измерьте температуру воды.
-
В первую колбу добавьте 5 г хлорида натрия, во вторую - 5 г нитрата натрия (или нитрата аммония), в третью - 5 г сульфата меди, в четвертую - 5 г сахарозы, в пятую - 5 мл серной кислоты.
3. Навески веществ энергично размешайте в воде и отметьте температуру полученных растворов.
4. Результаты измерений запишите в таблицу. Температура растворов будет изменяться по- разному. Объясните наблюдаемые явления.
5. Уберите рабочее место, растворы слейте в специальные емкости
- приемники.
Контрольные вопросы.
-
Что называют энтальпией растворения?
-
От чего зависит теплота (энтальпия) растворения?
-
В каком случае тепловой эффект растворения положительный, а в каком отрицательный?
-
Что такое криогидратная смесь и где она используется?
5. Гидратная теория растворов Д.И. Менделеева.
Лабораторная работа № 5.
Тема: Определение pH среды.
Цель: Ознакомление с колориметрическим методом определения pH среды.
Должны знать: диссоциация воды; нейтральная, кислая, щелочная среда; водородный показатель; способы определения pH среды.
Должны уметь: определять кислотно-щелочные свойства растворов опытным путем.
Реактивы и оборудование: набор индикаторов: метиловый фиолетовый, метиловый оранжевый, метиловый красный, бромкрезоловый пурпуровый, феноловый красный, фенолфталеин, тимолфталеин, трепеолин 0, универсальная индикаторная бумага, исследуемые растворы, пробирки.
Теоретическое пояснение
Водородные ионы занимают особое положение среди других ионов вследствие их влияния на ход многих реакций, протекающих в растворе. Для характеристики среды пользуются водородным показателем (pH), который вычисляют по формуле
pH = - lg (H+)
Для нейтральной среды (Н+) = (ОН-) = 10-7 моль/л, pH = 7
В кислых средах (Н+) (ОН-) pH 7
В щелочных средах (Н+) (ОН-) pH 7
Один из способов определения pH основан на использовании веществ-индикаторов, изменяющих свою окраску в зависимости от степени активной кислотности или щелочности. Метод определения концентрации ионов водорода, основанный на изменении цвета индикаторов, называется колориметрическим.
Ход работы
Опыт № 1. Определение pH прозрачных бесцветных жидкостей.
Получите у преподавателя 30 мл исследуемого раствора и определите его pH.
Пользуясь набором индикаторов, приведенным в табл. 1, можно определить pH раствора с точностью до 1.
Изменение цвета индикатора при различных значениях pH (табл. 1)
Для работы используйте тщательно вымытые пробирки. Налейте в пробирку 1 мл исследуемого раствора и добавьте 1-2 капли фенолового красного. Если раствор окрасился в желтый цвет, то pH 6,8. Если же раствор красный, то pH 8. Появление красной окраски раствора свидетельствует о том, что среда щелочная. Для более точного определения возьмите новую порцию раствора добавьте фенолфталеина. Если раствор слабо-розовый, то pH = 9, при красном цвете pH 10. Чтобы определить его точное значение в последнем случае, налейте опять 1 мл раствора и добавьте тимолфталеина. При синей окраске раствора pH больше 10,5. Для уточнения величины pH к новой порции исследуемого раствора добавьте ализарин. При желтом цвете раствора pH = 10, при оранжевом 11, при лиловом pH 12. Если pH раствора больше 12, то новую порцию исследуемого раствора проверьте индикатором тропеолином 0.
Аналогично проводят определение pH раствора, если после добавления фенолового красного раствор окрасился в желтый цвет. При этом индикаторы берут в иной последовательности. После фенолового красного к новой порции исследуемого раствора добавьте бромкрезоловый пурпуровый. Если раствор окрасился в желтый цвет, то pH 5.2. Затем испытайте раствор метиловым красным, который при pH 4,4 меняет свой цвет на красный. Новое определение pH можно провести метиловым оранжевым, который при pH = 5 окрашивает раствор в желтый цвет, при pH = 4 - в оранжевый, а при pH 3 - в красный. В последнем случае к исследуемому раствору добавьте метиловый фиолетовый; фиолетовый цвет соответствует pH = 3, голубой - pH = 2, зеленый - pH = 1 и желтый pH = 0,5.
Опыт № 2. Определение pH раствора с помощью универсального индикатора.
На универсальную индикаторную бумажку наносят 2 -3 капли исследуемого раствора. Сравнивают окраску индикатора с цветной шкалой на бумаге универсального индикатора.
Этот метод грубый (точность 0,5 pH), но довольно быстрый.
Контрольные вопросы
1. Что характеризует водородный показатель?
2. Для чего нужны индикаторы?
3. Какой метод определения pH называют колометрическим?
4. Какие растворы называются буферными?
5. Почему необходимо учитывать значение pH в кулинарных процессах
Лабораторная работа №6
Тема: Получение коллоидных растворов различными методами.
Цель: Ознакомление с методами конденсации и пептизации.
Знать: методы получения коллоидных растворов: диспергирование, конденсация, пептизация.
Уметь: получать коллоидные растворы различными методами; составлять схемы строения и формулы мицелл.
Реактивы и оборудование: 0,1 н р-р HCI, 2% р-р FeCL3, 0,1 % р-р K4 (Fe(CN)6 ), 1% р-р CuSO4, 1 % р-р KMnO4 , 1 % р-р Na2S2O3, р-р NН4ОН, 0,002 и 0,01 н р-ры AgNO3 0,01 и 0,002 н р-ры KI, 5% cnupm. р-р канифоли или парафина, спиртовка, мерный цилиндр, фильтры бум., колбы на 50мл, пробирки, держатель.
Теоретическое пояснение.
Коллоидные растворы (золи) можно получить как из неорганических веществ, так и органических веществ, если эти вещества практически нерастворимы в жидкости, служащей дисперсионной средой. Все методы получения коллоидных растворов делят на две основные группы:
1) диспергирование - дробление крупных частиц до коллоидной дисперсности;
2) конденсация - соединение атомов, ионов или молекул в более крупные частицы коллоидных размеров.
В коллоидном растворе частицы имеют размеры от 107 до 105 см.
Условно к методам диспергирования относят метод пептизации.
Он заключается в том, что к рыхлому свежеприготовленному осадку прибавляют раствор электролита (стабилизатора), под действием которого частицы осадка отделяются друг от друга и переходят во взвешенное состояние, образуя золь.
Пептизировать можно далеко не все осадки; плотные, тяжелые осадки не поддаются пентизации, наоборот, рыхлые, студенистые осадки, особенно свежеприготовленные, легко пептизируются.
К группе методов конденсации относят получения золей:
а) конденсацией паров,
б) заменой растворителя,
в) с помощью различных химических реакций.
Метод замены растворителя состоит в том, что к истинному раствору какого-либо вещества добавляют в большом объеме другую жидкость, которая является для этого вещества плохим растворителем, но хорошо смешивается с исходным растворителем.
Золи можно получить в результате химических реакций почти всех типов: обмена, окислительно-восстановительных, гидролиза и других. Например, золь хлорида серебра можно получить в ходе реакции обмена, смешивая очень разбавленные растворы хлорида натрия и нитрата серебра: NaCl + AgNO3 = AgCL + NaNO3
При этом одно из исходных веществ должно быть взято в избытке, чтобы служить стабилизатором получаемого гидрозоля. Если вещества будут взяты в эквивалентных количествах, то золь не получится и хлорид серебра выпадет в виде осадка.
Ход работы.
Опыт №1. Получение золя гидроксида железа (III) методом пептизации.
Возьмите 25мл 2%-него раствора хлорида железа (III) и прибавьте раствор аммиака по каплям до полного выпадения осадка гидроксида железа. Полученный осадок промойте декантацией дистиллированной водой, для чего осадок взболтайте с большим количеством воды, а после отстаивания прозрачную жидкость над осадком осторожно слейте. О конце отмывания судят по отсутствию запаха аммиака.
Промытый осадок разделите поровну в три колбы. В первую прибавьте в качестве пептизатора 1-2 мл 0,1 н. раствора соляной кислоты, во вторую 2 мл 2% раствора FeCL3, третью оставьте для сравнения. Содержимое первой и второй колб нагревают на водяной бане при 40-50 0 С 15-20 мин, периодически взбалтывая. При наступлении пептизации получается красно-коричневый золь гидроксида железа (III) .
Напишите уравнение происходящей реакции и формулу мицеллы (стабилизатор FeCL3)
Опыт №2. Получение золя канифоли или парафина.
Налейте в пробирку 10мл дистиллированной воды и добавьте в нее несколько капель (не более 0,5 мл) 5% спиртового раствора канифоли или парафина. Полученный раствор энергично перемешивают. Образуется белый опалесцирующий золь канифоли.
Укажите, каким способом получен золь канифоли. Почему в спирте канифоль образует истинный раствор, а в воде - коллоидный?
Опыт №3. Получение золя гидроксида железа (III) реакцией гидролиза.
Приготовьте 50мл кипящей дистиллированной воды и влейте в неё 3-5мл 2% раствора хлорида железа(III). Получается коллоидный раствор красно-коричневого цвета, стабилизированный хлоридом железа. Сравните цвет золя с цветом исходного раствора хлорида железа.
Напишите уравнение реакции гидролиза хлорида железа и формулу мицеллы.
Опыт №4. Получение золя железисто-синеродной меди - гексацианоферрат (II) меди (реакция обмена).
К 20 мл 0,1 % раствора K4 (Fe(CN)6 ) приливают 1 мл 1% раствора CuSO4. Полученный золь имеет коричнево-красный цвет.
Напишите формулы мицелл, если в избытке CuSO4 и K4 (Fe(CN)6 )
Опыт №5. Получение золя диоксида марганца (реакция восстановления)
Перманганат калия восстанавливается тиосульфатом натрия до диоксида марганца:
8 KMnO4 + 3 Na2S2O3 + H2O = 8 MnO2 + 3 K2SO4 + 2 KOH + 3 Na2SO4
В коническую колбу вносят 5 мл 1 % раствора перманганата калия и разбавляют дистиллированной водой до 50 мл. Затем в колбу добавляют по каплям 2 мл 1 % раствора тиосульфата натрия. Получается вишнево-красный золь диоксида марганца.
Напишите формулу мицеллы (стабилизатор KMnO4)
Опыт №6. Изменение знака заряда коллоида в зависимости от способа получении. Возьмите 10 мл 0,002 н. раствора нитрата серебра и добавьте из бюретки по каплям 1мл 0,01н. раствора иодида калия. Образуется золь иодида серебра с положительно заряженными частицами. В другую пробирку возьмите 10 мл 0,002 н. раствора иодида калия и добавьте по каплям из бюретки 1мл 0,01н. раствора нитрата серебра. Образуется золь с отрицательно заряженными частицами.
Напишите уравнение реакции получения иодида серебра и строение мицелл в обоих случаях.
Вопросы для контроля.
1. Какими методами можно получить золи?
2. Что такое пептизация?
3. Строение мицеллы гидрозоля.
4. Общие условия получения коллоидных растворов.
5. В ходе каких (типы) химических реакций можно получить коллоидные растворы?
6. Какие пищевые продукты получают методом механического диспергирования?
7. Чем объясняется помутнение одеколона /духов/ при введении в них воды?
Лабораторная работа № 7
Тема: Свойства коллоидных растворов.
Задачи работы: провести опыт по коагуляции золя под действием электролита; определить порог коагуляции для золя Fe(OH)3; получить положительно и отрицательно заряженные золи йодида серебра и наблюдать их взаимную коагуляцию; очистить воду коагуляцией.
Знать: устойчивость и коагуляция золей. Факторы, вызывающие коагуляцию.
Уметь: получать и исследовать свойства коллоидных растворов.
Реактивы и оборудование: Fe(ОН)3 - золь, Na2SO4 - 0,002 М р-р, Na3PO4 - 0,002 М р-р, золи AgJ, взвесь глины, пробирки, бюретка, мерный цилиндр.
Теоретическое пояснение
По самой своей природе коллоидные системы агрегативно неустойчивы. Потеря агрегативой устойчивости выражается в укрупнении частиц путем коагуляции, т. е. слипания их между собой с образованием крупных агрегатов. Далеко зашедшая коагуляция приводит к потери кинетической устойчивости, т. е. неспособности укрупнившихся коллоидных частиц равномерно распределяться по всему объему; эти частицы либо будут всплывать, либо оседать (седиментация).
Факторы, вызывающие коагуляцию, могут быть самыми разнообразными: изменение температуры, механическое воздействие, облучение, добавление различных электролитов. При коагуляции электролитов существует ряд общих правил.
-
Коагулирующим действием обладает не весь электролит, а только тот ион, который имеет заряд, противоположный заряду коллоидной частицы. Например, на положительно заряженные частицы золя гидроксида железа коагулирующее действие оказывают анионы.
-
Коагулирующая способность иона тем больше, чем выше его валентность.
-
Для ионов одинаковой валентности коагулирующая способность возрастает с увеличением радиуса иона.
Cs+ > Rb+ > K+ > Na+ > Li+
Различие в действии этих ионов объясняется их гидратационной
способностью.
-
Наименьшая концентрация электролита, вызывающая коагуляцию за определенный промежуток времени, называется порогом коагуляции (моль/л).
Внешне явление коагуляции выражается в том, что гидрозоль мутнеет, появляются видимые невооруженным глазом хлопья, постепенно система начинает расслаиваться на два слоя: жидкость и рыхлый осадок.
Коагуляцию можно наблюдать и в том случае, если к одному золю добавить другой золь с противоположным зарядом (взаимная коагуляция). В этом случае каждый золь по отношению к другому выполняет роль электролита-коагулятора. При взаимной коагуляции в осадок выпадают частицы обоих золей.
Ход работы.
Опыт №1. Очистка воды коагуляцией.
Возьмите шесть пробирок. В пять пробирок налейте по 10 мл мутной воды, содержащей взвешенные частицы глины, а в шестую - 5 мл, затем прибавьте различные количества золя гидроксида железа; в первую - 1 мл, во вторую - 2 мл, в третью - 4 мл, в четвертую - 6 мл и в шестую - 8 мл.
Мутная вода без золя гидроксида железа в пятой пробирке служит контрольным образцом. Содержимое пробирок перемешайте и оставьте стоять некоторое время. Наблюдайте, в какой пробирке быстрее происходит очистка воды.
Результаты опыта запишите в таблицу через 20; 40; 60; и 80 минут.
Объясните, почему происходит очистка воды?
Опыт №2. Коагуляция золей электролитами и определение порога коагуляции.
Налейте в пробирку 5 мл и золя гидроксида железа, а в бюретку - 0,002 М раствор сульфата натрия. Из бюретки следует медленно приливать раствор сульфата натрия в пробирку с золем гидроксида железа при тщательном перемешивании. Признаком начала коагуляции считается помутнение золя по всему объему раствора. Запишите объем израсходованного раствора сульфата натрия и вычислите порог коагуляции (ПК) по формуле: ПК = cv/5*1000, где с - концентрация электролита, моль/л; v - объем израсходованного электролита, мл; ПК - порог коагуляции, ммоль/л.
Налейте в пробирку 5 мл золя гидроксида железа и повторите опыт, взяв в качестве коагулирующего электролита 0,002 М раствора Na3PO4.
Определив порог коагуляции, данные обоих опытов запишите в таблицу.
Относительная коагулирующая способность вычисляется делением более высокого порога коагуляции на более низкий.
При обсуждении результатов опыта отметьте, почему коагулирующая способность одного иона выше, чем другого.
Опыт №3. Взаимная коагуляция золей иодида серебра.
Получите положительно и отрицательно заряженные золи йодистого серебра (можно использовать золи, полученные на предыдущей лаб. работе) Налейте в пробирку 5 мл отрицательно заряженного золя иодида серебра. Добавьте к нему 5 мл положительно заряженного золя иодида серебра.
Что при этом наблюдается? Объясните происходящее явление.
Контрольные вопросы.
1. Что такое коагуляция и какие факторы её вызывают?
2. Какой ион электролита обладает коагулирующим действием и как коагулирующая способность связана с зарядом ионов?
3. Что понимают под порогом коагуляции?
4. Каково практическое значение коагуляционных процессов в пищевой промышленности?
Лабораторная работа № 8.
Тема: Получение устойчивых эмульсий и пен, выявление роли стабилизатора.
Цель: Получить эмульсии, пены и выявить роль стабилизатора в получении устойчивых эмульсий и пен.
Должны знать: строение, свойства грубодисперсных систем, методы получения и стабилизации.
Должны уметь: получать устойчивые эмульсии и пены.
Реактивы и оборудование: раствор мыла, раствор белка, растительное масло, изоамиловый спирт, штатив с пробирками, мерный цилиндр, капиллярная трубка.
Литература: Лукьянов А.Б. Физическая и коллоидная химия, М., 1988 г, глава 12,
стр. 224 - 230.
Теоретическое пояснение.
Эмульсии представляют собой системы из двух взаимно нерастворимых жидкостей. Обычно одной из жидкостей является вода, а другой - масло, бензин, керосин, бензол и т.п.
Эмульсии - неустойчивые системы. В отсутствии стабилизатора капельки эмульгированного вещества сливаются в сплошной слой жидкости, и система полностью распадается на две жидкие фазы. Вещества, стабилизирующие эмульсию, называют стабилизаторами или эмульгаторами. Они обладают способностью адсорбироваться на поверхности капель эмульсии и препятствовать их смешиванию. Эмульгатор должен быть подобен той жидкости, которая образует дисперсионную среду. Пример, эмульсии м/в - стабилизируются растворимыми в воде в м.с. - белками, мылами щелочных металлов.
Пены - грубодисперсные системы, в которых дисперсная фаза - газ, а дисперсионная среда - жидкость в виде тонких пленок. Чистые жидкости не дают пен. Чтобы получить устойчивые пены, необходимы эффективные стабилизаторы-пенообразователи. К типичным пенообразователям водных пен относятся спирты, мыла, белки.
Ход работы.
Опыт №1 Получение эмульсий.
Приготовьте 3 пробирки и налейте
в 1-ю 5 мл воды,
во 2-ю 5 мл раствора мыла,
в 3-ю 5 мл раствора белка.
Добавьте в каждую пробирку по 5 капель растительного масла и взболтайте содержимое. Наблюдайте образование и относительную скорость разрушения эмульсий.
Задание. Дайте объяснение различной устойчивости полученных эмульсий.
Опыт №2 Получение пен.
Налейте в колбу 15 мл воды и через капиллярную трубку продувайте воздух. Повторите опыт, заменив воду раствором мыла.
-
В каком случае образуется пена?
K полученной пене добавте 1-2 капли изоамилового спирта.
-
Как это повлияла на устойчивость пены?
Задание. Объясните, почему в чистой воде пена не образуется, а образуется в растворе мыла? Какова роль изоамилового спирта?
Контрольные вопросы.
1. Какие системы называют эмульсиями, пенами?
2. Как классифицируют эмульсии?
3. Объясните причину неустойчивости эмульсий.
4. Какие требования предъявляют к эмульгатору?
5. К какому виду эмульсий (м/в, в/м) относится молоко, сливочное масло, маргарин медицинские мази, нефть?
6. Назовите методы определения типа эмульсий.
7. Что называют коалесценцией?
8. Какие эмульсии называют желатинированными? Приведите примеры таких эмульсий.
9. Какими способами может быть достигнуто деэмульгирование?
10. Чем представлена дисперсионная среда и фаза в эмульсии майонеза, и почему майонез необходимо хранить в тёмном мести и в герметичной таре?
11. Какие системы относят к собственно пенам?
12. Как получают твердые пены?
13. Приведите примеры пеногасителей и объясните, когда их применяют.
14. Какие пищевые продукты относят к пенам?
Лабораторная работа № 9
Тема: Изучение явлений набухания и студнеобразования крахмала, желатина и различных видов зерен.
Цель работы: Исследование кинетики ограниченного набухания веществ; факторов,
влияющих на процессы набухания и студнеобразования.
Должны знать: методы получения и свойства студней, характеристику процессов набухания и растворения полимеров.
Должны уметь: исследовать процессы набухания и студнеобразования, выявлять связь между строением и свойствами органических веществ.
Реактивы и оборудование: штатив с пробирками, колбы, мерные цилиндры, термометр, линейка, водяная баня, химические весы, желатин, крахмал, зерно, печенье, 0,025 % растворы HCL и NaOH, 0,1 % растворы NaCL, KCL, K2SO4, KCNS.
Литература: А.Б. Лукьянов. Физическая и коллоидная химия. М., 1988
В.Е. Липатников. Физическая и коллоидная химия. М., 1981
Ю.С. Рыбакова. Лабораторные работы по физической и коллоидной и.
коллоидной химии. М., 1988.
Теоретическое пояснение
Полимеры подобно низкомолекулярным веществам обладают избирательной растворимостью. Растворению полимера предшествует набухание. Набухание зависит, как от природы полимера, так и от природы жидкости. Полярные полимеры набухают в полярных жидкостях, а неполярные - в неполярных.
С повышением температуры скорость набухания увеличивается. Тепловой эффект, сопровождающий набухание полимера в жидкости, называется теплотой набухания.
Растворы высокомолекулярных веществ способны терять текучесть и застудневать, образуя при этом студни. Студнеобразное состояние вещества можно рассматривать как промежуточное между жидким и твердым состоянием. Застудневание связано с увеличением вязкости и замедлением броуновского движения и заключается в объединении частиц дисперсной фазы в форме сетки или ячеек и связывании при этом всего растворителя.
С повышением концентрации способность к застудневанию увеличивается, т.к. при этом уменьшается расстояние между частицами. Процесс застудневания даже при низкой температуре не происходит мгновенно и нередко требует продолжительного времени для формирования ячеистой объемной сетки.
Время, необходимое для застудневания, называется периодом созревания.
Продолжительность созревания зависит от природы веществ, концентрации, температуры.
Ход работы
Опыт №1. Кинетика набухания зерна.
Зерновые культуры (пшено, рис, лучше дробленый) ограниченно набухают в воде. Зерно насыпают в пробирки (1/3) так, чтобы во всех пробирках было одинаковое количество зерна по высоте. Наливают дистиллированную воду, чтобы вместе с зерном пробирки были заполнены на ¾ объема. Наблюдения за процессом набухания проводят в течение 40-50 минут. Полученные данные заносят в таблицу по образцу:
Таблица № 10
10
20
30
40
50
Пшено
Рис
Рис дробленый
Зерно
Опыт №2. Влияние кислоты, щелочи и солей на набухание желатины.
В семь пробирок одинакового диаметра вносят по 0,3 г. порошка желатины. В каждую пробирку наливают по 5 мл различных растворов (см. табл. № 2). Пробирки осторожно встряхивают, чтобы частицы желатины опустились на дно, определяют высоту осадка желатины до набухания. После этого, встряхнув пробирки несколько раз, оставляют их в покое на 40-50 мин. По истечении этого времени каждую пробирку еще раз встряхивают, дают осадку осесть, измеряют высоту набухшего осадка желатины(с каждой пробиркой измерения повторяют 2 раза). Данные заносят в таблицу.
Таблица № 2
На основании полученных данных делают вывод о влиянии кислоты, щелочи и солей на процесс набухания, а также о влиянии природы анионов.
Опыт № 3. Определение степени набухания печенья
Степень набухания печенья определяют в специальной рамке с большим числом отверстий на дне и стенке. Рамку опускают в воду, вынимают, вытирают фильтровальной бумагой с внешней стороны, взвешивают на технохимических весах. Закладывают в рамку одно печенье и опускают ее в сосуд с водой при t = 200 С на 2 мин. Затем вынимают рамку из воды, держат 30 с в наклонном положении для стекания избытка воды, вытирают фильтровальной бумагой с внешней стороны и взвешивают. Степень набухания печенья определяют по формуле
А = m - m1 / m2 * 100%
Где m - масса рамки с набухшим печеньем, г;
m1 - масса пустой рамки, г;
m2 - масса сухого печенья, г.
Опыт № 4 Выделение тепла при набухании.
В стакане размешайте 5 мл. воды и 5г. сухого крахмала (температуру воды предварительно измерьте). Затем в смесь погрузите термометр и измерьте температуру.
Объясните причину изменения температуры.
Опыт № 5. Влияние кислот и щелочей на студнеобразование.
В три пронумерованные пробирки вносят по 5 мл теплого 3 % раствора желатины. Затем приливают по 1 мл - в первую пробирку дистиллированную воду, во
вторую - 0,1 М раствора HCL, в третью - 0,1 М раствора NaOH.
Содержимое пробирок тщательно перемешивают и ставят на 10 мин в водяную баню с температурой 40 - 50 0 С. После этого пробирки помещают в термостат с температурой 10 -15 С 0; замечают время начала отсчета.
Периодически вынимая пробирки из термостата, наблюдают за образованием студня.
Моментом образования студня считают время, начиная с которого раствор желатины не выливается при переворачивании пробирки.
Данные опыта записывают в таблицу и, вычисляют время застудневания каждого раствора.
Время начала отсчета (астрономическое)…………………………………………………………
Таблица № 3
Делают вывод о влиянии кислот и щелочей на студнеобразование
Контрольные вопросы
-
Какие вещества относятся к высокомолекулярным соединениям?
-
Что называется набуханием?
-
По каким признакам различают ограниченное и неограниченное набухание?
-
Что понимают под степенью набухания?
-
Какие системы называют студнями?
-
Какие факторы влияют на скорость застудневания?
Лабораторная работа № 10.
Тема: Определение величины адсорбции на поверхности активированного угля.
Цель: Определить зависимость адсорбции от различных факторов.
Знать: определение и виды сорбции; зависимость адсорбции от величины площади поверхности адсорбента, от температуры, его природы и природы растворителя; гидрофильные и гидрофобные поверхности.
Уметь: проводить эксперименты по исследованию зависимости адсорбции от различных факторов.
Реактивы и оборудование: растворы CH3COOH, NaOH, активированный уголь, фенолфталеин, бюретка, пипетка, колбы, воронка, фильтры, мерный цилиндр, водяная баня.
Теоретическое пояснение.
Явление самопроизвольного поглощения вещества на поверхности раздела называется адсорбцией. Вещество, на поверхности которого происходит адсорбция, называется адсорбентом, а вещество, которое поглощается, адсорбируется - адсорбтивом. В процессе адсорбции на границе твердое тело - раствор участвуют не только внешняя, но и внутренняя поверхность адсорбентов.
Адсорбцию обозначают буквой Г, а ее величину принято выражать количеством вещества (x) на единицу массы (m) адсорбента.
Г = х/m (моль/кг)
Ход работы
Опыт №1.
Определение концентрации уксусной кислоты до начала опыта.
Для этого в колбу отбирают 10 мл. раствора уксусной кислоты, прибавляют 2 капли фенолфталеина и титруют 0,1 н раствором NaOH до изменения окраски.
Вычисляют концентрацию уксусной кислоты по формуле:
СCH3 COOH = C NaOH · V NaOH /VCH3СООH
Опыт №2.
Затем в колбу помещают 30 мл. раствора уксусной кислоты, одну таблетку активированного угля и нагревают при температуре не выше 50º 5 минут. После нагревания раствор отфильтровывают, отбирают 10 мл. раствора пипеткой ( или мерным цилиндром) и определяют его концентрацию как описано выше.
Количество адсорбированного вещества вычисляют по формуле:
Х = (Со-С) · V (моль / г)
m 1000
Со - концентрация уксусной кислоты до начала опыта
С - концентрация уксусной кислоты после опыта
V - объём уксусной кислоты, взятой для адсорбции
Х
m -количество адсорбированного вещества.
Опыт №3.
В колбу помещают 40 мл. уксусной кислоты, одну таблетку угля и кипятят содержимое колбы 10 мин. Затем отфильтровывают, определяют концентрацию раствора как описано выше. Вычисляют количество адсорбированного вещества.
Опыт №4.
В колбу отбирают 40 мл. уксусной кислоты, одну таблетку угля и кипятят содержимое колбы 20 мин. Затем отфильтровывают, отбирают 10 мл. раствора и определяют концентрацию раствора. Вычисляют количество адсорбированного вещества.
На основе данных составляют таблицу
-
мин.
tº
Х/m
Анализируя опытные данные, делают вывод о влиянии времени и температуры на количество адсорбированного вещества.
Контрольные вопросы
-
Что называется адсорбцией, десорбцией?
-
От каких факторов зависит количество адсорбированного вещества?
3. Какие вещества можно использовать в качестве адсорбентов?
4. Почему в ходе опыта изменяется концентрация уксусной кислоты?
5. Какими свойствами обладает актированный уголь?
6. Что изменится, если вместо угля взять каолин?
7. Как зависит количество адсорбированного вещества от температуры, времени?
8. Почему при тушении пожара нельзя пользоваться обычным противогазом
( с активированным углем)?
Лабораторная работа № 11
Тема: Анализ сухой соли
Цель: Отработать методику определения состава сухой смеси, установить состав выданного образца.
Должны знать: -ход анализа сухой смеси;
- частные реакции анионов.
Должны уметь: анализировать сухую соль.
Реактивы и оборудование: BaCl2, AgNO3, HCl, HNO3, Na2CO3, Н2S, (NH4)2S, (NH4)2СО3
раствор иода, известковая вода, Na2S, NH4OH, FeSO4
NaNO3, KМnO4 (р-р), H2SO4, Pb(NO3)2, КОН, Na2НРО4,
пробирки, газоотводная трубка, установка для нагревания,
образец сухой смеси.
Литература: Жванко Ю.М. Аналитическая химия и технохимический контроль в общественном питании, М., 1989г, глава YII, стр 62 - 71.
Порядок выполнения работы
Для анализа дают 0,5 г соли, содержащей один катион и один анион. Соль растворяют в 10 мл дистиллированной воды. Раствор следует разделить на две части для анализа и для контроля.
Предварительные испытания. Отметить в рабочей тетради цвет и запах полученного раствора. По цвету раствора можно ориентировочно определить присутствие катиона Cu2+ - раствор голубого цвета, Cr3+ - раствор зеленого цвета, Fe3+ раствор желтого цвета. По запаху можно определить летучие соединения: Н2S, NН3.
И с п ы т а н и е н а о к р а ш и в а н и е п л а м е н и.
Прокаленную нихромовую проволочку смочить анализируемым раствором и вновь прокалить в пламени спиртовки. Окраска пламени указывает на присутствие соответствующего катиона: зеленая Cu2+; желтовато - зеленая Ва2+; оранжево - красная Са2+; интенсивно - желтая Nа+; розово - фиолетовая (видимая через кобальтовое стекло) К+.
Д е й с т в и е г и д р о к с и д о в н а к а т и о н ы.
Действие щелочей позволяет открыть катион или по цвету выпавшего осадка, или по растворимости в избытке щелочи или в растворе NH4ОН (табл. 1)
Т а б л и ц а 1. Взаимодействие катионов с щелочами
Темно-синий
Р
Бесцвет-ный
Н
Н
Н
Н
Р
Н
Н
Примечание Н - нерастворим; Р - растворим.
Определение принадлежности катиона и аниона соответствующей группе
О т к р ы т и е к а т и о н а ч е т в е р т о й г ру п п ы.
К 1-2 каплям анализируемого раствора добавить 1-2 капли раствора группового реактива Н2S, подкисленного соляной кислотой. Выпадение осадка черного цвета указывает на присутствие катиона четвертой группы. Далее открыть катион данной группы наиболее характерной реакцией.
Если катионы четвертой группы отсутствуют, то устанавливают наличие катионов третьей группы.
О т к р ы т и е к а т и о н а т р е т ь е й г р у п п ы.
К 1-2 каплям анализируемого раствора добавить 1-2 капли раствора группового реактива (NH4)2S. Выпадение осадка гидроксида или сульфида указывает на присутствие катиона третьей группы. По цвету, осадка можно установить, какой катион третьей группы присутствует в растворе. Наиболее характерной реакцией подтвердить открываемый катион.
Если катионы третьей группы не были открыты, то анализируют катионы второй группы.
О т к р ы т и е к а т и о н а в т о р о й г р у п п ы.
К 2-3 каплям анализируемого раствора добавить 3-4 капли группового реактива (NH4)2СО3 и 1-2 капли гидроксида аммония NH4ОН. Смесь нагреть на водяной бане. Выпадение осадка белого цвета указывает на присутствие катиона второй группы. Наиболее характерной реакций определить, какой катион присутствует, соблюдая следующую последовательность открытия: Ва2+, Са2+, Мg2+. Открыть катион второй группы можно реактивом Na2НРО4.
Если катионы второй группы отсутствуют, приступают к определению катионов первой группы.
О т к р ы т и е к а т и о н а п е р в о й г р у п п ы.
Характерной реакцией открыть катион первой группы, соблюдая последовательность: NH4+, Na+, К+.
Если открыт катион первой или второй группы, то анализ проводится без предварительной обработки раствора.
О т к р ы т и е а н и о н а п е р в о й г р у п п ы.
К 1-2 каплям анализируемого раствора добавить 1-2 капли раствора ВаCl2; выпадение осадка белого цвета указывает на присутствие анионов первой группы. К полученному осадку добавить раствор азотной кислоты. Если осадок не растворяется, значит, присутствует сульфат - ион SO42-. Если осадок растворяется и при этом происходит как бы «вскипание раствора», присутствует карбонат - СО32-; выделение газа с резким специфическим запахом (SO2) - признак присутствия аниона SO32- . Для подтверждения открываемого аниона проделать наиболее характерную реакцию для него.
О т к р ы т и е а н и о н а в т о р о й г р у п п ы.
К 2-3 каплям раствора добавить 1-2 капли раствора Ag NO3, выпадение осадка указывает на присутствие анионов второй группы. Если осадок белый творожистый, то присутствуют ионы Cl-, если черного цвета - то ионы S2-.
О т к р ы т и е а н и о н а т р е т ь е й г р у п п ы.
Так как на анионы третьей группы нет группового реактива, то характерной реакцией установить, какой анион третьей группы присутствует в растворе.
Если катион анализируемой соли относится к тяжелым металлам, то необходимо удалить данный катион, поскольку он будет мешать открытию аниона. Присутствие аниона СО32- в контрольном растворе определяют действием азотной или соляной кислоты до осаждения катионов тяжелых металлов.
Катион тяжелого металла осаждают раствором карбоната натрия. К 2 мл анализируемого раствора добавляют по каплям раствор Na2СО3 до прекращения выпадения осадка. Смесь нагревают на водяной бане в течении 5 мин, проверяют полноту осаждения и центрифугируют. Отбирают раствор (содовая вытяжка), а осадок отбрасывают. Раствор используют для открытия анионов.
О т к р ы т и е а н и о н а п е р в о й г р у п п ы. К нескольким каплям содовой вытяжки добавить несколько капель воды и по каплям добавить 2 н. СН3СООН до кислой реакции (проба на лакмус). Раствор нагреть до полного удаления СО2. Открыть характерной реакцией анион данной группы.
О т к р ы т и е а н и о н а в т о р о й г р у п п ы. К нескольким каплям содовой вытяжки добавить несколько капель 6 н. HNО3 и несколько капель AgNO3. Выпадение осадка указывает на присутствие анионов второй группы.
О т к р ы т и е а н и о н а т р е т ь е й г р у п п ы. Присутствие аниона NО3- или NО2- определяют характерной реакций в растворе, подкисленном уксусной кислотой.
Если анализируемая соль растворима в воде, можно, пользуясь таблицей растворимости солей, предположить, какой анион входит в состав соли.
Контрольные вопросы
-
Присутствие каких катионов можно установить по окрашиванию пламени?
-
На присутствие каких катионов указывает выпадение осадка черного цвета после добавления Н2S, подкисленного соляной кислотой?
-
Какие реактивы необходимы для открытия анионов первой группы?
-
В каком порядке открывают катионы второй аналитической группы?
-
Выпишите формулы тех соединений, которые выпадают в осадок при кипячении с Na2СО3 раствора, содержащего следующие соли: KJ, MgCl2, Ca(NO3)2, Al(NO3)3, NaCl, Pb(NO3)2, NH4NO3. Составьте молекулярные и ионные уравнения происходящих реакций.
Лабораторная работа № 12
Тема: Определение кристаллизационной воды в BaCl2 2 H2O
Цель: Отработать методику определения кристаллизационной воды в кристаллогидратах.
Должны знать:
-
правила взвешивания на аналитических весах;
-
операции весового анализа.
Должны уметь: определять содержание кристаллизационной воды в кристаллогидратах.
Реактивы и оборудование: сушильный шкаф, аналитические весы, эксикатор,
бюкс, технохимические весы, навеска кристаллогидрата, тигельные щипцы.
Литература: Жванко Ю.М. Аналитическая химия и технохимический контроль в общественном питании, М., 1989 г, глава IX., стр. 71 -83.
Теоретическое пояснение
Вещества, которые кристаллизируются из растворов с определенным количеством молекул воды, называются кристаллогидратами, а вода, содержащаяся в них, - кристаллизационной. В формулах кристаллогидратов указывается число молекул воды, приходящихся на одну молекулу соли. Например: CuSO4 5 H2O, BaCl2 2 H2O,
Na2SO4 10 H2O. Кристаллизационная вода удаляется при нагревании соли в сушильном шкафу до 120-125оС, остаток взвешивают на аналитических весах и производят расчет.
Порядок выполнения работы
1. Тщательно вымытый бюкс сушат 30-40 минут в сушильном шкафу при 120-125оС, охлаждают в эксикаторе и взвешивают на аналитических весах. Результат взвешивания записывают в лабораторный журнал.
Для каждого гравиметрического определения выбирают оптимальную навеску исходного вещества, масса которой может колебаться от десятых долей грамма до нескольких граммов. От правильного выбора навески зависит точность определения. Если навеска большая, точность определения повышается, но на ее обработку (на высушивание) затрачивается много времени. Если навеска маленькая, ее легко обработать, но зато потери даже незначительного количества вещества сильно снизят точность определения.
2. Рассчитаем навеску BaCl22H2O, которую следует взять, чтобы в ней содержалось 0,1 г воды:
в 244,3 г BaCl2 2H2O содержится 36,00 г H2O
« х » BaCl2 H2O « 0,1 » H2O
x = 244,3 0,1 = 0,70 г.
36,000
Навеска не обязательно должна быть точно 0,70 г, она может быть и больше, и меньше, но в этих пределах.
3. Во взвешенный бюкс помещают примерную навеску соли, закрывают бюкс крышкой и взвешивают на технохимических весах с точностью до 0,1г, затем переносят бюкс на аналитические весы, где производится точное взвешивание. Результат взвешивания записывают в лабораторную тетрадь.
4. Бюкс с солью и поставленной на ребро крышкой помещают в сушильный шкаф, нагретый предварительно до 120-125оС.
5. Через час бюкс закрывают крышкой и переносят в эксикатор для охлаждения.
6. После охлаждения примерно через 15-20 минут бюкс взвешивают на аналитических весах, результат записывают в тетрадь.
7. После взвешивания опять открывают крышку бюкса, ставят ее на ребро и сушат образец еще 25-30 минут.
8. После сушки и охлаждения взвешивают на аналитических весах, и результат второго взвешивания записывают в тетрадь. Высушивание повторяют до тех пор, пока результаты двух взвешиваний не будут отличаться на 0,0002 г. Высушивание прекращают и считают, что вода удалена полностью, образец доведен до постоянной массы и можно приступать к вычислениям результата анализа.
Пример записи результатов в лабораторной тетради (примерный расчет):
-
Взятие навески хлорида бария BaCl22H2O
Масса бюкса с хлоридом бария, г. … 17,5831
Масса пустого бюкса с крышкой, г. … 16,8223
Масса навески BaCl22H2O, г. … …… 0,7608
-
Высушивание навески хлорида бария
Масса бюкса с хлоридом бария после высушивания г.
1-е взвешивание …….. 17,4896
2-е взвешивание …….. 17,4712
3-е взвешивание …….. 17,4712
-
Вычисление массы кристаллизационной воды:
17,5831 - 17,4712 = 0,1119 г.
-
Содержание (%) кристаллизационной воды вычисляют по формуле (х. 2).
Исходную навеску 0,7608 г принимаем за 100 %
« 0,1119 » х %
х = 0,1119 100 = 14,71 %
0,7608
5. Ошибка определения. Масса воды, входящая в формулу кристаллогидрата, является величиной теоретической и вычисляется из пропорции:
в 244,3 г BaCl2 2H2O содержится 36 г H2O
в 100 г BaCl2 2H2O х г H2O
х = 36,00 100 = 14,75 %
244,3
Разность между полученной и теоретической величинами является абсолютной ошибкой определения:
14,71 - 14,75 = 0,04 %
Таким образом, расхождение с теоретическим процентным содержанием воды составляет в нашем примере 0,04 %, что легко объясняется неизбежными погрешностями взвешивания.
При правильной работе это расхождение не должно превышать +/- 0,05 %.
Контрольные вопросы
-
В чем сущность гравиметрического метода анализа?
-
Как определяют кристаллизационную воду в содержащих ее веществах?
-
Какова точность взвешивания на аналитических весах?
-
Что такое абсолютная ошибка определения и как ее рассчитывают?
-
Что означает довести образец до постоянной массы?
Лабораторная работа № 13
Тема: Приготовление рабочего раствора щелочи и стандартного раствора щавелевой кислоты.
Цель: освоить расчет и методику приготовления растворов:
-
заданной концентрации путем разбавления более концентрированных растворов;
-
стандартных (исходных) растворов по точной навеске.
Должны знать:
-
сущность и методы объемного анализа;
-
способы выражения концентрации растворов.
Должны уметь: готовить растворы заданной концентрации.
Приборы, посуда и реактивы: ареометр с пределами измерения 1,00-1,20 г/см3,
мерный цилиндр или мерная пробирка вместимостью 10 см3,
мерный цилиндр вместимостью 500 см3,
склянка для хранения раствора вместимостью 500 см3,
концентрированный раствор гидроксида натрия,
аналитические весы, технические весы,
мерная колба вместимостью 250 см3,
воронка диаметром 3 см, бюкс вместимостью 50 см3,
промывалка с дистиллированной водой,
капельная пипетка,
склянка для хранения раствора вместимостью 500 см3,
препарат щавелевой кислоты.
Литература: Коренман Я.И. Практикум по аналитической химии. Воронеж, 2002, стр 32-35.
Жванко Ю.М. Аналитическая химия и технохимический контроль в общественном питании, М., глава XI., стр. 92 -104.
Порядок выполнения работы
1. Приготовление рабочего раствора гидроксида натрия
Необходимо приготовить 500 см3 раствора гидроксида натрия с приблизительной молярной концентрацией эквивалента с(1/1 NaOH)» 0,1 моль/дм3. Рабочий раствор готовят разбавлением концентрированного раствора NaOH.
Расчет. Предварительно измеряют плотность концентрированного раствора NaOH. Для этого раствор наливают в мерный цилиндр ( до края цилиндра не доливают 4-5 см), ареометром измеряют плотность ( например, р = 1,145 г/см3). По справочнику устанавливают массовую долю NaOH: w(NaOH) = 13,28 %.
Рассчитывают массу (г) NaOH в 500 см3 раствора при с(1/1 NaOH) = 0,1 моль/дм3:
V(NaOH) * c(1/1NaOH) * M(1/1NaOH) 500 * 0,1 * 40
m(NaOH)= ------------------------------------- = -------------- = 2,0 г.
1000 1000
Молярная масса эквивалента NaOH: M(1/1NaOH) = 40 г/моль.
Вычисляют массу раствора NaOH с массовой долей w(NaOH) = 13,28 %, в котором 2,0 г NaOH:
m (NaOH) * 100
w = ------------------ ,
m p
m(NaOH) * 100 2.0 * 100
отсюда m p = -------------------- = ---------- = 15,1 г.
w 13,28
С учетом плотности раствора рассчитывают его объем:
mp 15,5
V = ----- = -------- = 13,2 см3.
p 1,145
Для приготовления 500 см3 раствора NaOH с молярной концентрацией эквивалента с(1/1NaOH) = 0,1 моль/дм3 необходимо взять 13,2 см3 концентрированного раствора гидроксида натрия.
Приготовление раствора. Мерным цилиндром отбирают 13,2 см3 концентрированного раствора NaOH, переносят в мерный цилиндр вместимостью 500 см3, разбавляют дистиллированной водой до требуемого объема. Содержимое цилиндра переливают в склянку для хранения раствора, которую предварительно моют, ополаскивают дистиллированной водой, затем небольшим объемом приготовленного раствора. На склянку приклеивают этикетку с указанием концентрации раствора, фамилии студента, номера группы, даты приготовления.
2. Приготовление стандартного раствора щавелевой кислоты.
Стандартный раствор щавелевой кислоты необходим для установления концентрации рабочего раствора гидроксида натрия. Раствор готовят растворением точной навески кристаллогидрата щавелевой кислоты (Н2С2О4 * 2Н2О) в мерной колбе.
Готовят 250,0 см3 раствора щавелевой кислоты с молярной концентрацией эквивалента с(1/2Н2С2О2) = 0,1000 моль/дм3.
Расчет. Вычисляют массу навески щавелевой кислоты (г), необходимую для приготовления 250,0 см3 раствора с заданной концентрацией:
с(1/2Н2С2О4) * М(1/2Н2С2О4* 2Н2О) * V(Н2С2О4)
m (Н2С2О4 * 2 Н2О) = -------------------------------------------- =
1000
0,1000 * 63 * 250,0
= ---------------- = 1,5750 г.
1000
Молярная масса эквивалента щавелевой кислоты:
М(1/2Н2С2О4* 2Н2О) = 1/2 М(Н2С2О4 * 2 Н2О) = 1/2 * 126 = 63 г/моль.
Взвешивание навески. Взвешивать точно 1,5750 г щавелевой кислоты нет необходимости. Достаточно взять массу навески, близкую к рассчитанной (±0,010 г). После взвешивания точную концентрацию пересчитывают с учетом практически полученной массы навески щавелевой кислоты.
Бюкс предварительно взвешивают на технических весах, затем массу уточняют на аналитических весах. Массу пустого бюкса (mб) записывают в лабораторную тетрадь с точностью ±0,0002 г. К массе пустого бюкса прибавляют массу навески, полученную при расчете, и соответствующую навеску отбирают на технических весах, затем массу уточняют на аналитических весах. Массу бюкса с навеской записывают в лабораторную тетрадь (mб+н). По разности массы бюкса с навеской и массы пустого бюкса находят массу навески щавелевой кислоты (mн):
mн = mб+н - mб
Приготовление раствора. Массу навески щавелевой кислоты через сухую воронку количественно переносят в предварительно вымытую и ополоснутую дистиллированной водой мерную колбу. Дистиллированной водой из промывалки смывают оставшиеся кристаллы кислоты с внутренней поверхности бюкса и воронки в колбу ( ополаскивание повторяют 3-4 раза). Для растворения навески в колбу добавляют дистиллированную воду на 1/2 объема колбы. Круговыми движениями перемешивают раствор до полного растворения кристаллов кислоты. Капельной пипеткой доводят раствор до метки дистиллированной водой, колбу закрывают пробкой, раствор тщательно перемешивают. Содержимое колбы переносят в склянку для хранения раствора.
Рассчитывают титр (г/см3) и молярную концентрацию эквивалента (моль/дм3) раствора щавелевой кислоты:
mн Т * 1000
Т = ---- , c(1/2 Н2С2О4) = ------------------
V М (1/2Н2С2О4 * 2Н2О)
Контрольные вопросы
-
Какие существуют способы приготовления рабочих и стандартных растворов?
-
Какой раствор называется стандартным?
-
Закончите определение: молярная концентрация показывает, сколько…
А) …граммов вещества содержится в 100 г раствора
Б) … граммов вещества содержится в 1 дм3 раствора
В) …моль вещества содержится в 1 дм3 раствора
Г) … моль вещества содержится в 1 см3 раствора
4. Рассчитайте массу навески хлорида натрия (г), необходимую для приготовления
250 г раствора с массовой долей 8 %.
А) 8,00
Б) 16,00
В) 3,2
Г) 20,00
5. Раствор объемом 0,5 дм3 содержит NaOH массой 5 г. Определите молярную концентрацию этого раствора.
Лабораторная работа № 14
Тема: Установка титра рабочего раствора гидроксида натрия.
Цель: освоить правила и приемы работы с мерной посудой, технику титрования и установить титр рабочего раствора гидроксида натрия по стандартному раствору щавелевой кислоты.
Должны знать:
-
сущность и методы объемного анализа;
-
измерительную посуду объемного анализа и ее назначение.
Должны уметь:
-
осуществлять процесс титрования;
-
вычислять молярную концентрацию эквивалента (моль/дм3) и титр (г/см3) рабочего раствора.
Посуда и реактивы: бюретка вместимостью 25 или 50 см3,
коническая колба для титрования вместимостью 100 см3,
пипетка Мора вместимостью 10 см3,
химический стакан вместимостью 100 см3,
воронка диметром 3 см, экран для титрования,
рабочий раствор гидроксида натрия с приблизительной концентрацией 0,1 моль/дм3,
стандартный раствор щавелевой кислоты с молярной концентрацией эквивалента 0,1000 моль/дм3,
спиртовой раствор фенолфталеина с массовой долей 1,0%.
Литература: Коренман Я.И. Практикум по аналитической химии. Воронеж, 2002, стр 49-51.
Жванко Ю.М. Аналитическая химия и технохимический контроль в общественном питании, М., глава XI., стр. 92 -104.
Порядок выполнения работы
1. Подготовка мерной посуды к работе. Бюретку промывают водопроводной водой, дважды ополаскивают дистиллированной водой, затем титрантом. Через воронку заполняют бюретку раствором в соответствии с правилами:
-
раствор наливают выше уровня нулевой отметки;
-
заполняют раствором «носик» бюретки, изгибая соединительную трубку в виде сообщающихся сосудов и вытесняя из «носика» бюретки воздух.
-
устанавливают уровень раствора в бюретке на нулевое значение (нижний уровень мениска должен касаться нулевого деления).
Корректируют положение бюретки в штативе, закрепляя ее так, чтобы «носик» погружался в колбу для титрования на 2-3 см. На стол штатива, в котором закреплена бюретка, помещают белый экран для титрования.
Мерную пипетку промывают водопроводной водой, ополаскивают дистиллированной водой, затем небольшим объемом титруемого раствора.
-
Раствор в пипетку набирают резиновой грушей!
2. Титрование. Бюретку заполняют рабочим раствором NaОН. Мерной пипеткой отбирают стандартный раствор щавелевой кислоты из склянки и устанавливают уровень раствора на кольцевой отметке. Переносят раствор в колбу для титрования и дают раствору полностью вытечь из пипетки. Осторожно трижды прикасаются «носиком» пипетки к дну колбы, слегка наклоняя колбу.
-
Оставшийся в «носике» пипетки раствор выдувать запрещается, он не входит в объем, указанный на пипетке.
В колбу для титрования, содержащую раствор щавелевой кислоты, добавляют 2-3 капли индикатора (фенолфталеин).
Колбу со стандартным раствором помещают под «носик» бюретки и приливают раствор титранта небольшими порциями, постоянно перемешивая содержимое колбы круговыми движениями. Титрование прекращают, когда титруемый раствор окрасится в розовый цвет от одной капли раствора NаОН. Окраска раствора должна быть устойчивой в течении 30 с.
Первое титрование проводят ориентировочно, приливая титрант порциями по 1,0 см3. После перемешивания наблюдают окраску раствора в колбе. Измеряют, объем раствора щелочи с точностью до 1,0 см3.
Последующие три титрования проводят точно, вблизи точки эквивалентности рабочий раствор приливают по каплям, наблюдают окраску раствора после добавления каждой порции титранта. Расхождение между параллельными результатами титрования не должно превышать 0,1 см3. После каждого титрования уровень раствора в бюретке устанавливают на нулевое деление.
Результаты титрования помещают в таблицу.
3. Расчет. Находят средний объем титранта (см3). Зная точную концентрацию стандартного раствора, его объем титранта, измеренный по бюретке, по закону эквивалентов вычисляют молярную концентрацию эквивалента (моль/дм3) и титр (г/см3) рабочего раствора NаОН:
с (1/1 NаОН) = с (1/2 Н2С2О4) * V(Н2С2О4)
V (NаОН)
Т = с (1/1NаОН) * М(1/1NаОН)
1000
Контрольные вопросы
-
Что такое объемный метод анализа?
-
Какой из методов анализа - гравиметрический или объемный - обладают большей точностью и почему?
-
Что такое титр раствора, титрование, титрант, точка эквивалентности?
-
Какой раствор называется титрованным?
-
Как взаимосвязаны титр раствора и молярная концентрация эквивалента вещества?
-
Какая посуда называется мерной? Приведите примеры точной и неточной мерной посуды.
Лабораторная работа № 15.
Тема: Определение кислотности молока.
Цель: овладеть навыками определения кислотности молока методом алкалиметрии.
Должны знать:
-
сущность и методы объемного анализа;
-
измерительную посуду объемного анализа и ее назначение.
Должны уметь:
-
осуществлять процесс титрования;
-
определять кислотность молока методом алкалиметрии.
Посуда и реактивы: бюретка вместимостью 25 см3, воронка диаметром 3 см,
мерная пипетка вместимостью 10 см3,
мерный цилиндр вместимостью 20 см3,
коническая колба для титрования вместимостью 100 см3,
химический стакан вместимостью 100 см3.
титрованный раствор гидроксида натрия с концентрацией 0,1 моль/дм3,
спиртовой раствор фенолфталеина с массовой долей 1,0%.
Литература: Коренман Я.И. Практикум по аналитической химии. Воронеж, 2002, стр 49-51.
Жванко Ю.М. Аналитическая химия и технохимический контроль в общественном питании, М., глава XI., стр. 92 -104.
Теоретическое пояснение
Определение основано на алкалиметрическом (титрант - щелочь, от латинского слова «alkaly») титровании кислых солей, содержащихся в молоке. Кислотность молока и молочных продуктах выражается в градусах Тернера (оТ), показывающих число см3 раствора гидроксида натрия с концентрацией 0,1 моль/дм3 , необходимое для нейтрализации 100 см3 молока или 100 г молочного продукта.
Порядок выполнения работы
1. Анализ. Бюретку заполняют титрованным раствором гидроксида натрия.
В колбу для титрования пипеткой помещают 10,00 см3 молока, добавляют 20 см3 дистиллированной воды и 2-3 капли раствора индикатора. Предварительно выполняют ориентировочное титрование, добавляя титрант порциями по 1,0 см3. Фиксируют появление розовой окраски, устойчивой в течение 30 с. Измеряют объем титранта с точностью до 1,0 см3.
Точное титрование выполняют не менее трех раз, приливая титрант вблизи точки эквивалентности по каплям. Измеряют объем титранта по бюретке с точностью до 0,05 см3. Вычисляют средний объем титранта, израсходованный на титрование.
Результаты титрования помещают в таблицу.
2. Расчет. Кислотность молока (К, 0Т ) рассчитывают по формуле:
К = 10 * V(NaOН)
где V(NaOH) - объем титранта, затраченный на титрирование, см3;
10 - коэффициент пересчета, учитывающий объем титранта при анализе 100 см3 молока.
Кислотность молока не должна превышать 21 оТ, молока для детских учреждений-19 оТ.
Контрольные вопросы
-
Какие способы выражения концентрации используют в титриметрическом анализе?
-
Что означает выражение «раствор имеет нормальную концентрацию»?
-
В каких единицах измеряется нормальная концентрация?
-
Что понимают под титром раствора?
-
Какая масса называется эквивалентной?
-
Как определяется эквивалентная масса:
-
кислоты;
-
основания;
-
соли?
Лабораторная работа № 16
Тема: Установление титра рабочего раствора тиосульфата натрия методом замещения.
Цель: изучить метод замещения и условия титрования в присутствии специфического индикатора, установить титр рабочего раствора тиосульфата натрия.
Должны знать:
-
сущность метода иодометрии;
-
измерительную посуду объемного анализа и ее назначение.
Должны уметь:
-
устанавливать титр рабочего раствора методом замещения;
-
вычислять молярную концентрацию эквивалента (моль/дм3) и титр (г/см3) рабочего раствора.
Посуда и реактивы: бюретка вместимостью 25 или 50 см3,
пипетка Мора вместимостью 10 см3, мерная колба вместимостью 100 см3,
коническая колба для титрования вместимостью 100 см3,
мерные цилиндры вместимостью 10 см3 - 2 шт, экран для титрования,
химический стакан вместимостью 100 см3, воронка диаметром 3 см,
часовое или покровное стекло, промывалка с дистиллированной водой,
стандартный раствор дихромата калия, с(1/6К2Cr2О7) = 0,2000 моль/дм3,
рабочий раствор тиосульфата натрия, с(1/1Na2S2О3)@0,02 моль/дм3,
раствор серной кислоты, с(1/2Н2SO4) = 2,0 моль/дм3,
раствор иодида калия с массовой долей 10,0%,
раствор крахмала с массовой долей 0,5%.
Литература: Коренман Я.И. Практикум по аналитической химии. Воронеж, 2002, стр 95-101.
Жванко Ю.М. Аналитическая химия и технохимический контроль в общественном питании, М., глава XIII, стр. 117 -122.
Теоретическое пояснение.
Метод иодометрии основан на полуреакции:
I2 + 2е ® 2I-
Реакция обратима, ее направление зависит от условий. Иод плохо растворим в воде, но в присутствии идодид-ионов образуется комплекс I3-, поэтому при титровании протекает реакция:
I3- + 2е ® 3I-
I2 - окислитель средней силы, I- - средней силы восстановитель, поэтому в иодометрии применяют окислительные свойства йода и восстановительные свойства иодидов. Иодометрия является универсальным методом и применяется для определения и восстановителей, и окислителей.
Условия иодометрического титрования.
- Титруют в нейтральной, кислой или слабощелочной средах; рН < 9, так как в щелочной среде образуется гипоиодид:
I2 + 2ОН- = IO- + I- + Н2О.
Гипоиодид - сильный окислитель, окисление титранта приводит к завышенным результатам титрования. Поэтому анализируемый раствор подкисляют серной кислотой.
- Титрование проводят на холоде, так как I2 - летучее соединение; кроме того, при повышенной температуре понижается чувствительность индикатора.
- Реакция между определяемым веществом и иодидом калия протекает во времени, поэтому выделившийся в результате реакции иод титруют спустя 5-7 мин.
- Вследствие плохой растворимости I2 в воде при определении окислителей добавляют избыток Кl. Выделившийся в результате реакции замещения иод хорошо растворяется в растворе Kl. Кроме того, избыток иодида калия способствует ускорению реакции в требуемом направлении.
- Реакция замещения протекает в затемненном месте, без доступа воздуха, так как свет ускоряет окисление I- кислородом воздуха до I2, это приводит к завышенным результатам титрования.
- Высокая точность титрования обусловлена применением специфического чувствительного индикатора - крахмала ; раствор крахмала должен быть свежеприготовленным.
Амилоза, входящая в состав крахмала, образует с йодом адсорбционно-комплексное соединение, окрашенное в синий цвет. Прочность комплекса зависит от концентрации иода в растворе: чем она выше, тем устойчивее комплекс.
Особенность применение крахмала как индикатора заключается в том, что его добавляют в конце титрования, когда концентрация иода в пробе мала, и раствор имеет соломенно-желтую окраску. В присутствии крахмала раствор приобретает синюю окраску, титрование продолжают до обесцвечивания раствора.
Если крахмал добавить в начале титрования, когда концентрация йода в растворе высока, образует прочный комплекс, для разрушения которого требует избыток титранта, при этом пробу перетитровывают.
Иодометрическое определение окислителей выполняют методом замещения по следующей схеме.
1. В колбу для титрования помещают избыток раствора KI, раствор подкисляют серной кислотой и добавляют анализируемый раствор окислителя.
Колбу с реакционной смесью накрывают часовым стеклом и помещают на 5 мин в затемненное место. При этом протекает реакция замещения, в результате образуется эквивалентное количество I2.
2. Окрашенный в бурый цвет раствор иода титруют раствором тиосульфата натрия; индикатор - крахмал, который добавляют в конце титрования.
Препарат Na2S2О3 * 5Н2О не относится к стандартным веществам, так как может не соответствовать своей химической формуле (кристаллизационная вода при хранении выветривается) и разрушаться ферментными тиобактериями. Кроме того, раствор тиосульфата натрия неустойчив при хранении, подвержен автоокислению. Поэтому говорят рабочий раствор, точную концентрацию которого устанавливают при титровании стандартного раствора дихромата калия.
Титр рабочего раствора тиосульфата натрия устанавливают методом замещения, так как прямое титрование невозможно вследствие нестехиометричности реакции тиосульфата натрия с дихроматом калия. Определение проводят в присутствии серной кислоты и избытка иодида калия. При этом известное количество К2Cr2О7 замещается на эквивалентное количество иода:
К2Cr2О7 + 6KI + 7Н2SO4 ® Сr2(SO4)3 + 3I2 + 4K2 SO4 + 7Н2О.
Выделившейся в результате реакции иод оттитровывают раствором тиосульфата натрия:
I2 + 2Na2S2O3 ® 2 NaI + Na2S4O6
.
Порядок выполнения работы.
Приготовление стандартного раствора. Стандартный раствор дихромата калия готовят в мерной колбе разбавлением в 10 раз исходного раствора с молярной концентрацией эквивалента 0,2000 моль/дм3. Полученный раствор имеет молярную концентрацию эквивалента с(1/6К2Cr2О7) =0,2000 моль/дм3.
Стандартизация рабочего раствора Na2S2О3. Бюретку через воронку заполняют рабочим раствором тиосульфата натрия. На штатив помещают экран для титрования.
В колбу для титрования мерными цилиндрами отмеряют 5-7 см3 раствора KI и 5-10 см3 раствора серной кислоты. К полученной смеси мерной пипеткой прибавляют 10,00 см3 приготовленного раствора дихромата калия. Колбу закрывают часовым или покровным стеклом, чтобы предотвратить испарение I2 . Для завершения реакции колбу помещают на 5 мин в затемненное место. Затем стекло снимают и ополаскивают из промывалки водой, промывные воды собирают в колбу для титрования. Сразу приступают к титрованию.
Окрашенный в бурый цвет раствор титруют раствором тиосульфата натрия до светло-желтой окраски, когда в колбе останется небольшое количество свободного иода. Затем добавляют несколько капель раствора крахмала, раствор в колбе приобретает синий цвет, продолжают титровать до обесцвечивания раствора. Последние капли титранта прибавляют медленно, перемешивая раствор после каждой прибавленной капли.
-
Чтобы убедится в правильности результата, в колбу добавляют 1 каплю стандартного раствора дихромата калия, при этом раствор приобретает бледно-синюю окраску.
Точное титрование выполняют не менее трех раз; результаты записывают в таблицу.
V(Na2S2О3), см3
см3
Vср., см3
По результатам всех титрований рассчитывают молярную концентрацию эквивалента и титр раствора тиосульфата натрия:
с(1/1Na2S2О3) = с(1/6К2Cr2О7) * V(К2Cr2О7)
V (Na2S2О3)
Т = с(1/1Na2S2О3) * V (Na2S2О3) .
1000
Контрольные вопросы
-
На чем основан метод иодометрии?
-
Почему рабочий раствор тиосульфата натрия стандартизируют методом замещения?
-
Что является титрантом и стандартными веществами в методе иодометрии?
-
Каковы условия хранения рабочих растворов при иодометрических определениях?
-
Какие условия необходимо соблюдать при иодометрическом титровании?
-
На чем основано применение индикатора в иодометрии?
Лабораторная работа № 17.
Тема: Определение аскорбиновой кислоты во фруктовых напитках.
Цель: освоить методику обратного иодометрического титрования и определить аскорбиновую кислоту в напитках.
Должны знать:
-
сущность метода иодометрии;
-
измерительную посуду объемного анализа и ее назначение.
Должны уметь:
-
осуществлять процесс титрования;
-
определять аскорбиновую кислоту методом обратного иодометрического титрования.
Посуда и реактивы: бюретка вместимостью 25 или 50 см3, воронка диаметром 3 см,
пипетки Мора вместимостью 5 и 20 см3 - по 1 шт,
конические колбы для титрования вместимостью 100 см3 - 2 шт,
мерные цилиндры вместимостью 10 и 20 см3 - по 1 шт,
часовое или покровное стекло, промывалка с дистиллированной водой,
раствор серной кислоты, с(1/2Н2SO4) = 2,0 моль/дм3,
раствор иода, с(1/2I2) = 0,0100 моль/дм3,
раствор крахмала с массовой долей 0,5%,
стандартизированный раствор тиосульфата натрия,
с(1/1Na2S2O3) = 0,02000 моль/дм3.
Литература: Коренман Я.И. Практикум по аналитической химии. Воронеж, 2002, стр 95-103.
Жванко Ю.М. Аналитическая химия и технохимический контроль в общественном питании, М., глава XIII, стр. 111 -120.
Теоретическое пояснение.
Аскорбиновую кислоту (витамин С) добавляют в напитки для подкисления. Количественное определение аскорбиновой кислоты основано на ее восстановительных свойствах. При взаимодействии с иодом она окисляется до дегидроаскорбиновой кислоты:
С6Н8О6 + I2 ® С6Н6О6 + 2НI.
Высокая концентрация аскорбиновой кислоты в напитках препятствует взаимодействию иода с другими восстановителями, например, с глюкозой, фруктозой, амилозой.
Для определения аскорбиновой кислоты применяют метод обратного титрования: к анализируемой пробе добавляют избыток иода, остаток не вступившего в реакцию с аскорбиновой кислотой иода титруют раствором тиосульфата натрия.
Порядок выполнения работы
Анализ. В колбу для титрования помещают 20,00 см3 фруктового напитка, добавляют 3-4 см3 раствора серной кислоты, мерной пипеткой вводят 5,00 см3 раствора иода, колбу прикрывают стеклом. В течение 5 мин аскорбиновая кислота окисляется, затем избыток иода оттитровывают раствором тиосульфата натрия до перехода бурой окраски в светло желтую. Добавляют раствор крахмала и продолжают титрование до обесцвечивания раствора. Выполняют два титрования. Рассчитывают средний объем титранта, затраченный на титрирование.
Расчет. Содержание аскорбиновой кислоты в 20 см3 напитка (m, г) вычисляют по формуле:
(c(1/2 I2) * V(I2) - С(1/1Na2S2O3) * V(Na2S2O3) * M(1/2 C6H8O6)
m = ---------------------------------------------------------
1000
Молярная масса эквивалента аскорбиновой кислоты М(1/2 С6Н8О6) = 88 г/моль.
Контрольные вопросы.
1. Каким требованиям должны отвечать реакции окисления-восстановления, чтобы их можно было использовать в количественном анализе?
2. Какие реакции лежат в основе метода иодометрии?
3. Чему равна эквивалентная масса тиосульфата натрия в реакции взаимодействия его с иодом?
4. Что такое титрование методом замещения?
5. В чем суть метода обратного титрования?
Лабораторная работа № 18.
Тема: Приготовление рабочего раствора нитрата серебра и установление нормальной концентрации.
Цель: познакомиться с условиями проведения титрования по методу Мора, установить нормальную концентрацию раствора нитрата серебра.
Должны знать:
-
сущность методов осаждения;
-
аргентометрия (метод Мора), условия применения метода.
Должны уметь:
-
осуществлять процесс титрования методом Мора.
Посуда и реактивы: стандартный раствор - 0,05 н. AgNO3; установочное вещество - 0,05 н. NaCl; индикатор - 5 %-ный K2CrO4, мерный цилиндр или мерная пробирка вместимостью 10 см3,
мерный цилиндр вместимостью 100 см3,
склянка для хранения раствора вместимостью 100 см3,
аналитические весы, технические весы,
мерная колба вместимостью 250 см3,
склянка для хранения раствора вместимостью 100 см3,
Литература: Коренман Я.И. Практикум по аналитической химии. Воронеж, 2002, стр. 125-131.
Жванко Ю.М. Аналитическая химия и технохимический контроль в общественном питании, М., глава XIY, стр. 122 -125.
Теоретическое пояснение
В основе метода осаждения лежат реакции, сопровождающиеся выпадением осадка. В отличие от гравиметрического метода обработку осадка здесь не производят, массу исследуемого вещества определяют по объему реактива, израсходованному на реакцию осаждения. Не все реакции осаждения пригодны для объемно-аналитических определений, а только те из них, которые удовлетворяют определенным требованиям: 1) осадок должен быть практически нерастворимым; 2) взаимодействие стандартного раствора с определенным веществом должно протекать в соответствии с уровнем реакции; 3) выпадение осадка должно происходить быстро; 4) должна четко определяться точка эквивалентности.
Чаще всего методом осаждения определяют содержание ионов I-, Br-, Cl- в виде солей: AgI, AgBr, AgCl. Метод применяется для определения содержания поваренной соли в отдельных продуктах или рассолах.
Для определения ионов I-, Br-, Cl- в качестве стандартного раствора используют раствор AgNO3, поэтому метод называют аргентометрическим. В этом методе точку эквивалентности устанавливают без индикатора, зафиксировав прекращение образования осадка от добавления новой порции стандартного раствора; с индикатором, который в точке эквивалентности дает окрашенное соединение от добавления одной лишней капли AgNO3; можно в качестве индикатора использовать красители, которые в момент окончания реакции адсорбируются осадком и изменяют его цвет, и т. п. В зависимости от того, каким путем устанавливают точку эквивалентности, различают несколько способов выполнения аргентометрического метода.
Здесь рассматривается способ Мора, который не сложен в исполнении, обладает достаточной точностью и чаще всего применяется для определения хлоридов в растворе.
Способ Мора. В качестве стандартного раствора используется 0,05 н. AgNO3, титр и нормальную концентрацию которого устанавливают по раствору NaCl, индикатором является 5%-ный раствор K2CrO4. Определение хлорида натрия в растворе основано на уравнениях реакций:
NaCl + AgNO3 = AgCl + NaNO3
K2CrO4 + 2AgNO3 = Ag2CrO4 + 2KNO3
Образование AgCl - осадка белого цвета - происходит до тех пор, пока в растворе содержатся ионы Cl-. По достижении точки эквивалентности добавление одной капли AgNO3 приводит к образованию красно-коричневого осадка Ag2CrO4. То, что осадок Ag2CrO4 образуется лишь, после того как в реакцию вступили все ионы Cl-, объясняется различием в растворимости этих осадков. Растворимость AgCl составляет 1,3 * 10-5 моль/л, Ag2CrO4 - 1,3 * 10-4 моль/л, т. е. хромат серебра, обладает в десять раз большей растворимостью и, чтобы заметить его образование, нужно затратить некоторое избыточное количество раствора AgNO3.
Титрование по методу Мора проводят в нейтральной среде, так как в кислой среде хромат серебра растворяется, а в щелочной образуется бурый оксид серебра Ag2О, затрудняющий определение точки эквивалентности; в аммиачной среде и хлорид, и хромат серебра растворяются с образованием комплексного аммиаката серебра.
Порядок выполнения работы
1. Приготовление стандартного раствора AgNO3.
Для работы достаточно 250 мл 0,05 н. AgNO3. Нитрат серебра содержит примеси, поэтому готовят раствор приблизительной концентрации, а точные значения нормальной концентрации и титра устанавливают по раствору NaCl. Эквивалентная масса AgNO3 составляет 169,89 г.
Необходимую навеску рассчитаем по уравнению
m(AgNO3) = 0,05 * 169,89 * 250 = 2,1236 г.
1000
Навеску, близкую к рассчитанной, берут на технохимических весах, переносят в мерную колбу вместимостью 250 мл, растворяют в небольшом объеме дистиллированной воды, затем доводят объем раствора до метки дистиллированной водой и тщательно перемешивают. Растворы AgNO3 разлагаются на свету, поэтому их хранят в темных склянках.
2. Приготовление установочного раствора NaCl.
Для установления титра бывает достаточно 100 мл раствора установочного вещества, который готовят той же концентрации, что и стандартный раствор. Эквивалентная масса NaCl 58,44 г. Для приготовления 100 мл 0,05 н. NaCl необходима навеска:
m(NaCl) = 0,05 * 58,44 * 100 = 0,2922 г.
1000
Взвешенную на аналитических весах навеску, близкую к рассчитанной, переносят в мерную колбу вместимостью 100 мл, растворяют, доводят объем раствора до метки дистиллированной водой и, закрыв пробкой, хорошо перемешивают.
3. Установление титра и нормальной концентрации раствора AgNO3. Приступая к аргентометрическому методу определения, следует помнить, что серебро - драгоценный металл, поэтому все использованные растворы нитрата серебра, а также осадки хлорида серебра нельзя сливать в раковину, а следует собирать в специально отведенные для этого склянки.
Бюретку заполняют раствором AgNO3. Пипетку ополаскивают раствором NaCl и 10 мл его переносят в коническую колбу для титрования. Добавляют 0,5 мл 5%-ного раствора K2CrO4, раствор окрашивается в желтый цвет. Из бюретки по каплям добавляют раствор AgNO3, тщательно перемешивая раствор в колбе. Титрование заканчивают, когда окраска раствора из желтой перейдет в красно-коричневую вследствие образования осадка хромата серебра.
Примерный расчет
-
Приготовление 100 мл 0,05 н. NaCl.
Масса часового стекла с NaCl, г . . . . . . . . . . . . 12,5692
Масса часового стекла, г . . . . . . . . . . . . . . . . 12,2756
Навеска NaCl, г . . . . . . . . . . . . . . . . . . . . . . 0,2936
-
Вычисление титра раствора NaCl:
T (NaCl) = навеска = 0,2936 = 0,002936 г/мл
объем колбы 100
3. Вычисление нормальной концентрации раствора NaCl:
N (NaCl) = T (NaCl) * 1000 = 0,002936 * 1000 = 0,05023 экв/л
Э (NaCl) 58,44
-
Определение нормальной концентрации раствора AgNO3:
Титрование
Объем NaCl, мл
Объем AgNO3, мл
Индикатор
 1
1
2
3
10,00
10,00
10,00
10,26
10,28
10,25
V cр = 10,26
5%-ный
раствор
K2CrO4.
N (AgNO3) = V (NaCl) * N (NaCl) = 10*0,05023 = 0,04896 экв/л.
Vср (AgNO3) 10,26
Контрольные вопросы
-
На чем основан метод осаждения?
-
Каким требованиям должна удовлетворять реакция осаждения, чтобы ее можно было использовать для количественных определений?
-
Что такое аргентометрия?
-
В чем состоит способ Мора?
-
К каким методам (гравиметрическому или объемному) следует отнести метод осаждения и почему?
Лабораторная работа № 19.
Тема: Определение содержания хлорида натрия в растворе.
Цель: освоить методику аргентометрического определения хлорида натрия в растворе.
Должны знать:
-
сущность методов осаждения;
-
аргентометрия (метод Мора), условия применения метода.
Должны уметь:
-
осуществлять процесс титрования методом Мора.
Посуда и реактивы: стандартный раствор - 0,05 н. AgNO3; установочное вещество - 0,05 н. NaCl; индикатор - 5 %-ный K2CrO4, мерный цилиндр или мерная пробирка вместимостью 10 см3,
мерный цилиндр вместимостью 100 см3,
склянка для хранения раствора вместимостью 100 см3,
аналитические весы, технические весы,
мерная колба вместимостью 250 см3,
склянка для хранения раствора вместимостью 100 см3,
Литература: Коренман Я.И. Практикум по аналитической химии. Воронеж, 2002, стр 125-131.
Жванко Ю.М. Аналитическая химия и технохимический контроль в общественном питании, М., глава XIY, стр. 122 -125.
Порядок выполнения работы
Определение содержания NaCl в растворе. Получив от преподавателя раствор хлорида натрия в мерной колбе вместимостью 100 мл, доводят объем его до метки дистиллированной водой, закрывают пробкой и хорошо перемешивают. Поступают так же, как при установлении титра раствора AgNO3. Бюретку заполняют раствором AgNO3. Пипетку ополаскивают раствором NaCl и 10 мл его переносят в коническую колбу для титрования. Добавляют 0,5 мл 5%-ного раствора K2CrO4, раствор окрашивается в желтый цвет. Из бюретки по каплям добавляют раствор AgNO3, тщательно перемешивая раствор в колбе. Титрование заканчивают, когда окраска раствора из желтой перейдет в красно-коричневую вследствие образования осадка хромата серебра.
Титрование повторяют трижды и для вычислений берут среднее значение объема раствора AgNO3..
Определение содержания NaCl в 100 мл раствора:
Титрование
Объем NaCl, мл
Объем AgNO3, мл
Индикатор
 1
1
2
3
10,00
10,00
10,00
11,36
11,38
11,36
5%-ный
раствор
K2CrO4.
1-й способ. Вычисляем навеску по формуле
m = N * Э * V / 1000
N (NaCl) = 0,05023 экв/л ( смотреть расчет в работе № 17)
Эквивалентная масса NaCl 58,44 г.
m (NaCl) = 0,05023 * 58,44 * 100 = 0,3250 г.
1000
2-й способ. Вычислив Т (AgNO3/NaCl):
Т (AgNO3/NaCl) = N (AgNO3) * Э (NaCl) = 0,04896 * 58,44 = 0,002861 г/мл,
-
1000
находим содержание NaCl в 100 мл раствора:

m (NaCl) = Т (AgNO3/NaCl) * V (AgNO3) * 10 = 0,002861 * 11,36 * 10 = 0,3252 г.
Контрольные вопросы
-
Почему определение хлоридов способом Мора рекомендуется проводить в нейтральной среде? Что произойдет, если среда будет аммиачной?
-
Сколько граммов хлорида натрия содержится в растворе объемом 250 мл, если на титрование 10.0 мл его израсходовано 12,5 мл 0,05 н AgNO3?
-
На чем основан метод комплексиметрии?
-
Какое соединение в комплексиметрии обозначают через ЭДТА?
-
Что такое металлиндикаторы? На чем основано их применение?