- Учителю
- Провероные работы по теме «Кислородные соединения углерода».
Провероные работы по теме «Кислородные соединения углерода».
Задания контроля знаний учащихся по химии, разработанные учителем химии Муллиной Надеждой Владимировной, с. Хорновар-Шигалинской СОШ, Дрожжановского р-на, РТ.
Самостоятельная работа по теме «Кислородные соединения углерода». Проводится на этапе актуализации.
Инструктаж перед использованием самостоятельной работы :
1.Прочтите задания внимательно, не торопясь.
2.В 1-ом задании писать только номер задания и правильную букву ответа, во 2-ом задании - задаче- писать полное решение.
Задание. 1. Выберите из предложенных утверждений только те, которые справедливы: I вариант - для алмаза, II вариант - для графита.
-
Прозрачный, бесцветный.
-
Очень твердый.
-
Ковалентная неполярная связь.
-
Не проводит электрический ток.
-
Используют как добавку в смазке.
-
Непрозрачный, серого цвета, с металлическим блеском.
-
Электропроводен.
-
Атомная кристаллическая решетка.
-
Легко расслаивается на отдельные мельчайшие пластинки.
-
При обычных условиях химически инертен, при высокой температуре становится активным.
2. Задача. Рассчитайте, во сколько раз изменится скорость реакции Н2+С12 = 2НС1 при увеличении давления в 2 раза.
Решение: υ = ± dC/dt, ῡ = - ΔC/Δt [моль/л·с].
H2 + Cl2 = 2HCl
υпрям = k×[H2] ×[Cl2];
υобр = k×[HCl]2
При увеличении давления в 2 раза концентрация веществ увеличится тоже в 2 раза и скорость реакции станет равна:
υпрям 2= k×[2H2] ×[2Cl2]
υпрям 2/ υпрям1= k×[2H2] ×[2Cl2] /k×[H2] ×[Cl2] = 4,
υпрям возрастает в 4 раза.
Ответы: Задание 1.: I вариант - 1,2,3,4,8,10. II вариант - ,5,6,7,8,9,10. 2. Задача: ответ: в 4 раза.
Разбалловка ответов:
В 1 задании за каждые правильные цифры дается по 1 баллу.
Во 2 задании 4 балла- нет ошибок, правильный ответ; 3 балла- недочеты в решении, но правильный ответ; 0 баллов- неправильный ответ.
10-9 баллов оценивается как «5»
8-7 баллов - «4»
6-5 баллов - «3»
От 4 и менее баллов - «2».
Проверочная работа по теме «Кислородные соединения углерода». Проводится на этапе актуализации.
Инструктаж перед использованием проверочной работы:
1.Прочтите задания внимательно, не торопясь.
2.В заданиях, с выбором одного правильного ответа, писать только номер задания и правильную букву ответа, в задаче писать полное решение.
3.В начале свои ответы и решения задач выполняйте на черновиках. Перед списыванием решения из черновика в тетрадь проверьте внимательно свои решения.
Задания с выбором одного правильного ответа.
Часть А.
1.CO - это:
А) углекислый газ Б) угольная кислота
В) угарный газ Г) оксид углерода (IV)
2.Оксид углерода (IV) взаимодействует с:
А) серной кислотой Б) гидроксидом калия
В) магнием Г) кислородом
3.Углерод проявляет восстановительные свойства в реакции:
А) Ca+2C= CaC2 Б) C +FeO = Fe+ CO
В) CO2+Li2O= Li2CO3 Г) 4Al+ 3C = Al4C3
4.Углерод является окислителем в реакции:
А) Ca+2C= CaC2 Б) C +2FeO = 2Fe+ CO2
В) CO2+BaO=BaCO3 Г) H2O+ C = CO+ H2
5.«Сухой лед» получают при повышенном атмосферном давлении и низкой температуре из:
А) оксида углерода (II) Б) углерода
В) кислорода Г) оксида углерода (IV)
6.Оксид углерода (II) взаимодействует с:
А) водой Б) гидроксидом натрия
В) оксидом меди (II) Г) кислородом
Часть В.
Задания с выбором нескольких правильных ответов.
7. Выберите из предложенных утверждений те, которые справедливы для угарного газа (СО):
1. Бесцветный газ, без запаха.
2. Тяжелее воздуха.
3. Ядовитый.
4. Хорошо растворим в воде.
5. Плохо растворим в воде.
6. Немного легче воздуха.
7. Проявляет кислотные свойства.
8. Несолеобразующий оксид.
9. Соединяется с гемоглобином крови.
10. Получается разложением карбонатов.
11. При высоком давлении сжижается, образуя «сухой лед».
12. Применяют для получения соды.
13. Используют как газообразное топливо.
14. Используют в производстве фруктовых вод.
15. Используют в органическом синтезе.
8. Задача. Температурный коэффициент реакции равен 2,5. Как изменится ее скорость при охлаждении реакционной смеси от изменения температуры от 50 °С до 30 °С?
Решение:
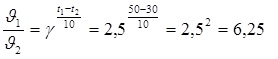
Скорость реакции уменьшится в 6,25 раз.
Ответы: 1- В, 2-Б, 3-В, 4-А, 5-Г, 6-В, 7-3,5,6,8,9,13,15; 8-6,25.
Разбалловка ответов: За правильный ответ на каждое задание в части А дается 1 балл.
В части В задание 7 оценивается по следующему принципу: 3 балла - нет ошибок, 2 балла - допущена 1 ошибка, 0 баллов - допущены 2 и более ошибок. Задание 8: 4 балла- нет ошибок в решении и правильный ответ; 3 балла- небольшие недочеты в решении, но правильный ответ, 0 баллов- не правильный ответ.
13-12 баллов оценивается как «5»
11-9 баллов - «4»
10-6 баллов - «3»
От 5 и менее баллов - «2».
Контрольная работа по теме главы 8 «Подгруппа Углерода». Проводится на весь урок.
Инструктаж перед использованием контрольной работы:
1.Прочтите задания внимательно, не торопясь.
2.В заданиях, с выбором одного правильного ответа, писать только номер задания и правильную букву ответа, в задаче писать полное решение.
3.В начале свои ответы и решения задач выполняйте на черновиках. Перед списыванием решения из черновика в тетрадь проверьте внимательно свои решения.
Задания с выбором одного правильного ответа.
1.Электронное строение атома углерода отвечает формуле:
а) lS22S22P4 б) 1S22S22P2
в)1S22S22p63S23p2 г)1S22S1
2.Для получения углекислого газа в лаборатории используют реакцию:
а) термического разложения карбоната кальция;
б) растворения карбоната кальция в соляной кислоте;
в) горение метана СН4
г) горение спирта С2Н5ОН
3.Высшие оксиды элементов-неметаллов в подгруппе углерода имеют состав:
а) СО2 и SiO2; б) СО2и SnО2; в) NO2 и SО2; г) СО и РЬО
4.Соединение углерода с металлом называется:
а) карбонат; б) силикат; в) силицид; г) карбид
5. Алмаз и графит обладают:
а) молекулярным строением;
б) ионным строением;
в) атомным строением;
г) металлическим строением
-
В какой из перечисленных реакций оксид кремния (IV) проявляет кислотные свойства:
а) SiО2 + 2NaOH = Na2SiO3 + Н2O;
б) SiО2+ 2С = Si + 2CO;
в) SiO2 + 2Mg = Si + 2MgО;
г) Si + O2 = SiO2
-
Какое из перечисленных веществ называется силикат магния:
а) MgCO3
б) Fe(НСО3)2
в) MgSiO3
г) ZnSiO3
8. Сырьем для получения оконного стекла являются:
а) СаСО3; Н2SiО3; СО2
б) СaСО3 ; SiO2 ; Na2CO3
в) СaСО3 ; Al2О3 ; К2СО3
г) CaСО3 ; МgО ; Fe СО3
-
Степень окисления углерода в молекуле угольной кислоты равна:
а) +4; б) +2; в) -4; г) -2
10. Состав «cvxoгo льда» можно выразить формулой:
а) СО2; б) СО; в) Н2SiО3; г) СН4
11.Угарный газ СО проявляет восстановительные свойства в реакции:
а) с водой; б) с оксидами металлов; в) с металлами; г) с соляной кислотой
12. Коэффициент перед формулой окислителя в уравнении реакции
СН4 + O2 = СO2 + Н2O равен:
а) 2; 6) 3; в) 1; г) 4
13. Какой из химических элементов не входит в подгруппу углерода: а) С; б) Si; в) As; г) Рb
14. В какой из реакций невозможно получить оксид кремния (IV):
а) Si + О2 =
б) H2SiО3 =
в) SiН4 + O2 =
г) Si + H2O =
15.Какой объем оксида углерода (IV) образуется при растворении 13,8г карбоната калия в избытке соляной кислоты? (н.у.)
а) 22,4л; б) 2,24; в) 44,8л; г) 4,48л
16. Задача. Константа равновесия реакции: СОСl2(г) ↔ СО(г)+С12(г) равна 0,02. Исходная концентрация СОCl2 составила 1,3 моль/л. Рассчитайте равновесную концентрацию Сl2. Какую исходную концентрацию СОCl2 следует взять, чтобы увеличить выход хлора в 3 раза?
Решение.
СОСl2(г) ↔ СО(г)+С12(г)
Запишем выражение для константы равновесия:
К = [СО]·[Cl2] ̸ [СОСl2]
Пусть [СО]равн = [Cl2]равн = х, тогда
[СОСl2]равн = 1,3 - х
Подставим значения в выражение для константы равновесия
0,02 = х·х/(1,3 - х)
Преобразим выражение в квадратное уравнение:
х2 + 0,02х - 0,026 = 0
Решая уравнение, находим
х = 0,15
Значит, [СО]равн = [Cl2]равн = 0,15 моль/л
Увеличив выход хлора в 3 раза получим:
[Cl2]равн = 3·0,15 = 0,45 моль/л
Исходная концентрация [СОСl2]исх2 при этом значении Cl2 равна:
[СОСl2]равн2 = 0,45·0,45/0,02 = 10,125 моль/л
[СОСl2]исх2 = 10,125 + 0,45 = 10,575 моль/л
Таким образом, чтобы увеличить выход хлора в 3 раза, исходная концентрация СОCl2 должна быть равна [СОСl2]исх2 = 10,575 моль/л
Ответы:
1-Б, 2-Б, 3- А, 4-Г, 5-В, 6-А, 7-В, 8- Б, 9-А, 10-А,11-Б, 12-А,13-В, 14-Г,15-Б, 16-10,575 моль/л.
Разбалловка ответов:
С 1-го по 14-го задания за правильный ответ дается по 1 баллу.
За правильное 15 задание дается 2 балла. За правильное решение 16 задания-задачи с правильным ответом дается 4 балла; 3 балла- недочеты в решении, но правильный ответ; 0 баллов- неправильный ответ.
20-18 баллов оценивается как «5»
17-15 баллов - «4»
14-11 баллов - «3»
От 10 и менее баллов - «2».
Источники:
-
УМК: Химия. 9 кл.: Учеб. Для общеобразоват. Учреждений / Н.И. Новошинский,Н.С. Новошинская. -3-е изд-е,перераб.- М.: ООО «Издательство Оникс»: «Издательство Мир и Образование», 2007- 240 с..
-
Интернет-ресурс: Статья «Задачи к разделу Химическая кинетика и равновесие химической реакции» - zadachi-po-khimii.ru/obshaya-himiya/zadachi-2.html
-
Электронные ресурсы:
Фестиваль пелагогических идей «Открытый урок» (Углерод. Кислородные соединения углерода) festival.1september.ru/articles/599651/
Сайт для учителей (Конспект урока химии "Кислородные соединения углерода") kopilkaurokov.ru/himiya/uroki/konspiekt-uroka-khimii-kislorodnyie-soiedinieniia-ughlieroda</</font>
Личный вывод: Проведя эти формы ( самостоятельная, проверочная, контрольная работы) контроля, я хочу узнать успеваемость учащихся по химии, знания учащихся по данной теме, умение учащихся анализировать увиденное и решить задания ( задачи, составление уравнения реакций); формировать у учащихся навыки самоконтроля усвоения изученного материала;