- Учителю
- Урок Химические реакции 8 класс
Урок Химические реакции 8 класс
Муниципальное бюджетное общеобразовательное учреждение
«Осиноплесская средняя общеобразовательная школа»
Областной конкурс
Конспект тематического урока по химии 8 класса
по теме
«Химические реакции»
Выполнила:
Учитель химии Золина Ольга Егоровна
Тема урока: Химические реакции.
Цели урока:
-
Деятельностная:
- формирование познавательных универсальных учебные действий при изучении химических реакций.
-
Предметно-дидактическая:
- формирование представления о химических явлениях - химических реакциях и их признаках;
- формирование представления об условиях протекания химических реакций.
Задачи:
Личностные: - сформировать представления о химических явлениях, признаках и условиях протекания химических реакций;
- повысить мотивацию собственных знаний;
- осознать необходимость соблюдения правил техники безопасности при выполнении эксперимента.
Метапредметные:
Регулятивные: - уметь управлять своими знаниями в новой ситуации;
- уметь объяснять зависимость протекания химических реакций от внешних условий;
Коммуникативные: - уметь работать в группах, выражать свою позицию.
Познавательные: выяснить какую роль играют химические реакции в окружающем мире.
Тип урока:
-
По ведущей дидактической цели: изучение нового материала.
-
По способу организации: синтетический
-
По ведущему методу обучения: проблемный.
Методы обучения:
-
Основной: построение и решение проблемы.
-
Дополнительные: объяснение, беседа, самостоятельная работа в парах, демонстрационный и лабораторный практикум и т.д.
Основные вопросы урока:
-
Химические реакции - явления, связанные с изменением состава вещества.
-
Химические процессы, происходящие в недрах Земли.
-
Признаки и условия протекания химических реакций.
-
Выделение тепла и света - реакции горения.
-
Понятие об экзо- и эндотермических реакциях.
Средства обучения:
- О.С.Габриелян. Учебник «Химия 8 класс». М. ДРОФА. 2012 год.
- Оборудование и реактивы для демонстрационного и лабораторного эксперимента: дихромат аммония, магний, соляная кислота, серная кислота, малахит, мрамор, спиртовка, сульфат меди (II), гидроксид натрия, фенолфталеин, пробирки.
- Приложения.
- Инструктивные карты для выполнения лабораторного эксперимента.
Ход урока:
1.Организационный момент. Проверка готовности учащихся к уроку.
Проверка д/з Перед изучением нового материала ответьте на вопросы. Мы знаем, что с телами и веществами происходят различные изменения, которые называются явлениями. - На какие группы делят эти явления? (физические и химические) - Назовите способы получения чистых веществ, к каким явлениям они относятся? (фильтрование, дистилляция или перегонка, выпаривание, отстаивание) - Какие процессы позволяют воде переходить из одного агрегатного состояния в другое? (процесс превращения жидкости в газ - испарение, переход газа в жидкость - конденсацией, жидкость в твердое - кристаллизацией).
Вспомним, что изучает химия? (Наука о веществах, их свойствах и превращениях).
2.Изучение нового материала:
Беседа учителя: Химические явления, или химические реакции, отличаются от физических тем, что в результате химических реакций происходит превращение одних веществ в другие. Причем, образовавшиеся вещества отличаются от исходных по своим свойствам. Например, железный гвоздь на воздухе ржавеет, ржавчина - это уже не железо, а совсем другое вещество, отличающееся по свойствам от железа. С химическими явлениями мы встречаемся и в повседневной жизни: скисание молока, гниение листьев, фотосинтез.
Запомните несколько признаков химических реакций: выпадение осадка, выделение газа, появление запаха, выделение или поглощение теплоты, появление света, изменение цвета.
Давайте проследим за протеканием химических реакций и установим признаки, которые подтверждают образование новых веществ и появление у них новых свойств.
Постановка проблемы:
1.Вспомните и перечислите известные вам физические явления в химии.
2.Какие изменения происходят с веществами при физических явлениях?
3.Изменяется ли при этом состав веществ, из которых состоят тела?
(Учитель контролирует работу учащихся. Выясняет возникшие затруднения.)
По результатам работы предлагает определить главное отличие химических реакций от физических явлений.
Итак, в химической реакции меняется состав вещества. Можем ли мы по внешним признакам определить это изменение? Можно ли отличить химическую реакцию от физического явления? По каким признакам? Каковы условия протекания химических реакций?
Объявляется тема урока и учитель предлагает выполнить самостоятельную работу, используя приложение 1.
Осуществляется взаимопроверка, сверяется правильность выполнения задания.
Минитест:
Среди перечисленных явлений укажите физические и занесите их в левую часть таблицы, а явления, которые не относятся к физическим, занесите в правую часть таблицы:
а) ржавление железа,
б) горение свечи,
в) плавление льда,
г) плавление олова,
е) испарение воды,
ж) получение проволоки из бруска алюминия,
з)скисание молока,
и) горение спирта.
Составляют схему явлений:
ФИЗИЧЕСКИЕ - новых веществ не образуется
ХИМИЧЕСКИЕ - образуются новые вещества
Дают определение химическим реакциям.
Беседа: Ответы на поставленные вопросы можно найти, изучив теоретический материал по учебнику, а можно попытаться найти в результате наблюдений, которые вам предстоит осуществить по ходу демонстрационного и лабораторного эксперимента.
Предложите ваши варианты решения проблемы.
Под руководством учителя разрабатывают план:
1.Провести наблюдения по ходу демонстрационного эксперимента и назвать признаки проделанных реакций.
2. Выполнить лабораторный эксперимент, сделать вывод о существующих признаках химических реакций.
3. Демонстрационный и лабораторный эксперименты.
Внимательно пронаблюдайте, устно опишите то, что будете наблюдать и определите, можно ли данное явление отнести к химической реакции, по каким признакам.
Опыт №1 Разложение дихромата аммония.

Вопрос: Какое явление в природе напоминает этот опыт?
Вопрос: Можем ли мы визуально определить, произошла ли химическая реакция? По каким признакам?
Вопрос: Существуют ли какие-либо еще, кроме названных, признаки химических реакций?
Для ответа на этот вопрос вам необходимо выполнить лабораторные опыты.
Проводится инструктаж по технике безопасности, контролирует работу групп (задания для лабораторного эксперимента делятся на три группы и выполняются по инструктивным карточкам в парах - приложение 2).
Предлагает обсудить результаты проведенных реакций, отметив их признаки.
По окончании работы и обсуждения ее результатов предлагает каждому оценить степень участия в лабораторном эксперименте по пятибалльной системе.
После обсуждения результатов наблюдений, полученных в ходе лабораторного эксперимента и составления схемы, предлагает вспомнить признаки реакции, отмеченные в ходе наблюдения за опытом «Вулкан».
Демонстрирует опыт «Горение магния». Отметьте признаки данной реакции.
Вопрос: Всегда ли реакции, идущие с выделением энергии, сопровождаются выделением света?
Вводится определение реакции горения.
Демонстрирует опыт «Разложение малахита».
Задание: Назовите условия, при которых проводились реакции горения магния и разложения малахита, сравните данные условия, определив черты сходства и различия.
Обобщает высказанное учениками, обращая внимание на то, что для реакции горения магния нагревание необходимо только для того, чтобы реакция началась, а при разложении малахита нагревание необходимо на протяжении всей реакции.
Подводит к классификации химических реакций по признаку выделение или поглощение тепла (энергии). Объясняет значение терминов: экзотермическая, эндотермическая.
Для осуществления реакции разложения малахита необходимым условием было нагревание.
Вопрос: Какие ещё условия, кроме нагревания, необходимы для протекания химических реакций?
Задание: работа с текстом учебника.
Отметить и выписать в тетрадь условия протекания химических реакций.
Ответы:
В группах выбирают «заведующего лабораторией» и выполняют в парах лабораторные опыты с использованием инструктивных карточек (приложение 2).
1 группа:
- р-р сульфата меди (II) + р-р гидроксида натрия;
- гидроксид меди (II) + р-р серной кислоты;
2 группа:
- мрамор (мел) + р-р соляной кислота;
- к р-ру гидроксида натрия добавить каплю фенолфталеина + р-р соляной кислоты;
Представитель от каждой группы («заведующий лабораторией») озвучивает результаты наблюдений и оценивают степень своего участия в проведении лабораторного эксперимента и выставляют оценку на бланке ответов.
Учитель: Реакции, которые протекают с выделение теплоты и света, называются реакциями горения (см. рис. 93). Кроме того, реакции, протекающие с выделением теплоты, называются экзотермическими (экзо - наружу), а реакции, протекающие с поглощением теплоты, называются эндотермическими (эндо - внутрь) (см. рис. 95).
К эндотермическим реакциям относится реакция разложения оксида ртути (II). Оксид ртути (II) представляет собой вещество красного цвета. При нагревании образуется кислород, который улетучивается и ртуть - металл серебристо-белого цвета (см. рис. 94).
По ходу обсуждения на доске создаётся схема, которую заносят в тетрадь:
Признаки химических реакций: Выпадение осадка, растворение осадка, выделение газа, изменение окраски вещества, выделение тепла и света, поглощение тепла.
Составляют схему:«Классификация химических реакций по тепловому эффекту», заносят ее в тетрадь.
Записывают в тетрадь определения реакций горения, экзо - и эндотермической.
Учитель: Чтобы химическая реакция прошла, необходимы определенные условия:
-
Необходимо, чтобы реагирующие вещества соприкоснулись, чем больше будет площадь их соприкосновения, тем быстрее пойдет реакция, для этого твердые вещества измельчают и перемешивают, а растворимые - растворяют и сливают растворы;
-
Нагревание - второе условие, которое в основном необходимо для эндотермических реакций, для экзотермических оно необходимо для начала реакции, а в некоторых случаях и вовсе не нужно;
-
Некоторые реакции не протекают без света, электрического тока. Например, для процесса фотосинтеза - свет - это необходимое условие.
В 1748 г. М.В. Ломоносов открыл закон сохранения массы веществ, который гласит: масса веществ, вступивших в химическую реакцию, равна массе веществ, получившихся в результате ее.
Как известно, носителями массы веществ являются атомы химических элементов, из которых состоят как вещества, которые вступают в химическую реакцию (реагенты), так и вещества, образовавшиеся в результате реакции (продукты реакции). При химических реакциях атомы не разрушаются и не образуются, а происходит только их перегруппировка.
Работа в тетради: Условия протекания химических реакций:
1)соприкосновение реагирующих веществ (измельчение, растворение);
2)нагревание.
4.Дополнение по теме: Разнообразие химических реакций на Земле:
Окружающий нас мир при всем его богатстве и многообразии живет по законам, которые достаточно легко объяснить с помощью таких наук, как физика и химия.
В основе жизнедеятельности такого сложного организма, как человек, лежат химические явления и процессы.
В недрах нашей планеты непрерывно происходят внутренние процессы, изменяющие лик Земли. Чаще всего эти изменения показывают, что одни участки земной поверхности поднимаются, другие опускаются.
Химические процессы, происходящие внутри Земли, вызывают изменения физического состояния Земли, объема и других свойств вещества. Это приводит к накапливанию упругих напряжений в какой-либо области земного шара. Когда упругие напряжения превысят предел прочности вещества, произойдет разрыв и перемещение больших масс земли, которые будут сопровождаться сотрясениями большой силы. Таким образом происходит землетрясение.
На Земле существует еще одно грозное явление, связанное с внутренними процессами, происходящими в земной коре - вулканизм. Вулкан - это конусообразная гора, через которое извергается магма.
5.Закрепление и самооценка.
Выдаёт задания на самостоятельную работу (либо тест, либо работа с презентацией, в которой предлагаются изображения или видео различных физических явлений и химических реакций). Учащимся предлагается выбрать химические реакции и записать признаки, по которым их можно отличить от физических явлений.
После выполнения задания предлагает ознакомиться с правильными ответами и оценить свою работу.
Выполняют самостоятельную работу сверяют ответы и выставляют оценку.
6.Рефлексия деятельности на уроке.
Беседа. Назовите самые интересные и успешные, по вашему мнению, ответы участников вашей группы.
Вопросы:
1.Удалось ли вам справиться с заданиями? (В тетради записывают «да» или «нет).
2. Какое задание было для вас наиболее интересным? (Отмечают задание (тест, лабораторная, умение сделать вывод, провести наблюдение и т.д.)
3.Какое задание было для вас наиболее сложным? (Отмечают задание)
4.Какую бы вы поставили себе оценку за урок? (В тетради выставляют оценку).
Домашнее задание. С.156-159.Составить кроссворд на тему «Землетрясение»
Вывод: Познакомились с понятием химическая реакция, условиями протекания реакций.
Говорят, если реакция свершается, То при этом осадок получается, или газ выделяется, или цвет изменяется, или звук появляется, или вещество нагревается. То есть органами чувств реакция определяется. На этом наш урок закончен.
Спасибо за внимание и участие.
Приложение №1.
-
-
Среди перечисленных явлений укажите физические и занесите их в левую часть таблицы, а явления, которые не относятся к физическим, занесите в правую часть таблицы: а) ржавление железа, б) горение свечи, в) плавление льда, г) плавление олова, е) испарение воды, ж) получение проволоки из бруска алюминия, з)скисание молока, и) горение спирта.
-
-
Физические явления
Химические реакции
в, г, е, ж
а, б, з, и
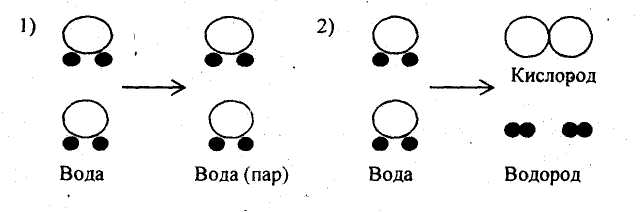
2.Определите по рисункам, где показана сущность физического явления. Подготовьте объяснение своего выбора устно.
Сравните обозначенные на рисунках процессы по плану:
-
-
Определите исходные вещества в первом и во втором процессах, назовите их.
-
Определите образовавшиеся вещества в обоих процессах, назовите их.
-
Ответьте на вопрос: в чём отличие второго процесса от первого?
-
Проанализируйте ваши ответы и определите, какой из процессов проходит с изменением состава вещества.
-
Приложение №2
ЗАДАНИЕ группы №1
Проведите предложенные химические реакции. Результаты наблюдений занесите в таблицу.
ОПЫТ №1: В пробирку к 1 мл раствора сульфата меди (II) прилейте небольшое количество раствора гидроксида натрия.
ОПЫТ №2: К полученному в первом опыте осадку гидроксида меди (II) прилейте 1 мл раствора серной кислоты.опыта
Признаки исходных веществ
Наблюдения (признаки реакции)
Признаки образовавшихся веществ
№1 CuSO4
NaOH
Прозрачный р-р голубого цвета
Прозрачный бесцветный р-р
выпадение осадка ↓
Раствор не прозрачный, образовался осадок голубого цвета
№2 Cu(OH)2
H2SO4
Осадок голубого цвета
Прозрачный бесцветный р-р
Растворение осадка
Прозрачный раствор голубого цвета
ЗАДАНИЕ группы №2
Проведите предложенные химические реакции. Результаты наблюдений занесите в таблицу:
ОПЫТ №1: В пробирку к кусочкам мрамора (мела) прилейте 2 мл раствора соляной кислоты.
ОПЫТ №2: В пробирку к 1 мл раствора гидроксида натрия добавить каплю фенолфталеина, затем прилить 1 мл раствора соляной кислоты.
опыта
Признаки исходных веществ
Наблюдения (признаки реакции)
Признаки образовавшихся веществ
№1 CаСO3
HCl
Кусочек мела
Прозрачный бесцветный р-р
Вскипание раствора,
выделение газа ↑
выделение пузырьков газа
Приложение №3
Классификация химических реакций по тепловому эффекту
ТЕПЛОВОЙ ЭФФЕКТ ХИМИЧЕСКОЙ РЕАКЦИИОБОЗНАЧАЕТСЯ
ПОКАЗЫВАЕТ
ИЗМЕРЯЕТСЯ
Q Дж/моль
КОЛИЧЕСТВО ТЕПЛОТЫ, КОТОРОЕ
ВЫДЕЛЯЕТСЯ ИЛИ ПОГЛОЩАЕТСЯ
В ХОДЕ ХИМИЧЕСКОЙ РЕАКЦИИ
+Q (экзотермическая)
- Q(эндотермическая)
Приложение 4
Слайд № 1 Извержение вулкана

Слайд №2 образование снежинок

Слайд №3 скисание молока

слайд №4 Салют над рекой

Слайд №5 утренняя роса выпала

Слайд №6 ложку «скрутило»

Слайд №7

Слайд №8 Загнивание яблока

Слайд № 9 погашение соды уксусом 
Слайд № 10 горение свечи

Слайд № 11

Слайд № 12 Горение дров

Слайд №13 Молния

Слайд № 14 Горение бенгальских огней

Слайд № 15 таяние снега, льда

Слайд №16
