- Учителю
- Конспект урока химии для 11 класса 'Свойства фосфора'.
Конспект урока химии для 11 класса 'Свойства фосфора'.
Класс: 9
Предмет: химия
УМК: программа, учебник авторской линии О.С.Габриеляна.
Тема урока: Фосфор. Соединение фосфора. Биологическая роль и применение в медицине.
Тип учебного занятия: урок «открытия» новых знаний и первичного закрепления полученных знаний.
Форма проведения занятия: урок-презентация с использованием интерактивной доски, виртуальное занятие для учащихся надомного обучения, или обучающихся дистанционно в форме экстерната.
Методы и приемы: наглядные, частично- поисковые, проблемного изложения.
Дидактическое сопровождение: компьютер, мультимедиапроектор, интерактивная доска, оборудование для дистанционного обучения (вебкамера, микрофон, колонки), программы для общения в сети Skype, ooVoo, выход в интернет на сайт http: // school.saripkro.ru в раздел «Профильное обучение школьников в дистанционной форме» на курс «Химия биогенных элементов», презентация; периодическая система химических элементов, химические реактивы
( красный фосфор, вода, лакмус), лабораторное оборудование.
Список использованной литературы:
-
Учебник О.С.Габриеляна « Химия- 9», изд.» Дрофа», 2012 год.
-
Габриелян О.С. Настольная книга учителя. Химия. 9 класс. - М.: Дрофа, 2002.
-
Уроки химии Кирилла и Мефодия. 8-9 класс. [Электронный носитель]. - М.: «Кирилл и Мефодий», 2002.
-
-
.
Данная разработка имеет большие возможности применения как в классно-урочной системе обучения, так и при обучении на дому с учащимися-инвалидами, имеющими ограниченные возможности, часто болеющими учениками, занимающимися по индивидуальному плану; ребятами, обучающимися в форме экстерната с использованием технологии дистанционного обучения. позволяет обеспечить доступ детей данной категории к образовательным и иным информационным ресурсам, оказать поддержку семьям, воспитывающим детей с нарушениями развития, способствует созданию безбарьерной среды для детей-инвалидов, получению ими качественного образования, расширению возможностей их последующей профессиональной занятости, как следствие, - их успешной социализации и интеграции в обществе.
Дистанционное обучение не исключает традиционное обучение на дому, а дополняет и обогащает его. Делает процесс обучения высокотехнологичным, творческим.
Дистанционное обучение является неотъемлемой частью работы с детьми, имеющих высокую мотивацию по предмету. Именно через дистанционное обучение (используя онлайн общение в Skype, ooVoo) можно осуществлять подготовку детей к олимпиадам разного уровня, к итоговой аттестации, вести консультации по сложным темам курса. Такая работа может проводиться в системе , что позволит осуществлять дифференцированный подход к каждому ученику, создать несколько вариантов изложения материала, выдавать задания по сложности в зависимости от текущего состояния знаний, а не один вариант из одного учебника. Обратная связь позволит учащемуся определить правильно ли усвоен материал, если нет, он может просмотреть дополнительные видеоролики по данной теме. Учащийся получает задания в виде лекций, презентаций, видеороликов, на которых разбирается учебный материал, затем проводится вэб- конференция по каждой теме, где разбираются непонятные вещи, преподаватель подключается к компьютеру ученика и помогает найти ошибку.
Данная разработка подходит не только для урока химии в 9 классе, но также может быть использована в элективном курсе по химии в старшей школе при профильном обучении, на занятиях предметного кружка по «Занимательной химии». Система с применением технологии дистанционного обучения позволяет ученику принимать активное участие в уроке. Если класс сельской школы имеет небольшое количество учащихся то можно поделить учащихся на группы по 1-2 учащихся. Так например в данном уроке ученик занимающийся дистанционно выполняет обязанности одной из групп и отчет о его работе учитель может увидеть на экране компьютера через функцию в программе Skype «поделиться» , или ooVoo «действия - трансляция экрана - ок» при этом учитель и ученики класса могут оценить работу.
Тема урока: Фосфор. Соединение фосфора. Биологическая роль и применение в медицине.
Цели урока:
Образовательная:
-
обеспечить усвоение учащимися знаний о фосфоре как о химическом элементе и простом веществе;
-
ознакомить учащихся с аллотропными модификациями фосфора;
-
повторить зависимость свойств вещества от его состава и строения;
-
продолжить совершенствование общеучебных умений и навыков: умение извлекать информацию при чтении или слушании текста;
-
способствовать формированию устойчивого интереса к изучаемому предмету, используя исторические хроники, презентации на уроке.
Развивающая:
-
продолжить развитие памяти, мышления, внимания учащихся;
-
развивать ключевые компетенции учащихся (информационная, коммуникативная, учебно-познавательная);
-
развивать интерес к предмету химия.
-
способствовать развитию познавательной деятельности учащихся при изучении данной темы;
-
способствовать развитию мышления при изучении и анализе данной темы;
-
сформировать умения обобщать, конкретизировать и делать выводы;
-
развивать самостоятельность добывания знаний.
Воспитательная:
-
способствовать формированию материалистического мировоззрения, продолжить формирование химической научной картины мира;
-
используя межпредметную связь с литературой, содействовать нравственному воспитанию школьников;
-
способствовать участию учащихся в дискуссии; осознанию учащимися значимости совместных действий в процессе обдумывания тех или иных вопросов;
-
способствовать формированию грамотного отношения к химическим процессам, протекающим в окружающем мире.
Тип учебного занятия: урок «открытия» новых знаний и первичного закрепления полученных знаний.
Методы и методические приемы:
-
словесные: рассказ, беседа.
-
наглядные: демонстрация презентации, демонстрация опытов.
Формы организации:
Индивидуальная, групповая, химический эксперимент
Оборудование и средства обучения:
Реактивы и оборудование в видеофрагменте на диске: бертолетова соль, фосфор красный, стеклянная палочка, спиртовка, спички, вата, пробирка, пробиркодержатель.
Мультимедийный проектор, компьютер, презентация Power Point.
Раздаточный материал: периодическая система химических элементов Д.И.Менделеева, таблица «Физические свойства аллотропных модификаций фосфора», коллекция природных материалов, образцы фосфорных удобрений;
Ход урока
1. Организационный момент
-
Здравствуйте, ребята! Посмотрите, какое ясное солнышко за окном, как природа радуется ему. Улыбнитесь друг другу, пусть урок пройдет организованно, весело, с пользой. Удачи вам, новых знаний.
2. Мотивация учащихся
Эпиграфом к сегодняшнему уроку станут слова из стихотворения-загадки. Попробуйте угадать, о чем идет речь?
То я камень философский,
То огонь холодный я,
То цвет белый, красный, черный представляю я,
А в России появился, светоносцем объявился.
-
Ребята, какой большой раздел химии мы с вами изучали на предыдущих уроках?
-
Да, правильно раздел неорганической химии, а именно элементы пятой группы главной подгруппы ПСХЭ Д. И. Менделеева.
3. Стадия вызова
-
Но о каком элементе сегодня, на нашем урока мы будем говорить?
Учитель зачитывает отрывок из романа А.Конан-Дойля «Собака Баскервилей».
«...Да! Это была собака, огромная, черная, как смоль. Но такой собаки еще никто из нас, смертных не видывал. Из ее отверстной пасти вырывалось пламя, глаза метали искры. По морде и загривку переливался мерцающий огонь. Ни в чьем воспаленном мозгу не могло возникнуть видение более страшное, более омерзительное, чем это адское существо, выскочившее на нас из тумана… Страшный пес, величиной с молодую львицу. Его огромная пасть все еще светилась голубоватым пламенем, глубоко сидящие дикие глаза были обведены огненными кругами. Я дотронулся до этой светящейся головы и, отняв руку, увидел, что мои пальцы тоже засветились в темноте. Фосфор, - сказал я».
Выпросы:
-
Из какого произведения этот отрывок?
-
Но могло ли быть такое в действительности?
-
А обладает ли фосфор такими свойствами выясним на уроке, прав ли был А.Конан-Дойл?
Выясним сегодня на уроке.
Эпиграф урока. Жизнь учит только тех, кто её изучает", и это не случайно.
Вы ещё раз убедитесь, что те вещества, о которых будет идти речь в данной теме, очень важны в жизни растений и животных, в необходимости изучения свойств этих веществ и действия их на организм.
4. Целепологание.
Итак, тема урока определена «Фосфор. Соединение фосфора. Биологическая роль и применение в медицине».
Откройте тетради, запишите число и тему нашего урока.
- Ребята, а как вы думаете, что должны сегодня узнать по этой теме?
5. Определение целей урока.
Прежде, чем приступить к изучению нового материала, заполните таблицу (ЗУХ).
Что мы знаем о фосфоре?
Что мы узнали?
Что мы хотим узнать?
1.
2.
3.
6. Стадия осмысления материала
Учащимся предлагается разделится на группы. Каждая группа выполняет работу по созданию кластера (опорного конспекта-схемы). Итогом работы всех групп будет создания общего печатного или электронного кластера по теме урока.
Первая группа работает с текстом «История открытия фосфора. Нахождение фосфора в природе». (см. Приложение 1).
Вторая группа «Фосфор как химический элемент». (см. опорную схему и заполните её).
Третья группа «Физические свойства фосфора. Аллотропные модификации фосфора». (работа по презентации «Фосфор» в оболочке дистанционного курса «Химия биогенных элементов» Слайд № 5,6,7).
Четвертая группа «Химические свойства и получение фосфора» (работа по презентации «Фосфор» в оболочке дистанционного курса «Химия биогенных элементов» Слайд № 8,9,10,11,12,13,14,15,16).
Пятая группа «Применение фосфора». (работа по презентации «Фосфор» в оболочке дистанционного курса «Химия биогенных элементов» Слайд № 17).
-
Разноуровневая работа.
Учащиеся работают с текстами, презентацией ,обсуждают информацию в группах, разрабатывают план выступления , презентуют материал.
Во время выступления представителей других групп, остальные учащиеся кратно ведут
записи в технологической карте урока.
Приложение 1.
«История открытия фосфора. Нахождение фосфора в природе».
История открытия фосфора.
Фосфор открывали несколько раз. Причем всякий раз получали его из … мочи. Есть упоминания о том, что первооткрывателем фосфора был арабский алхимик Альхильд Бехиль (XII век), перегонявший мочу с глиной, известью и углем. Но все же годом открытия фосфора считается 1669-й.
Гамбургский алхимик-любитель Хеннинг Бранд, разорившийся купец, хотел с помощью алхимии поправить свои дела и в поисках проводил опыты с разными веществами. Он собрал около тонны мочи из солдатских казарм, выпарил, затем перегнал до образования твердого остатка, при нагревании которого образовалось вещество, ярко светившееся в темноте. Бранд назвал его фосфором, что в переводе с греческого означает "светоносец". Способ получения фосфора держался в секрете. В результате развернувшейся «фосфорной лихорадки» Бранд продает секрет дрезденскому алхимику Крафту, который изготовив большое количество фосфора, отправился по Европе, где демонстрируя его свойства перед богатыми, извлекал большую выгоду. Выведав у Крафта секрет получения фосфора, английский химик Роберт Бойль начал изучать свойства элемента. И уже скоро пришел к открытию фосфорной кислоты и фосфористого водорода. В третий раз фосфор открыл Р.Бойль в 1680 году.
Нахождение в природе
Общее содержание фосфора в земной коре составляет 0,08 %. В природе фосфор встречается только в виде соединений. Важнейшее из них - фосфат кальция - минерал апатит. Известно много разновидностей апатита, из которых наиболее распространен фторапатит 3Ca3(PO4)2 * CаF2. Разновидности апатита слагают осадочные горные породы - фосфориты. Фосфор входит также в состав белковых веществ в виде различных соединений. Содержание фосфора в тканях мозга составляет 0,38 %, в мышцах - 0,270 %. Фосфор необходим для жизни растений, поэтому почва всегда должна содержать достаточное количество соединений фосфора.
В растениях фосфор сосредотачивается главным образом в семенах и плодах, в организме животных, птиц и рыб - в скелете и нервной ткани. В среднем тело человека содержится около 1,5 кг фосфора, из которых около 1,4 кг приходится на кости. Если бы фосфор исчез из костей, наше тело превратилось бы в бесформенные массы. Если бы фосфор исчез из мышц, мы утратили бы способность двигаться, из нервной ткани - мы перестали бы мыслить.
Приложение 2
Строение атома фосфора
Для работы используйте схему:
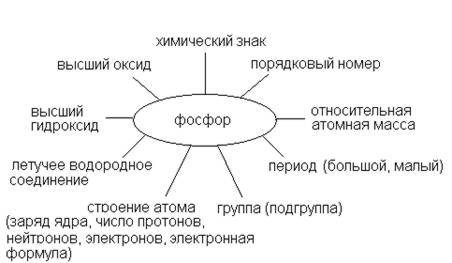
- Составьте схему строения атома фосфора, сделайте вывод о проявлении свойств.
- Определите возможные степени окисления фосфора в соединениях.
- Составьте формулу летучего водородного соединения, высшего оксида и гидроксида, расставьте степени окисления.
Приложение 3.
Физические свойства
- Для простого вещества фосфора характерно явление аллотропии. Дайте определение аллотропной модификации.
Таблица «Аллотропные модификации фосфора»
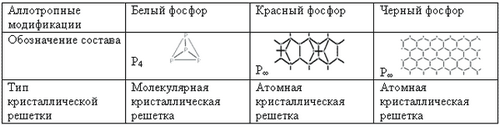
- Какой тип кристаллической решетки у белого, красного и черного фосфора?
Молекула белого фосфора состоит из 4 атомов, построенных в форме тетраэдра, красный фосфор имеет атомную кристаллическую решетку с довольно сложным строением, черный фосфор - полимерное вещество с атомной кристаллической решеткой.
- Как вы думаете из одного аллотропного видоизменения фосфора можно получить другое? (ответы учащихся ).
Демонстрационный опыт. Получение белого фосфора из красного
(демонстрация опыта с помощью диска виртуальная лаборатория )
Красный фосфор (количество с полгорошины) поместить в пробирку, вставить стеклянную палочку, закрыть тампоном, нагреть. Образуется белый дым оксида фосфора, затем - желтоватые капли белого фосфора. Извлечь стеклянную палочку, белый фосфор самовозгорается.
-
Какова температура воспламенения белого фосфора?
-
Прав ли был А.Конан-Дойль в описании сюжета с собакой Баскервилей?
-
Какой вывод можем сделать о невозможности использования белого фосфора?
Белый фосфор самовозгорается на воздухе. Кроме того, процесс окисления катализируется органическим веществом, в частности, шерстью. Поэтому собака Баскервилей не могла быть окрашена белым фосфором.
-
Каково физиологическое действие белого фосфора?
Доза фосфора в 0,05-0,15 г для человека смертельна. Профессиональное заболевание рабочих спичечных фабрик был фосфорный некроз - поражение челюстей. Белый фосфор не только сильный яд, при попадании на кожу вызывает долго не заживающие ожоги.
-
Сравните физические свойства аллотропных видоизменений фосфора (самостоятельная работа учащихся с таблицей)
-
Сходны ли свойства белого, красного и черного фосфора?
-
Чем объясняются различия в свойствах?
Химические свойства
Фосфор проявляет и окислительные, и восстановительные свойства.
+ 3e - 5e
P-3---------------------P0 ------------------- P+5(P+3)
окислитель восстановитель
восстанавливается окисляется
А) Взаимодействие с простыми веществами.
Фосфор легко окисляется кислородом.
Учащиеся самостоятельно записывают уравнения химических реакций, расставляют коэффициенты методом электронного баланса, указывают окислитель и восстановитель. А затем проверяют выполненные действия по шаблону заранее заготовленному на интерактивной доске.
4P + 5O2 --> 2P2O5 (с избытком кислорода)
4P + 3O2 --> 2P2O3 (при медленном окислении или при недостатке О2).
Фосфор взаимодействует с металлами как окислитель, образует фосфиды:
2P + 3Ca --> Ca3P2, 2P + 3Mg --> Mg3P22.
с неметаллами как восстановитель:
2P + 3S --> P2S3,
2P + 3Cl2 --> 2PCl3.
В) Взаимодействие со сложными веществами:
4Р + 6Н2О --> РН3 + 3Н3РО2 (фосфорная кислота)
4Р + 3KOH + 3Н2О --> РН3 + 3KН2РО2.
2 P +2NaOH +H2O-->Na2HPO3+PH3
Сильные окислители превращают фосфор в фосфорную кислоту:
3P + 5HNO3 + 2H2O --> 3H3PO4 + 5NO;
2P + 5H2SO4 --> 2H3PO4 + 5SO2 + 2H2O.
Реакция окисления также происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
6P + 5KClO3 --> 5KCl + 3P2O5
Смеси с бертолетовой солью от удара взрываются, воспламеняются. Эта реакция происходит, когда мы зажигаем спички. В головке спички содержится бертолетова соль, в намазке шкурки - красный фосфор.
Получение
Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре 1600°С:
Минутка здоровья (снятие напряжения с глаз)
Применение
Большинство (80-90%) добываемой фосфатной руды идет на получение удобрений. В 1799 году было доказано, что фосфор необходим для нормальной жизнедеятельности растений. Накапливаясь в биомассе, фосфор исчезает из почвы. Ежегодно мировой урожай уносит с полей несколько миллионов тонн фосфора, наряду с азотом и калием, поэтому необходимо возобновление его ресурсов в плодородном слое. В древние времена люди удобряли почву навозом, костями и гуано. Первое искусственное фосфорное удобрение - суперфосфат было получено в Англии в 1839 году, а в 1842 году там же было организовано его первое промышленное производство. В России первое предприятие по производству суперфосфата появилось в 1868 году. Сейчас его получают, обрабатывая апатит серной кислотой.
Более ценный продукт - двойной суперфосфат, так как в нем содержится в три раза больше фосфора по массе, его получают обработкой апатита фосфорной кислотой:
Доля производства удобрений, содержащих в своем составе только один фосфор, падает, и все больше производится комплексных удобрений, содержащих два или три питательных элемента. Большая часть фосфорных удобрений, производимых в России, приходится на аммофос, диаммофос и азофоску. Ежегодное мировое производство фосфорных удобрений на начало 21 в. составило 41 млн. тонн, а суммарное количество всех удобрений - 190 млн. тонн. Основными производителями фосфорных удобрений являются Марокко, США и Россия, а основными потребителями - страны Азии, Латинской Америки и Западной Европы.
Фосфор является важнейшим биогенным элементом и в то же время находит очень широкое применение в промышленности. Красный фосфор применяют в производстве спичек. Его вместе с тонко измельчённым стеклом и клеем наносят на боковую поверхность коробка. При трении спичечной головки, в состав который входят хлорат калия и сера, происходит воспламенение.
Фосфор - элемент не только биологической жизни, но и повседневной, действительно, фосфорсодержащие соединения используются в сельском хозяйстве, медицине, фармакологии, научных исследованиях, пищевой и химической промышленности, строительстве, металлургии, технике и, наконец, в повседневном быту. Такая ситуация была не всегда, и на протяжении долгого времени после открытия Бранда фосфор оказывался замешанным во многих скверных историях, все началось со спекуляций самого Бранда и его последователей. Далее "таинственные" вспыхивающие надписи на стенах в храмах и "чудо самовоспламенения свечей". Долгое время бытовали предрассудки и суеверия, связанные с "блуждающими" огнями, возникающими иногда над болотами и являющимися следствием самовоспламенения фосфина.
Минутка здоровья (танцевальная физминутка на расслабление мышц)
8. Актуализация знаний.
Игра «Редактор»
-
А сейчас я каждому из вас предлагаю побыть в роли редактора.
-
Что означает это слово? (Тот, кто обрабатывает и готовит текст к печати или оформляет издание.)
-
Иногда при создании художественных произведений как мы сегодня убедились, авторы допускают ошибки или специально придумывают захватывающий фантастический сюжет.
Но вам сейчас предстоит отредактировать статью для печати. Перед вами статья. Исследуйте её. Найдите ошибки? Исправьте их. Измените предложения, запишите правильные варианты.
-
Объясните, что нужно помнить, чтобы не допускать таких ошибок? (Знать свойства химических элементов.)
-
Будьте внимательны и избегайте подобных ошибок!
-
Фосфор - неметалл.
-
Электронная формула фосфора 3s23p3.
-
Фосфор имеет пять аллотропных модификаций.
-
Красный фосфор самовоспламеняется на воздухе.
-
Фосфор обладает окислительными и воссстановительными свойствами.
-
В промышленности фосфор получают из фосфоритов и апатитов, нагревая их в электрической печи без доступа воздуха в присутствии оксида кремния (IV) и угля.
-
Белый фосфор не ядовит.
-
В смеси с бертолетовой солью красный фосфор от удара взрывается.
-
Чёрный фосфор - полимерное вещество с металлическим блеском, похожее на графит, без запаха, жирное на ощупь.
9. Закрепление материала
Фронтальный опрос:
- Отрывок из какой книги прозвучал в начале урока? Кто автор?
- Каковы аллотропные модификации фосфора?
- С какими физическими свойствами фосфора мы познакомились?
- Перечислите химические свойства фосфора.
- Какие области применения имеет фосфор?
А теперь я предлагаю вам перенестись на корабль. Кто самый главный человек на корабле? (капитан)
Я предлагаю сегодня побыть в роли капитана одному ученику из каждой группы, который представит нам результаты всей команды.
А кто помогает капитану? (боцман)
Попрошу в роли боцмана сегодня побыть ученика, который выполнял в группе функции помощника капитана и представит нам письменный вариант мини-кластера своей команды. Итак, перед вами на доске или экране интерактивной доски (если выбран вариант электронного кластера) демонстрируются отчеты каждой творческой группы.
Все остальные - матросы - работают самостоятельно в тетрадях.
Предлагаю вернуться к таблице «ЗУХ» и заполнить 2 и 3 столбцы.
Взаимопроверка.
-
Проверьте друг у друга тесты, поставьте оценки (по шаблону).Посмотрите на свои оценочные листы, проанализируйте их. -Какую оценку за урок вы бы поставили себе и почему?
10. Заключение. Подведение итогов урока. Обобщающее слово учителя.
-
Сегодня мы постарались вспомнить все о фосфоре.
-
Что вам понравилось, запомнилось на уроке?
-Что нового вы узнали на уроке?
-Что из пройденного материала удалось усвоить лучше всего? -Какие из свойств вы бы хотели еще повторить?
11. Итоговая рефлексия.
-
Ребята, проанализировав сейчас свои умения, вы имеете дома возможность устранить пробелы в ваших знаниях, продолжить дома подготовку к следующему уроку. Надеюсь, что вам было комфортно работать сегодня на уроке, и вы получили удовлетворение от результативности урока.
-
Отражая своё самочувствие в конце урока, отметьте ваше настроение. Смайлики дорисуйте улыбку , с приподнятыми уголками губ вверх, если вам понравился наш урок, если не понравился уголки губ вниз.
Выставление оценок.
Домашнее задание.
-
Обязательное задание: Изучить текст учебника по теме "Фосфор". Выполнить интерактивный онлайн тест в дистанционном курсе.
-
Задание по выбору:
-
Написать эссе на тему: «Фосфор - элемент жизни и мысли».
-
Составьте кроссворд на тему «Фосфор».
Дети сами выбирают себе задание на дом.
Спасибо всем за работу.
Приложение 4.
Таблица «Физические свойства белого, красного и черного фосфора»
Характеристика вещества
Свойства белого фосфора
Свойства красного фосфора
Свойства черного фосфора
Физическое состояние
Кристаллическое вещество
Порошкообразное вещество
Похож на графит, жирное на ощупь
твердость
Небольшая, можно резать ножом (под водой)
-
-
цвет
Бесцветный с желтоватым оттенком
Темно-красный
черный
запах
чесночный
Без запаха
-
Плотность (в Г/см3)
1,8
2,3
-
Растворимость в воде
Не растворяется
Не растворяется
Не растворяется
Растворимость в сероуглероде
Хорошо растворяется
Не растворяется
Не растворяется
Температура плавления
44oС
При сильном нагревании превращается в пары белого фосфора
-
Температура воспламенения
40oС, в измельченном состоянии воспламеняется при обычной температуре
260oС
490oС
свечение
Светится в темноте
Не светится
Не светится
Действие на организм
Сильный яд
Не ядовит
Не ядовит
Приложение 5.
Занятие 3 в курсе дистанционного обучения.
Тема: Фосфор. Соединение фосфора. Биологическая роль и применение в медицине.
На этом занятии Вы должны изучить следующие вопросы:
-
Положение фосфора в Периодической системе химических элементов Д.И. Менделеева
-
Строение атома фосфора
Физические их химические свойства фосфора -
Физиологическое значение фосфора
В результате Вы должны научиться:
-
Давать характеристику атома фосфора по его положению в Периодической системе химических элементов Д.И. Менделеева
-
Составлять уравнения реакций, характеризующих химические свойства фосфора
-
Объяснять роль фосфора в обмене веществ
Для этого:
-
Изучите материалы, предлагаемые в файле .
-
Познакомьтесь с .
-
Дайте характеристику фосфору по его положению в периодической системе и с точки зрения теории о строении атома, а также рассмотрите валентные возможности фосфора и азота;
-
Файл с выполненным заданием отправьте преподавателю;
-
Выполните ;
-
Если у Вас возникли вопросы, то Вы их можете задать преподавателю в форуме
Лекция 8
Фосфор и его соединения
Название фосфора происходит от греч. Phosphorus (несущий свет). Впервые был получен гамбургским алхимиком Г. Брандом в 1669 г. Позднее Либих установил, что фосфор имеет огромное значение для жизнедеятельности растений. Это распространенный элемент, содержание его в земной коре примерно 0,1%. В свободном виде фосфор в природе не существует, а встречается только в связанном состоянии.
Фосфор образует несколько аллотропных модификаций. Главные из них - белый, красный и черный фосфор.
Белый фосфор - ядовитое, бесцветное твердое кристаллическое соединение, плохо нерастворимое в воде. Плавится при температуре 44C, превращаясь в бесцветную жидкость. Белый фосфор химически очень активен из-за неустойчивости молекулы P4. Если нагревать белый фосфор без доступа воздуха, он превращается в красный фосфор.
Красный фосфор по своим свойствам сильно отличается от белого фосфора. Он ядовит, не растворяется ни в чем. При охлаждении его паров образуется белый фосфор. Красный фосфор используется главным образом в производстве спичек, ядохимикатов.
Черный фосфор образуется из красного при нагревании его до 350C под высоким давлением.
Химические свойства фосфора
На воздухе фосфор сгорает, образуя оксид фосфора (V) - фосфорный ангидрид:
4Р + 5O2 = 2P2O5
При взаимодействии со щелочами образуется фосфин PH3:
2Р + 2NaOH + H2O = Na2HPO3 + PH3
Фосфин - это бесцветный ядовитый газ с запахом чеснока, аналог аммиака, однако, в отличие от него очень неустойчив и при непосредственном взаимодействии фосфора с водородом не образуется. Используется как боевое отравляющее вещество.
Азотная кислота окисляет фосфор до фосфорной кислоты:
3Р + 5HNO3 + 2H2O = 3H3PO4 + 5NO
В атмосфере хлора фосфор горит, со фтором реагирует со взрывом, с серой фосфор образует сульфиды различного состава, с металлами при нагревании - фосфиды.
2P + 5Cl2 → 2PCl5
2P + 3Cl2 → 2PCl3
3Ca + 2P → Ca3P2
Смесь красного фосфора с бертолетовой солью очень взрывоопасна:
6Р + 5КС1О3 = 5КС1 + ЗР2О5
Чистый фосфор получают восстановлением фосфоритов и апатитов коксом в присутствии песка в электропечах при 1500C:
Ca3(PO4)2 + 5C+ 3SiO2 = 3CaSiO3 + 5CO + 2P
Оксиды фосфора
Фосфор образует два оксида: P2O3 и P2O5. Оксид фосфора (V) или фосфорный ангидрид - белое кристаллическое вещество. Реальный состав молекулы оксида фосфора (V) соответствует формуле Р2О10, хотя на практике для простоты формулу оксида фосфора (V) упрощенно записывают как P2O5. Фосфорный ангидрид жадно поглощает воду, при этом в зависимости от соотношения числа молекул воды и оксида фосфора (V) P2O5 образуется несколько типов фосфорных кислот: мета- и ортофосфорная, дифосфорная, а также большая группа полифосфорных кислот. Сила полифосфорных кислот возрастает с увеличением числа атомов фосфора.
При взаимодействии P2O5 с водой при обычных условиях получается метафосфорная кислота НРО3:
P4O10 + 2Н2O = 4НРO3
При нагревании водного раствора метафосфорной кислоты образуется ортофосфорная кислота:
HPO3 + H2O = H3PO4
Оксид фосфора (III) по аналогии с оксидом фосфора (V) образует молекулы P4O6. С водой образует фосфористые кислоты. Их соли называются фосфитами. Ортофосфористая кислота Н3РО3 - слабая двухосновная кислота, сильный восстановитель. Ее особенность - только два атома водорода способны замещаться на металл. При нагревании ее в водном растворе выделяется водород:
H3PO3 + H2O = H3PO4 + H2
Фосфорная кислота
Ортофосфорная или фосфорная кислота - трехосновная кислота средней силы. Ее диссоциация в водных растворах протекает в три ступени. Фосфорная кислота не летуча и устойчива, для нее не характерны окислительные свойства. Поэтому она реагирует только с металлами, расположенными в ряду напряжений левее водорода. От других фосфорных кислот ее можно отличить по характерной реакции с нитратом серебра: выделяется осадок Ag3PO4 желтого цвета. Фосфорная кислота образует три вида солей: дигидрофосфаты, гидрофосфаты и фосфаты.
Соли фосфорной кислоты используются в медицине, а также как удобрения. Соответственно, ортофосфорная кислота крайне важна в производстве удобрений.
В лаборатории фосфорную кислоту получают окислением фосфора азотной кислотой, в промышленности - окислением фосфора при нагревании и далее поглощением оксида фосфора (V) водой:
4Р + 5O2 = 2P2O5
P2O5 + Н2O = 2НРO3
Физиологическая роль фосфора
Фосфор в больших количествах присутствует во многих пищевых продуктах (молоко, мясо, рыба, хлеб, овощи, яйца). Большая часть потребленного с пищей фосфора всасывается в проксимальном отделе тонкого кишечника.
Содержание фосфора в теле взрослого человека около 1 % ( примерно 700 г на 70 кг массы тела). Суточная потребность человека в фосфоре составляет 1,3 г.
В организме основное количество фосфора содержится в костях (около 85 %), много фосфора в мышцах и нервной ткани. Вместе с кальцием, фтором и хлором фосфор формирует зубную эмаль. В организме человека около 14 % фосфора содержат внутриклеточные компоненты мягких тканей и только 1 % находится в внеклеточной жидкости. Из организма фосфор выводится с мочой и калом.
Значение фосфора для организма человека огромно. Фосфор находится в биосредах в виде фосфат-иона, который входит в состав неорганических компонентов и органических биомолекул. Фосфор присутствует во всех тканях, входит в состав белков, нуклеиновых кислот, нуклеотидов, фосфолипидов. Соединения фосфора AДФ и АТФ являются универсальным источником энергии для всех живых клеток. Значительная часть энергии, образующася при распаде углеводов и других соединений, аккумулируется в богатых энергией органических соединениях фосфорной кислоты. Растворимые соли фосфорной кислоты формируют фосфатную буферную систему, ответственную за постоянство кислотно-щелочного равновесия внутриклеточной жидкости. Труднорастворимые (кальциевые) соли фосфорной кислоты составляют минеральную основу костной и зубной ткани. Фосфор играет важную роль в деятельности головного мозга, сердца, мышечной ткани.
Приложение 6.
Предлагаемые темы.
Первая группа работает с текстом «История открытия фосфора. Нахождение фосфора в природе». (см. Приложение 1).
Вторая группа «Фосфор как химический элемент». (см. опорную схему и заполните её).
Третья группа «Физические свойства фосфора. Аллотропные модификации фосфора». (работа по презентации «Фосфор» в оболочке дистанционного курса «Химия биогенных элементов» Слайд № 5,6,7).
Четвертая группа «Химические свойства и получение фосфора» (работа по презентации «Фосфор» в оболочке дистанционного курса «Химия биогенных элементов» Слайд № 8,9,10,11,12,13,14,15,16).
Пятая группа «Применение фосфора». (работа по презентации «Фосфор» в оболочке дистанционного курса «Химия биогенных элементов» Слайд № 17).
Группа №1
Ф.И ученика
Обязанность в группе
Оценка за работу над проектом
учащихся
учителя
1.
2.
3.
4.
Группа №2
Ф.И ученика
Обязанность в группе
Оценка за работу над проектом
учащихся
учителя
1.
2.
3.
4.
Группа №3
Ф.И ученика
Обязанность в группе
Оценка за работу над проектом
учащихся
учителя
1.
2.
3.
4.
Группа № 4
Ф.И ученика
Обязанность в группе
Оценка за работу над проектом
учащихся
учителя
1.
2.
3.
4.
Группа№5
Ф.И ученика
Обязанность в группе
Оценка за работу над проектом
учащихся
учителя
1.
2.
3.
4.
Приложение 7.
Технологическая карта
Учащегося________ класса
_____________________________
( Фамилия, имя)
Дата: ________
Тема урока: _____________________________________________
Что мы знаем о фосфоре?
Что мы узнали?
Что мы хотим узнать?
1.
2.
3.
История открытия . Нахождение в природе.
Характеристика фосфора:
Положение в П.С: группа________, период_________.
Cхема строения атома 1s_________
Аллотропные модификации фосфора:
Сравнение физических свойств красного и белого фосфора
Параметры сравнения
Красный фосфор
Белый фосфор
Химические свойства фосфора:
как восстановитель
как окислитель
с о сложными веществами
о сложными веществами
Применение фосфора: