- Учителю
- Конспект урока по химии на тему Закон сохранения массы веществ. Закон постоянства состава веществ. Вещества молекулярного и немолекулярного строения 11 класс
Конспект урока по химии на тему Закон сохранения массы веществ. Закон постоянства состава веществ. Вещества молекулярного и немолекулярного строения 11 класс
Урок № 2
Тема: «Закон сохранения массы веществ. Закон постоянства состава веществ. Вещества молекулярного и немолекулярного строения».
Цель: повторить основные законы стехиометрии - закон сохранения массы веществ и закон постоянства состава веществ.
Задачи:
Образовательные:
-
Углубить знания учащихся о законе сохранения массы веществ, дать краткие сведения об истории открытия закона и научной деятельности ученых в этой области, рассмотреть значимость этого закона в химии.
-
Повторить закон постоянства состава веществ и научить применять для решения задач.
Развивающие:
-
Развивать познавательный интерес к предмету.
-
Создать условия для овладения приемами изучения состава веществ.
-
Формировать умение проводить поиск, обработку и систематизацию информации.
Воспитательные:
-
Воспитывать толерантные отношения в группе, классе.
Тип урока: изучение нового материала.
Методы: словесный, наглядный, практический.
Ход урока:
-
Орг.момент.
Взаимное приветствие, проверка готовности к уроку, отметка отсутствующих.
-
Проверка домашнего задания.
Стр.6
-
22 протона содержит ядро атома Титана, так как порядковый номер его 22.
-
Речь идет о Железе. Порядковый номер 26, электронов 26, нейтронов 30. 26 56Fe.
-
Атом урана: протонов - 92, нейтронов 143; атом калия: протонов - 19, нейтронов- 22, атом стронция: протонов 38, нейтронов - 52.
-
Актуализация опорных знаний. Вводный контроль знаний.
Дайте ответы на следующие вопросы:
-
Что называется химическими реакциями? Химическими реакциями называются явления, при которых одни вещества, обладающие определенным составом и свойствами, превращаются в другие вещества - с другим составом и другими свойствами. При этом в составе атомных ядер изменений не происходит.
-
Что называется реагентами и продуктами реакции? Продукты реакции - это те вещества, которые получаются в результате реакции.
Соответственно, реагенты - вещества, вступающие в реакцию.
-
Что называют химическим уравнением? Химическим уравнением (уравнением химической реакции) называют условную запись химической реакции с помощью химических формул, числовых коэффициентов и математических символов.
-
Что показывают коэффициенты в уравнении химической реакции? Коэффициенты в уравнении химической реакции показывают не только число молекул каждого вещества, но и соотношение количеств веществ, участвующих в реакции.
4.Изучение нового материала.
Давайте рассмотрим реакции между метаном и кислородом. В этой реакции метан и кислород - реагенты, а диоксид углерода и вода - продукты.
СН4 + 2О2 = СО2 + 2Н2О
Изготовим пластилиновые модельки реагентов, похожие на те, что изображены на рисунке:
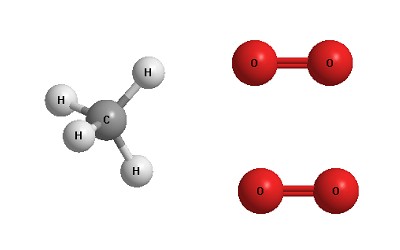
Получатся модельки одной молекулы метана и двух молекул кислорода. Мы можем разобрать эти модельки на отдельные "атомы" и тут же собрать из них модельки продуктов. Для этого нам не потребуется никаких других деталей - только те атомы, которые мы взяли из одной "молекулы" метана и двух "молекул" кислорода.
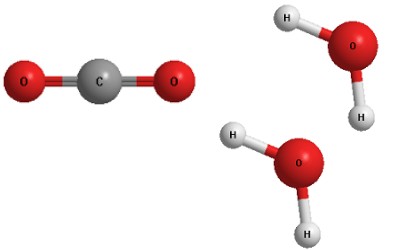
Разумеется, масса всех пластилиновых "атомов" при этом не изменилась, хотя перед нами теперь лежат уже совсем другие "молекулы" - диоксида углерода и воды.
Этот простой опыт иллюстрирует один из важнейших законов природы - ЗАКОН СОХРАНЕНИЯ МАССЫ. Новые вещества не получаются из ничего и не могут обратиться в ничто. Масса (вес) реагентов всегда в точности равна массе (весу) продуктов химической реакции. Этот фундаментальный закон впервые открыл русский ученый М.В.Ломоносов. Немного позже французский химик А.Лавуазье пришел к тем же выводам и независимо от Ломоносова сформулировал тот же закон.
Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции
Когда мы разбирали пластилиновые модельки реагентов СН4 и О2, чтобы собрать модельки продуктов СО2 и Н2О, нам не потребовалось что-либо изменять в атомах. Разве что самую малость: к атому углерода в молекуле СО2 атомы кислорода прикрепляются не так, как до этого прикреплялись атомы водорода.
Значит, изменения коснулись только "внешней поверхности" атома. Там, как мы знаем, в настоящем атоме находится валентная электронная оболочка. Точно так же в химических реакциях изменения касаются только внешних электронов, а вся внутренняя "начинка" атома, находящаяся под его валентной оболочкой, остается неизменной.
Задача: Аэронавты погрузили на воздушный шар 2 кг продуктов и отправились в полет. Как изменилась масса воздушного шара с аэронавтами после того, как все продукты были съедены?
Работа в группах. А сейчас я предлагаю Вам небольшие задачи. Обсудите их в группах и через минуту докажите справедливость закона сохранения массы.
1 группа
Масса золы, полученной при сжигании дров гораздо меньше массы исходных веществ. Объясните, не противоречит ли этот факт закону сохранения массы веществ?
Дополнительная информация!
При сжигании дров органические вещества, входящие в состав дерева превращаются в водяной пар и углекислый газ.
2 группа
Горящая свеча тает, оставляя лишь маленькую лужицу парафина. Объясните, не противоречит ли это закону сохранения массы веществ.
Дополнительная информация!
При горении парафина образуются летучие водяные пары и углекислый газ.
3 группа
Объясните, не противоречит ли закону сохранения массы веществ, что масса проржавевшего ведра может оказаться больше, чем масса такого же нового ведра?
Дополнительная информация!
Ржавчина образуется при взаимодействии железа с кислородом воздуха и влагой.
4 группа
Можно ли при сжигании 100 кг угля (С) получить углекислого газа (СО2) больше, чем 100 кг? За счет чего масса углекислого газа больше массы использованного угля?
Дополнительная информация!
При горении вещества присоединяют кислород.
Закон постоянства состава веществ был открыт французским ученым Прустом в 1808 г. Вот как этот закон звучал в его изложении: «От одного полюса Земли до другого соединения имеют одинаковый состав и одинаковые свойства. Никакой разницы нет между оксидом железа из Южного полушария и Северного. Малахит из Сибири имеет тот же состав, как и малахит из Испании. Во всем мире есть лишь одна киноварь».
Современная формулировка закона: каждое химически чистое вещество с молекулярным строением независимо от места нахождения и способа получения имеет один и тот же постоянный качественный и количественный состав.
А сейчас послушайте выступление о знаменитом
споре между французскими учеными Ж.Л.Прустом и К.Л.Бертолле,
который длился около 10 лет на страницах французских журналов в
начале XIX в.
Да, спор двух французских химиков длился с 1799 по 1809 г., а затем
был продолжен химиками Англии, Швеции, Италии, России и других
стран. Этот спор можно с полным правом назвать первой научной
дискуссией такого масштаба и по времени возникновения, и по
стратегической важности обсуждаемых проблем. Эта дискуссия
определила пути развития химии на столетия вперед.
В 1799 г. профессор Королевской лаборатории в Мадриде,
француз по происхождению, Жозеф Луи Пруст опубликовал статью
«Исследования меди». В статье подробно освещены анализы соединений
меди и сделан вполне обоснованный вывод, что химически
индивидуальное соединение всегда, независимо от способа его
образования, обладает постоянным составом. К такому же выводу Пруст
пришел и позже, в 1800-1806 гг., исследуя химические соединения
свинца, кобальта и других металлов.
В 1800-1803 гг. английский химик Джон Дальтон обосновал этот закон
теоретически, установив атомное строение молекул и наличие
определенных атомных масс элементов. Чисто теоретически Дальтон
пришел к открытию еще одного основного закона химии - закона
кратных отношений, находящегося в единстве с законом постоянства
состава.
В то же самое время профессор Нормальной школы в Париже Клод Луи
Бертолле, уже знаменитый химик, опубликовал ряд статей, в которых
отстаивал вывод о том, что состав химических соединений зависит от
способа их получения и часто бывает не постоянным, а переменным.
Бертолле выступил против законов Пруста и Дальтона, аргументируя
это все новыми и новыми опытами по получению сплавов, твердых
оксидов металлов. Он воспользовался и данными самого Пруста, указав
на то, что в природных сульфидах и оксидах металлов содержится
избыток серы и кислорода по сравнению с полученными в
лаборатории.
Развитие химии показало, что обе стороны были правы. Точка зрения
Пруста и Дальтона для химии 1800-х гг. была понятна, конкретна и
почти очевидна. Пруст и Дальтон заложили основы атомно-
молекулярного учения о составе и строении химических соединений.
Это была магистральная линия развития химии. Точка зрения Бертолле
была практически неприемлема для тогдашней химии, т. к. она
отражала химизм процессов, изучение которых началось в основном
лишь
с 1880-х гг. И только будущее показало, что и Бертолле был
прав!
По предложению академика Н.С.Курнакова вещества постоянного состава
были названы дальтонидами (в честь английского химика и физика
Дальтона), а вещества переменного состава - бертоллидами (в память
о французском химике Бертолле).
На основании этого закона состав веществ выражается химической формулой с помощью химических знаков и индексов. Например, Н2О, СН4, С2Н5ОН и т.п.
Закон постоянства состава справедлив для веществ молекулярного строения. Наряду с веществами, имеющими постоянный состав, существуют вещества переменного состава. К ним относятся соединения, в которых чередование нераздельных структурных единиц (атомов, ионов) осуществляется с нарушением периодичности.
В связи с наличием соединений переменного состава современная формулировка закона постоянства состава содержит уточнения:
Состав соединений молекулярного строения, то
есть состоящих из молекул, является постоянным независимо от
способа получения.
Состав же соединений с немолекулярной структурой (с атомной, ионной
и металлической решеткой) не является постоянным и зависит от
условий получения.
5. Выводы по уроку:
-
В чем сущность закона сохранения массы веществ?
Закон сохранения массы веществ заключается в том, что масса вступивших веществ в реакцию равна массе веществ образованных. -
Какое значение имеет закон сохранения массы веществ?
Слово учителя:
Уравнение реакции отражает материальный баланс вступивших в реакцию веществ (реагентов) и образовавшихся продуктов.
6. Закрепление.
-
Почему масса железной окалины больше массы железа? Какие вещества могут входить в состав окалины? (В состав окалины входят железо и кислород.)
-
Почему масса золы меньше массы сгоревшей древесины? (Углекислый газ, вода испаряются.)
-
Анализ уравнения реакции:
2Н2О → 2Н2 + О2
2*(1*2+16) = 2*2 + 2*16
7. Домашнее задание.
</ Параграф 2, упр 3-4.