- Учителю
- Конспект занятия 'Озон'
Конспект занятия 'Озон'
Разработала Кузьмина Светлана Анатольевна
Тема урока: Озон.
Цель: изучить состав, получение, свойства и значение озона, как аллотропной модификации кислорода.
Задачи:
А) Образовательные:
-
сформировать понятия: «аллотропия» и «аллотропные видоизменения» кислорода;
-
познакомить учащихся со свойствами озона и его влиянии на существование всего живого на земле.
Б) Развивающие:
-
продолжить развитие у учащихся умений работать в группе, считаться с мнением товарища и отстаивать свою точку зрения, анализировать, сравнивать, делать выводы.
В) Воспитательные:
-
воспитать стремление к саморазвитию;
-
формировать бережное отношение к природе и ответственность к здоровому и безопасному образу жизни.
Тип урока: изучение нового материала.
Оборудование: ватман, маркеры, дополнительный материал.
Ход урока:
-
Мотивационный момент.
Деление на команды: учитель перед уроком разрезает четыре высказывания на 5 частей (или в зависимости от количества детей) и раздает учащимся. Им необходимо их собрать и склеить. Так формируется команда.
Распределение ролей. Ученикам предлагается рассчитаться. 1номер - лидер команды, 2 - аналитик, 3 - художник, 4 - спикер, 5 - хранитель времени.
Высказывания:
-
Озон - активный кислород.
-
Озонатор - прибор для получения озона.
-
Озонотерапия - это высокоэффективный метод лечения.
-
16 сентября - международный день охраны озонового слоя.
-
Изучение нового материала.
Вопрос: что общего в этих высказываниях?
Предполагаемый ответ: речь идет о веществе озоне.
Тема урока: Озон.
Задание: Исходя из высказываний, определите, что должна изучить каждая группа.
Учащиеся высказываются, их ответы дополняются учителем.
Задание: учащиеся должны изучить текст параграфа, дополнительный материал и создать постер по своей теме:
1 группа - строение озона и его физические свойства
2 группа - получение и химические свойства озона
3 группа - значение озона
4 группа - охрана озонового слоя
После выполнения задания каждой группе нужно будет оценить работу своих товарищей.
Вопрос: по каким критериям вы будете оценивать их работу? Предполагаемый ответ: научность, эстетичность постера, доступность, выступление спикера.
Каждый критерий оценивается в 5 баллов.
20-18 баллов - «5»
17-15 баллов - «4»
14-11 баллов - «3»
Защита постера спикером.
Строение озона и его физические свойства.
Впервые озон обнаружил в 1785 году голландский физик Ван Марум по характерному запаху и окислительным свойствам, которые приобретает воздух после пропускания через него электрических искр. Однако как новое вещество он описан не был, Ван Марум считал, что образуется особая «электрическая материя».
Термин озон, предложенный немецким химиком X.Ф. Шёнбейном в 1840 году, вошел в словари в конце XIX века.
Это соединение, состоящее из 3-х атомов кислорода. Молекулярная формула - O3.
Явление, когда один и тот же химический элемент образует несколько простых веществ, называют аллотропией.
Разные простые вещества, образованные одним и тем же химическим элементом, называют аллотропными модификациями.
Озон - голубоватый газ с характерным резким запахом, малорастворимый в воде. Ткип= -1120С, Тпл =-1970С. Молекулярная масса 48, что тяжелее кислорода в 1,5 раза.
Получение и химические свойства озона.
Озоновый слой находится от 19 до 35 км над поверхностью Земли. Озон образуется из кислорода во время грозы, при ударе молнии, и в рентгеновском оборудовании. В промышленности его получают из воздуха или кислорода в озонаторах действием электрического разряда.
Уравнение реакции: 3О2 → 2О3
Сжижается озон легче, чем кислород, и потому их несложно разделить.
Молекула О3 неустойчива, и при достаточных концентрациях в воздухе при нормальных условиях самопроизвольно за несколько десятков минут превращается в O2 с выделением тепла.
По сравнению с кислородом озон проявляет особую химическую активность. Он взаимодействует со многими простыми и сложными веществами и без нагревания. Он быстро разрушает резину, очень медленно изменяющуюся в среде воздуха.
Взаимодействует при комнатной температуре с серебром, образуя оксид серебра:
Ag + O3→AgO + О2
Спирт при соприкосновении с озоном возгорается.
Значение озона.
Применение озона обусловлено его свойствами:
1. сильного окисляющего агента:
-
стерилизация изделий медицинского назначения;
-
получение многих веществ в лабораторной и промышленной практике;
-
отбеливание бумаги;
-
очистка масел.
2. сильного дезинфицирующего средства:
-
очистка воды и воздуха от микроорганизмов (озонирование);
-
дезинфекция помещений и одежды;
-
озонирование растворов, применяемых в медицине, как для внутривенного, так и для контактного применения.
Многочисленные исследования показали, что вдыхание озона способствует улучшению общего самочувствия, улучшает сон, смягчает проявление аллергических и астматических реакций, во многом снимает симптомы стресса, укрепляется иммунитет. Сегодня озон считается популярными эффективным средством обеззараживания воды, воздуха и очищения продуктов питания.
Охрана озонового слоя.
Озоновый слой защищает растения и животных от ультрафиолетового излучения. В 1985 году на Южном полушарии, над Антарктидой, была впервые обнаружена озоновая дыра.
Причины ослабления озонового щита.
1. Сгорающее топливо космических ракет «выжигает» в озоновом слое большие дыры.
2. Самолеты. Выбрасываемый ими пар и другие вещества разрушают озон.
3. Окислы азота, которые выделяются при разложении азотных удобрений.
4. Хлор и его соединения с кислородом, которые поступает в атмосферу, прежде всего от разложения фреонов, используемых в холодильной промышленности.
22 марта 1985 года была принята Венская конвенция «Об охране озонового слоя», в которой страны-участники конвенции договорились о необходимости проводить систематические исследования, связанные с озоновым слоем, и включить в законодательство требования по уменьшению и ликвидации эмиссии веществ, разрушающих озоновый слой.
16 сентября 1987 года был принят Монреальский протокол «По веществам, разрушающим озоновый слой», который позднее несколько раз был изменен и дополнен.
Протокол определяет мероприятия и сроки, в которые развитым и развивающимся странам необходимо уменьшить и прекратить производство, потребление, импорт и экспорт установленных в его приложениях веществ, разрушающих озоновый слой. Ученые прогнозируют, что если будут соблюдаться проводимые сегодня мероприятия по охране озонового слоя, то примерно в 2060 году озоновый слой может быть обновлен, и его «толщина» будет близка к нормальной.
Обсуждение выступлений и их оценивание.
-
Рефлексия:
-
Заполнить диаграмму Эйра Венна: отличия и сходства озона и кислорода (приложение 1).
Отличие кислорода от озона
Сходство озона и кислорода
Отличие озона от кислорода
-
Выберите правильные суждения:
А) Явление, когда один и тот же химический элемент образует несколько простых веществ, называют аллотропией.
Б) Озон - это аллотропная модификация кислорода.
В) Кислород химически активнее озона.
Г) Озон тяжелее воздуха.
Д) Озоновый слой предохраняет поверхность земли от перегрева.
Е) Кислород и озон - это единственные аллотропные видоизменения.
3. Лабиринт. Оценить результаты: 8 шагов - «5»; 6,7 - «4»; 4,5 - «3»
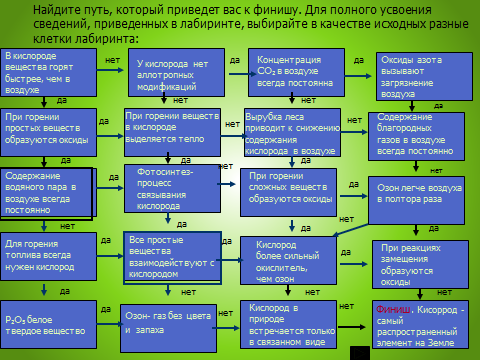
Приложение 1
Отличие кислорода от озона
Сходство озона и кислорода
Отличие озона от кислорода
-
В составе - два атома кислорода;
-
газ без цвета и запаха;
-
устойчивое соединение;
-
Ткип= -1830, Тпл= -2180;
-
поддерживает дыхание.
-
Простые вещества, образованные атомами кислорода;
-
газообразные, малорастворимые в воде вещества;
-
окислители.
-
В составе - три атома кислорода;
-
голубой газ с запахом;
-
неустойчивое соединение;
-
Ткип= -1120, Тпл= -1970;
-
защищает живые организмы от ультрафиолетовых лучей; химически активнее кислорода.
Использованная литература:
-
Новошинский, И. И. Химия 9 класс. Учебник для общеобразовательных учреждений. // И. И. Новошинский, Н. С. Новошинская - Москва «ОНИКС 21 век» «Мир и Образование», - 2004 год, - с.256
-
Бердоносов, С. С. Особенности содержания и методики преподавания некоторых избранных тем курса химии 8 - 9 классов// С. С. Бердоносов, Е. А. Менделеева. - Лекции 1-4. - Москва Педагогический университет «Первое сентября» - 2006 год, - с.76
-
Давыдова, М. Н. Кислород. Сценарии уроков 8 класс. // М. Н. Давыдова, Е. В. Савинкина. - Москва «Чистые пруды» - 2006 год, - с.32