- Учителю
- Разработка урока-практикума Получение и свойства этилена
Разработка урока-практикума Получение и свойства этилена
Тема: Получение и свойства этилена.
Образовательные цели:
-
закрепление, применение и оценивание знаний учащихся о практическом способе получения алкенов;
-
создание условий для формирования и развития экспериментальных умений учащихся;
-
формирование целостной системы знаний.
Воспитательные цели:
-
формирование коммуникативных и информационных компетенций школьников через организацию работы в группе;
-
воспитывать ответственность при работе в коллективе, исполнительность;
-
формировать черты социально направленной личности учащихся.
Развивающие цели:
-
продолжить формирование основных мыслительных операций (анализ, синтез, сравнение, абстрагирование);
-
способствовать развитию творческого подхода к учению.
Задачи:
-
знать лабораторный способ получения этилена, правила по технике безопасности при работе с органическими веществами и концентрированной серной кислотой;
-
уметь практически получать этилен и доказывать его свойства (непредельность) характерными реакциями;
-
уметь составлять уравнения реакций, доказывающие свойства этилена, проводить наблюдения, делать выводы, соблюдать правила техники безопасности при работе в кабинете химии.
Тип урока: применение знаний на практике
Форма урока: урок-практикум.
Структура урока подразумевает этапы: организационный, постановки цели, проверки домашнего задания и актуализации знаний, оперирования знаниями, умениями и навыками при решении практических задач, составление отчета о выполнении работы, определение домашнего задания. На этом уроке ученики, основываясь на ранее приобретенных знаниях, занимаются практической деятельностью. Сначала проверяется выполнения домашнего задания, затем разбирается теоретический материал с целью актуализации знаний. После этого ученики включаются в выполнение конструктивных заданий, имеющих ярко выраженную практическую направленность.
Форма организации деятельности учащихся: индивидуальная работа и работа в группах.
Основные единицы знаний: лабораторный способ получения этилена; качественные реакции на непредельные углеводороды этиленового ряда.
Методы обучения:
-
словесные;
-
наглядные;
-
практические;
-
применение знаний;
-
формирование умений и навыков;
-
творческая деятельность;
-
инструктивно-практические.
Средства обучения:
-
учебник Нурахметов Н.Н.(11 класс)
-
электронное пособие - Виртуальная лаборатория (химия 8-11 класс);
-
вопросы для повторения техники безопасности ;
-
проектор;
-
карточка-путеводитель для 4-х групп, ( Приложение №1 )
-
плакат: «Осторожно работайте с химическим оборудованием! Осторожно обращайтесь с концентрированной серной кислотой H2SO4!»;
-
концентрированная серная кислота - H2SO4;
-
раствор перманганата калия - KMnO4
-
штатив;
-
мерный цилиндр;
-
пробирки;
-
мерная ложка;
-
пробиркодержатель;
-
спиртовка;
-
прокаленный речной песок;
-
этиловый спирт - С2Н5ОН;
-
бромная вода Br2 (aq);
-
газоотводная трубка;
-
спички;
Ход урока:
Дома ребята изучали самостоятельно Практическую работу №2 по учебнику с. 328-328.
На уроке практическую работу учащиеся выполняют экспериментально в группах (4 группы по 4 человека).
-
Подготовка к проведению практической работы (организационный этап).
-
Вопросы (актуализация знаний) о правилах техники безопасности при работе с органическими веществами и поведении в кабинете химии (можно использовать электронное пособие - Виртуальная лаборатория (химия 8-11 класс).
Вопрос 1.
Следует ли конец газоотводной трубки вынимать из пробирки с раствором, например перманганата калия, не прекращая нагревания смеси H2SO4 и С2Н5ОН?
-
нет соблюдать это правило необязательно;
-
так делать не следует, т.к. возрастает опасность разрушения пробирки- реактора;
-
да, т.к. при охлаждении пробирки- реактора создается разряжение и холодный раствор, попав в горячую пробирку, приведет к ее разрушению;
-
да, потому, что смесь в пробирке-реакторе должна остывать постепенно, иначе возможен взрыв.
Вопрос 2.
Для чего в смесь этилового спирта и концентрированной серной кислоты добавляют кипятильные камешки?
-
для более равномерного кипения;
-
кипятильные камешки предохраняют смесь от перегрева;
-
для увеличения объема смеси;
-
кипятильные камешки играют роль катализатора.
Вопрос 3.
Как правильно приготовить реакционную смесь (смесь этилового спирта и концентрированной серной кислоты)?
Вопрос 4.
Прокомментируйте изображение «нагревание жидкости в пробирке».
Повторение основных правил техники безопасности.
3. Беседа о ходе проведения работы, с использованием карточек-путеводителей, запись цели работы (проверка домашнего задания, постановка цели).
Цель работы: научиться получать этилен в лаборатории и проводить качественные реакции на непредельные углеводороды этиленового ряда.
4. Проведение практической работы (оперирование знаниями, умениями и навыками).
4 группы учащихся получили карточку-путеводитель и приступили к выполнению
( карточка-путеводитель ) Приложение №1
5. Составление и оформление отчёта о выполнении работы индивидульно .Приложение №2
6. Домашнее задание:§ 4.2 стр.92
-
Задача. Смесь этана и этилена объёмом 0,8 л (н.у.) обесцветила 200г бромной воды с массовой долей 1,6%. Определите объёмную долю каждого газа в смеси.
-
Практическая работа закончена, учащиеся сдают тетради для практических работ на проверку,
Приложение №1

Приложение № 2
Получение этилена и опыты с ним Осторожно нагревать смесь.
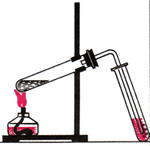
НАБЛЮДЕНИЯ:
1) ........................
CH3-CH2-OH ![]() .......
.......
1) Каким способом в лаборатории получают этилен?
2) Какую роль при этом играет серная кислота?
2. КАЧЕСТВЕННЫЕ РЕАКЦИИ НА ЭТИЛЕН.
1) Когда начнётся реакция, пропустить газ в пробирку с 2-3мл
подкисленного раствора перманганата калия, опустив газоотводную
трубку до дна пробирки (нагревание не прекращат;
2) Пропустить газ в пробирку с таким же кол-ом бромной воды.

НАБЛЮДЕНИЯ:
1) ........................
1) CH2=CH2 + [O] + HOH ![]() .......
.......
2) CH2=CH2 + Br2(aq) ![]() .......
.......
1) Какие вещества являются реактивами на двойную связь?
2) О чём свидетельствует изменение окраски растворов перманганата
калия и бромной воды?
3. ГОРЕНИЕ ЭТИЛЕНА.
Повернуть газоотводную трубку отверстием вверх и поджечь выделяющийся газ.

Наблюдения: светящиеся или несветящиеся пламя?
С2H4 + O2 ![]() ....
....
Что можно сказать о содержании углерода в этилене? (ответ подтвердите рассчётом мас.доли С%)
6. Домашнее задание:
-
§ 4.2 ст. 91
-
Задача. Смесь этана и этилена объёмом 0,8 л (н.у.) обесцветила 200г бромной воды с массовой долей 1,6%. Определите объёмную долю каждого газа в смеси.
Практическая работа закончена, учащиеся сдают тетради для практических работ на проверку,
Правила техники безопасности в кабинете химии
|
|
|
</<font face="Times New Roman, serif">1.
Проводите опыты, предусмотренные учителем, соблюдая правила
техники безопасности. |