- Учителю
- Опорный конспект Химическая связь. Строение вещества.
Опорный конспект Химическая связь. Строение вещества.
Химическая связь. Строение вещества.
Инертные газы (VIII гр. гл. подгр.) одноатомны
![]()
внешний электронный слой завершенный устойчивый
Другие изолированные атомы стремятся к ns2np6 (или к Is2). В результате образуется система связанных атомов и выделяется энергия.
Химическая связь (х. с.) - это совокупность сил, удерживающих атомы друг около друга.
Физическая природа х. с. едина - это ядерно-электронное взаимодействие.
Деление х. с. на виды условно и связано с природой химических элементов.
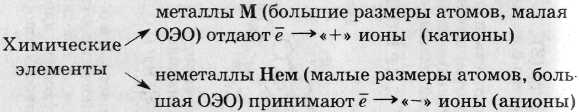
1. X. с. между типичными М и типичными Нем (большая разница в размерах атомов и ЭО) - ионная (связь между катионами и анионами за счет электростатического притяжения):
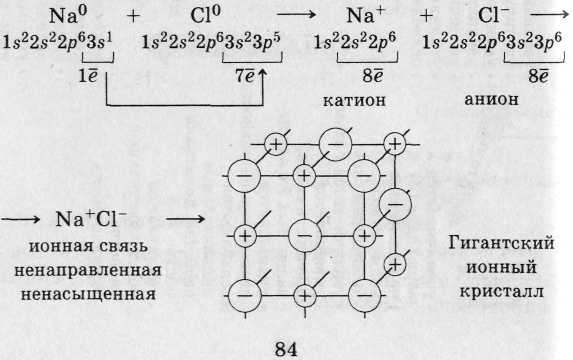
Примеры других веществ: CaO, LiF, K3N, NaH, ВаСl2, CsF (ионность связи 89 %) - твердые, тугоплавкие, растворы и расплавы электропроводны (NaCl = Na+ + Сl-), многие растворимы в Н2О.
2. X. с. между Нем (или М и Нем с небольшой разницей в размерах атомов и ЭО) - ковалентная (с помощью общих пар ē):
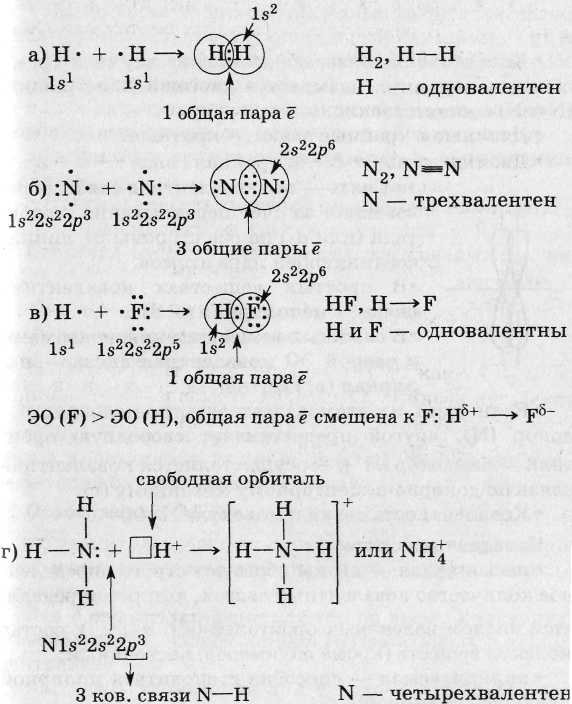
• При образовании ковалентной связи перекрываются орбитали внешнего слоя, имеющие неспаренные ē с противоположными спинами.
• Ковалентная связь, образованная одной общей парой ē, называется одинарной (Н - Н, Н - Сl). Одинарная связь - всегда α-связь.
α-Связь - это ковалентная связь, образованная за счет перекрывания орбиталей по линии, соединяющей ядра атомов:
![]()
и др.
• Ковалентная связь, образованная двумя и тремя общими парами ē, называется двойной или тройной
(N ≡ N) соответственно.
• Двойные и тройные связи - кратные.
• Двойная связь → σ + π ; тройная связь → σ + 2π.
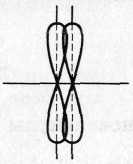
• π-Связь - это ковалентная связь, образованная за счет перекрывания р-орбитали (или d-) по обе
стороны от линии, соединяющей ядра атомов.
• В простых веществах ковалентная связь - неполярная (а, б).
• В сложных веществах между атомами с разной ЭО ковалентная связь - полярная (в, г).
• Если один из атомов дает электронную пару - донор (N), другой предоставляет свободную орбиталь - акцептор (Н+), =» осуществляется ковалентная связь по донорно-акцепторному механизму (г).
• Ковалентность связи в молекуле Н2 90% .
Ковалентная связь:
• насыщаемая - атомы образуют строго определенное количество
ковалентных связей, которое определяется числом валентных
орбиталей ![]() состав
молекул веществ (кроме полимеров) постоянный;
состав
молекул веществ (кроме полимеров) постоянный;
• поляризуемая - способна становиться полярной или более полярной;
• направленная - области перекрывания орбиталей располагаются определенным образом по отношению к взаимодействующим атомам, что влияет на пространственное строение (геометрию) многоатомных молекул и других частиц.
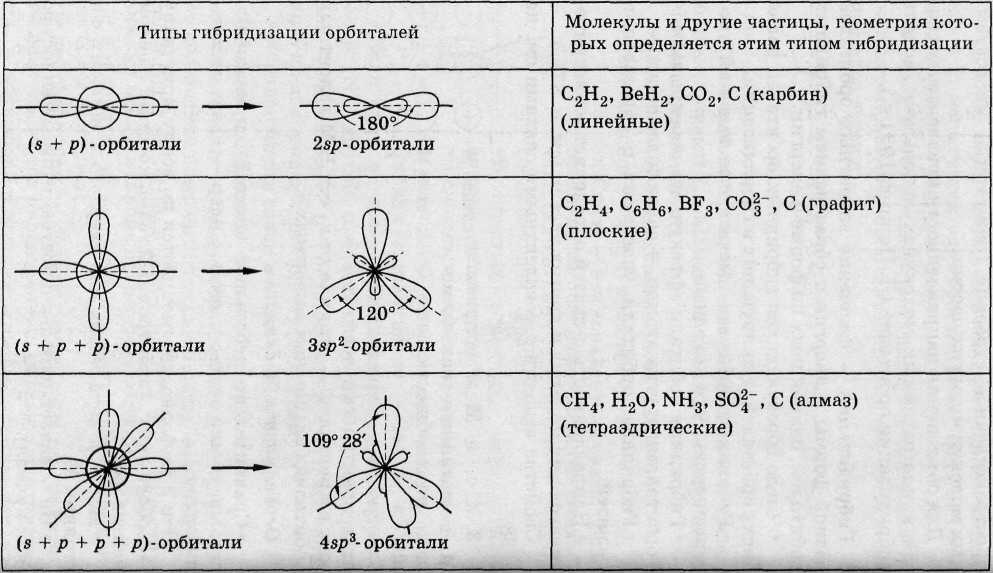
Для объяснения направленности ковалентных связей в многоатомных молекулах используют модель гибридизации орбиталей (Л. Полинг, 1931 г.).
Гибридизация - смешение валентных орбиталей разной формы и энергии с образованием гибридных орбиталей, одинаковых по форме и энергии.
• Число образующихся гибридных орбиталей равно числу орбиталей, участвующих в гибридизации.
• Гибридные орбитали имеют более высокий уровень энергии, чем исходные.
• Гибридные орбитали эффективнее перекрываются с орбиталями других атомов, => связи более прочные.
• Гибридные орбитали участвуют в образовании σ-связей.
• Направленность σ-связей определяет геометрическую форму молекул и других частиц.
Свойства веществ с ковалентными связями.
3. X. с. в М и сплавах. М - металлическая (основана на обобществлении - как в к. с. - валентных электронов, принадлежащих практически всем атомам в кристалле - отличие от к. с). В М валентных орбиталей больше, чем валентных ē.
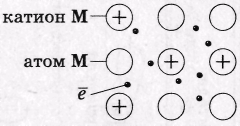
Особенности М связи:
• Сравнительно небольшое число ё одновременно связывает множество атомных ядер - связь делокализована.
Эти ē свободно перемещаются по всему кристаллу («свободные ё», «электронный газ»), который в целом нейтрален.
• М связь характерна для твердого и жидкого состояний М.
• Не обладает направленностью и насыщенностью (как ионная).
Вещества с ковалентными связями (кристаллы).

Общие физические свойства М: твердость (кроме Hg), металлический блеск, непрозрачность, тепло- и
электропроводность ( ↓ с ↑ t), пластичность, прочность, нерастворимость в Н2О (МЩ и МЩЗ с ней взаимодействуют) и др.
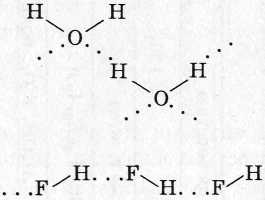
4. Водородная связь - связь между молекулами или частями больших молекул.
Механизм образования:
1) электростатическое притяжение между атомом Н (δ+) одной молекулы (или ее части) и сильно ЭО атомом F, О, N (δ-) другой молекулы (или ее части);
2) донорно-акцепторное взаимодействие маленького атома Н δ+, способного близко подходить к другим атомам с неподеленной парой ē, таким, как F, О, N (реже Сl и S).
Межмолекулярные: NH3, H2O, HF, спирты, карбоновые кислоты; амины и др.
Внутримолекулярные: полипептиды, нуклеиновые кислоты и др.
Влияние на свойства: увеличение плотности, t ПЛ , t КИП , растворимость в Н2О.
Ассоциация молекул за счет водородных связей (...)
Энергия связи Е (мера ее прочности) - энергия, необходимая для разрыва данной х. с. в 1 моль вещества (кДж/моль):
![]()
Длина связи - межъядерное расстояние (1 нм = = 10 -9 м, 1пм = 10 -12 м).