- Учителю
- Конспект урока к учебнику Г.Е. Рудзитис и Ф.Г. Фельдман Сильные и слабые электролиты (9 класс)
Конспект урока к учебнику Г.Е. Рудзитис и Ф.Г. Фельдман Сильные и слабые электролиты (9 класс)
Урок по теме: «Сильные и слабые электролиты. Степень диссоциации.»
Цели урока: сформировать знания о степени диссоциации и силе электролитов.
Задачи:
Обучающие: углубить понятия об электролитах и ЭД; показать влияние разбавления, температуры на степень диссоциации; определить понятие «степень электролитической диссоциации», сильные и слабые электролиты
Развивающие: развивать умение написания реакций диссоциации; формировать понятие диссоциированных и недиссоциированных молекул; научиться определять силу электролита в зависимости от степени диссоциации; развивать умение учащихся на основе теоретических знаний сравнивать, анализировать, обобщать, логически рассуждать, делать выводы, развивать устную речь.
Воспитательные: воспитывать интерес к знаниям, взаимопомощь, чувство товарищества, коммуникабельность, критичность по отношению к себе и другим, развивать самооценку.
Тип урока: комбинированный
Ход урока:
I. Организация начала урока.
II. Проверка усвоения предыдущего материала.
Фронтальный опрос:
Закончить предложение:
1). Электролитическая диссоциация - это….
2). Электролиты - это….
3). Неэлектролиты - это…
4). Дайте определение кислотам с точки зрения ТЭД. Приведите примеры.
5). Дайте определение щелочам с точки зрения ТЭД. Приведите примеры.
6). Дайте определение солям с точки зрения ТЭД. Приведите примеры.
7). Что показывают уравнения: а) NaCl - Na++Cl- и б) Na++Cl- - NaCl ? Как осуществить эти процессы в домашних условиях?
Карточки:
1).Составить уравнения диссоциации веществ: NaNO3, HCl, KOH
2). При диссоциации каких веществ в воде образуются ионы: Na+, Cl-, H+, Br-, Li+,OH-
3). Составьте уравнения диссоциации веществ: серной кислоты, карбоната натрия, гидроксида кальция
III. Изучение новой темы.
До сих пор мы рассматривали электролиты, которые в водных растворах диссоциируют полностью. Возникает вопрос: все ли электролиты в одинаковой степени распадаются на ионы? Ответ на этот вопрос поможет дать эксперимент.
Если опустить в концентрированный раствор хлорида натрия электроды прибора для определения электрической проводимости, то лампочка в нем засветится ярко, а в концентрированном растворе уксусной кислоты - неярко. При добавлении воды к раствору уксусной кислоты лампочка начинает светиться все ярче. Разбавление же раствора хлорида натрия почти не влияет на яркость свечения лампочки. Так как электрическая проводимость зависит от числа ионов в растворе, то, следовательно, хлорид натрия даже в концентрированных растворах диссоциирует на ионы полностью, молекулы же уксусной кислоты в концентрированных растворах почти не диссоциируют. При разбавлении раствора уксусной кислоты число диссоциированных молекул увеличивается.
Выводы:
1). Некоторые электролиты независимо от концентрации в водных растворах диссоциируют на ионы полностью. Это вещества с ионной кристаллической решеткой.
2). Существуют электролиты, которые диссоциируют частично. Разбавление таких растворов приводит к смещению равновесия вправо, а увеличение концентрации - влево.
Степень электролитической диссоциации.
Отношение числа диссоциированных молекул к общему числу молекул, находящихся в растворе, называют степенью диссоциации.
Степень диссоциации (α - греческая буква альфа) - это отношение числа молекул, распавшихся на ионы (n), к общему числу растворенных молекул (N):
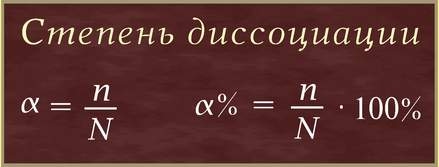
Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если α = 0, то диссоциация отсутствует, а если α = 1 или 100%, то электролит полностью распадается на ионы. Если же α = 20%, то это означает, что из 100 молекул данного электролита 20 распалось на ионы.
Степень диссоциации зависит от природы электролита и растворителя, от концентрации электролита, температуры.
1. Зависимость степени диссоциации от добавления одноименных ионов: при добавлении одноименных ионов в раствор, степень диссоциации уменьшается.
2. Зависимость степени диссоциации от концентрации электролита: с уменьшением концентрации электролита, т.е. при разбавлении его водой, степень диссоциации всегда увеличивается.
3. Зависимость степени диссоциации от температуры: степень диссоциации возрастает при повышении температуры.
Сильные и слабые электролиты
В зависимости от степени диссоциации различают электролиты сильные и слабые. Электролиты со степенью диссоциации больше 30% обычно называют сильными, со степенью диссоциации от 3 до 30% - средними, менее 3% - слабыми электролитами.
Классификация электролитов в зависимости от степени электролитической диссоциации (памятка)
2. Сильные кислоты (НСl, HBr, HI, НNО3, НClO4, Н2SO4(разб.));
3. Сильные основания - щёлочи.
H3PO4
H2SO3
1. Почти все органические кислоты (CH3COOH, C2H5COOH и др.);
2. Некоторые неорганические кислоты (H2CO3, H2S и др.);
3. Почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH);
4. Вода.
Силу кислородсодержащих кислот можно определить по следующему правилу:
HnROm, где R - кислотообразующий элемент, n - число атомов водорода, m - число атомов кислорода. Если m-n = 0, кислота очень слабая, m-n = 1 - слабая, m-n = 2 - сильная, m-n = 3 - кислота очень сильная.
Задание: рассчитайте силу кислоты: HNO2, HClO3, H2SO3, HClO4.
IV. Закрепление:
1.Чему равна степень диссоциации электролита, если при растворении его в воде из каждых 100 молекул на ионы распалось: а) 5 молекул, б) 80 молекул?
2.В перечне веществ подчеркните слабые электролиты.
H2SO4; H2S; CaCl2; Ca(OH)2; Fe(OH)2; Al2(SO4)3; Mg3(PO4)2; H2SO3; КОН, KNO3; HCl; BaSO4; Zn(OH)2; CuS; Na2CO3.
3. При полной диссоциации 1 моль нитрата меди (II) в растворе образуется:
А) 3 моль катионов меди и 1 моль нитрат-ионов;
Б) 2 моль катионов меди и 3 моль нитрат-ионов;
В) 1 моль катионов меди и 2 моль нитрат-ионов;
Г) 1 моль катионов меди и 3 моль нитрат-ионов.
</ V. Итоги урока. Выставление оценок. Домашнее задание: п. 8, упр. 1, 4 стр. 33.