- Учителю
- Урок по химии на тему: 'Вода - самое удивительное вещество'
Урок по химии на тему: 'Вода - самое удивительное вещество'
Вода - самое удивительное вещество.
Воде была дана волшебная власть стать соком жизни на Земле.
Леонардо да Винчи.
Цель:
-углубить знания о физических и химических свойствах воды;
- расширить знания о значении воды как источнике жизни на нашей планете;
- способствовать бережному отношению к воде и водоемам;
- развивать интерес к предмету химии, расширить кругозор обучающихся.
- способствовать наиболее яркому проявлению творческих способностей учащихся.
Задачи:
- содействовать формированию основных базовых компетенций: учебной, коммуникативной, личностной;
- развивать умения и навыки самостоятельного учебного труда с информационными источниками, умение анализировать, сравнивать, обобщать и делать выводы, выступать перед аудиторией;
- обеспечить формирование экологически целесообразного поведения в быту и будущей трудовой деятельности.
Методы и методические приемы: 1) словесный, наглядный, практический; 2) частично - поисковый.
Межпредметные связи: биология, литература, география, история, медицина, физика.
Использованная литература:
-
Л. И. Попова МИР ВЕЩЕСТВ. Разработки внеклассных мероприятий 8-11 классы. ООО «Чистые пруды», 2010
-
Репетитор по химии под редакцией А. С. Егорова, Ростов - на - Дону «Феникс», 2011
-
Предметная неделя химии в школе. Составитель С. В. Бочарова. Волгоград: Корифей, 2006
-
Предметная неделя химии в школе. Под общей редакцией К. Н. Задорожного. Ростов - на - Дону «Феникс», 2008
-
Шукайло А. Д. Тематические игры по химии: методическое пособие для учителя. М. «Сфера», 2003
-
Элективный курс «Химия в повседневной жизни»: 10-11 классы. Составитель С. В. Бочарова. Волгоград «Корифей», 2007
План урока
-
Вода в природе.
-
Строение молекулы воды. Водородная химическая связь
-
Физические свойства воды.
-
Химические свойства воды.
-
Вода - универсальный растворитель.
-
Вода - самое необыкновенное вещество в мире. Показ фильма «Вода - удивительное вещество»
-
Значение воды (пословицы, загадки). Кроссворд.
-
Проблема дефицита пресной воды в мире. Пути решения водной проблемы.
Организационный момент: проверка обучающихся по списку.
Подготовка к восприятию нового материала:
Загадка
Хоть составчик мой и сложный,
Без меня жить невозможно.
Я - отличный растворитель,
Жажды лучший утолитель.
А разрушите, так сразу
Два получите вы газа. (ВОДА)
Учитель: Советский ученый В. И. Вернадский писал: «Она стоит особняком в истории нашей планеты. Нет природного тела, которое могло бы сравниться с ней по влиянию на ход основных, самых грандиозных геологических процессов. Нет земного вещества - минерала, горной породы, живого тела, которое ее бы не заключало. Все земное вещество… ею проникнуто и охвачено». О каком веществе идет речь?
( После ответов обучающихся, на доске вывешивается тема занятия - «Вода - самое удивительное вещество»).
Изучение нового материала:
Показ презентации на тему: «Вода - самое удивительное вещество»
1. Вода в природе.
Учитель: Жизнь- вода, время - вода, вечность - вода.
Вода - самое распространенное на Земле вещество. Поверхность земного шара на ¾ части покрыта водой (океаны, моря, озера, ледники). В больших количествах вода также находится в атмосфере и земной коре. Наша планета буквально пропитана водой и окутана водяным паром. Общие запасы свободной воды на Земле составляют 1,4 млрд км. Почти столько же воды находится в физически и химически связанном состоянии, например в природных кристаллогидратах: глауберовой соли Na2SO4 * 10 H2O, бокситах AL2O3 * n H2O.
Организмы животных и растений содержат от 50 до 90 % воды. В организме человека она составляет около 65 - 70% от массы тела. Большая часть воды в организме находится внутри клеток (70%), около 23% составляет межклеточная вода, а остальная (7%) находится внутри кровеносных сосудов и в составе плазмы крови. Потеря организмом человека более 10% воды может привести к смерти. При продолжительности жизни 70 лет человек потребляет около 25 т воды.
Установлено, что у новорожденного ребенка вода составляет до 90% массы тела, у взрослого - 70-80%. А критической считается цифра в 55% - именно столько воды содержится в организме человека, умирающего от старости.
Ученые пришли к выводу, что вода загрязняется:
-
Углекислым газом за счет выбросов заводов;
-
Космические влияния очень загрязняют воду;
-
Негативная энергия людей.
На протяжении 5 лет ученые исследовали свойства воды. Так установлено, что вода воспринимает сознание человека и способна реагировать на него. Негативные слова разрушают живительные свойства воды, а добрые слова делают воду красивой, яркой. Исследователи пришли к выводу, что жизнь - программа, которая связана с живительными свойствами воды. Гордыня человека изменяет качества воды. Если вода внутри чистая, то мир приятен и светел.
-
Строение молекулы воды. Водородная химическая связь (сообщения обучающихся)
Молекула воды имеет угловое строение, угол между связями Н-О-Н = 105.
Связи О-Н в молекуле воды являются полярными, на атоме кислорода существует частичный отрицательный заряд, на атомах водорода - частичный положительный заряд.
В целом молекула воды является полярной молекулой, т. е. диполем: + -

Итак, рассмотрим строение молекулы воды: угол Н-О-Н равен 105. Молекула воды имеет угловое строение. Из чего состоит молекула воды?
Обучающиеся: из двух атомов водорода и одного атома кислорода.
Молекула воды - устойчивое химическое соединение, т. к. для воды характерна водородная химическая связь. (стр. 48 - учебник О. С. Габриелян химия 11 класс) Химическая связь между атомами водорода одной молекулы и атомами электроотрицательных элементов (F, O, N) другой молекулы называют водородной химической связью.
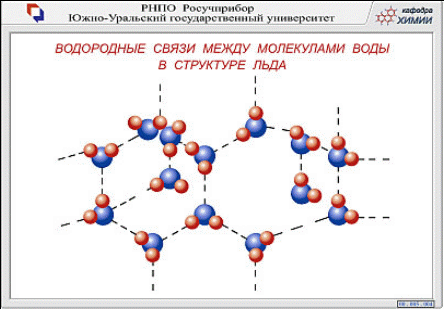
Так образуются ассоциации молекул воды. Если бы водородных связей не было, то вода была бы подобна химическим соединениям водорода с другими элементами шестой группы периодической системы (S, Se, Te), т. е. она могла бы кипеть при температуре - 70 С и замерзать при - 90 С и тогда вода могла бы существовать на Земле в виде пара.
По современным представлениям молекула воды - диполь, т. е. она имеет 2 центра тяжести. Один - центр тяжести положительных зарядов, другой - отрицательных. В пространстве эти центры не совпадают, они ассиметричны, т. е. молекула воды имеет два полюса, создающих вокруг молекулы силовое поле, молекула воды полярна.
Учитель: какая температура кипения и температура замерзания воды?
Обучающийся: температура кипения воды - 100 С, а температура замерзания - 0 С.
Учитель: Существуют кластеры воды: пара - и орто - ансамбли. Пара - ансамбли никогда не вращаются. Можно сказать, что это мертвая вода, а орто- ансамбли вращаются всегда. Они очень активны и общительны, т. е. способны воспринимать информацию. Ученые считают, что благодаря этим свойствам воды, мы сможем лечить многие тяжелые заболевания (растворять почечные камни).
Установлено, что при ( - 269 С ) вода не замерзает, обладает текучестью и способна перемещаться на огромные расстояния. Находясь в критическом состоянии, она способна растворять и разлагать ядовитые вещества.
В Германии в 60 -годы двадцатого столетия лаборантка уронила ампулу хорошо закрытую с ядом в дистиллированную воду. Она не стала ее вытаскивать из воды, чтобы не привлекать внимание. Через 4 дня ампулу обнаружили. Водой, в которой была ампула с ядом, напоили лабораторных мышей. Через 10 минут мыши были мертвые. Значит, вода восприняла негативную информацию даже через хорошо закупоренную ампулу.
-
Физические свойства воды (сообщения обучающихся).
Вода (оксид водорода) при обычных условиях - прозрачная жидкость, не имеющая цвета, вкуса и запаха. В твердом состоянии она называется льдом или снегом, а в газообразном - водяным паром.
Вода воспринимает любое воздействие. Под эти воздействием вода изменяет характер
Невозможно найти в природе другое вещество, физические свойства которого были бы так необычны, своеобразны, аномальны. Это связано с тем, что молекулы воды находятся в ассоциированном состоянии за счет образования межмолекулярных водородных связей:
Практически все тела при нагревании расширяются, при охлаждении сжимаются. В интервале температур от +4 до 0С вода при охлаждении расширяется! Наибольшую плотность (1000 кг/м) вода имеет при +4 С, при более низкой и более высокой температурах плотность воды несколько меньше. Благодаря этому явлению осенью и зимой в глубоких водоемах конвекция происходит своеобразно. Охлаждаясь сверху, вода опускается вниз, на дно, но только до тех пор, пока ее температура не достигнет + 4 С. Более холодная вода остается сверху. Благодаря этому под слоем льда, покрывающим водоем сверху, живут в воде рыбы и другие обитатели водоемов.
Вода воспринимает широкий спектр полей и лучей и способна колебаться с любой частотой.
Учитель: Ученые установили, что клетки нашего организма заполнены пограничной водой, обладающей с одной стороны отрицательным зарядом, а с другой стороны положительным зарядом. Когда мы пьем обычную воду, организм тратит мало энергии на перевод этой воды в пограничную воду. При употреблении чая, кофе, организму нужно потратить много энергии, чтобы перевести эти напитки в пограничную воду. Вывод: пейте больше обычной воды (2 - 2, 5 л в день).
-
Химические свойства воды.
Учитель: вода - одно из наиболее реакционноспособных веществ.
1.Вода при обычных условиях взаимодействует с такими сильнейшими восстановителями, как щелочные и щелочноземельные металлы:
2 Na + 2H2O= 2NaOH+ H2
2. Многие химические процессы ускоряются в присутствии воды, т. е. вода играет роль катализатора:
2AL + 3I2==== 2 ALI3
3. Взаимодействие с основными оксидами (оксидами металлов):
CaO + H2O = Ca(OH)2
-
Взаимодействие с кислотными оксидами (оксидами неметаллов):
SO3+ H2O = H2SO3
5. Для воды характерна реакция разложения, ее еще называют электролизом воды. Она протекает под действием электрического тока в специальном устройстве - электролизёре. В результате образуется два газа - кислород и водород.
2 H2O === 2H2 + O2
Запишите реакции, с помощью которых можно осуществить следующие превращения:
H Cl → H2 → H2O → NaOH
Cl → H2 → H2O → NaOH
H2CO3
Ответы:
1. Ca + 2HCl = CaCl2 + H2↑
2. 2H2 + O2 = 2H2O
3. 2Na + 2H2O = 2NaOH + H2↑
4. H2O + CO2 ↔ H2CO3
Учитель (вопрос обучающимся 1-го ряда): Почему яйцо не тонет в соленой воде?
Обучающиеся: Потому что плотность соленой воды больше, чем пресной, значит, больше и выталкивающая сила.
Учитель (вопрос обучающимся 2-го ряда). Почему говорят: «Как с гуся вода?»
Обучающиеся: Перья гусей покрыты жиром и водой не смачиваются - позволяют им «выйти сухими из воды».
Учитель (вопрос обучающимся 3-го ряда). Может ли вода гореть?
Обучающиеся: Да, в атмосфере свободного фтора.
-
Вода - универсальный растворитель (сообщения обучающихся).
Вода - универсальный растворитель. На дне Тихого океана находится 1 500 000 млн. т. металлических руд. В воде морей и океанов содержатся почти все элементы периодической системы Д. И. Менделеева. Океанскую воду называют «жидкой рудой», и уже сегодня из нее извлекают натрий, хлор, золото, уран.
Вода широко используется в качестве растворителя в химической технологии, а также в лабораторной практике. Она представляет собой универсальный растворитель, необходимый для протекания биохимических реакций. Вода прекрасно растворяет ионные, а также многие ковалентные соединения. Способность воды хорошо растворять многие вещества, обусловлена полярностью ее молекул. Молекула воды обладает сравнительно большим дипольным моментом. Поэтому при растворении в ней ионных веществ молекулы воды ориентируются вокруг ионов - гидратируют их. Водные растворы ионных веществ являются электролитами. Обучающиеся проводят опыты (растворение NaCI (соли) в воде и шипучая таблетка «Аспирин- упса» также растворяется в воде).
Вода - лучший растворитель в мире! Она растворяет очень многие вещества, но сама остается инертной - не изменяется ее химический состав. Благодаря этому качеству вода смогла стать носителем жизни.
-
Вода - самое необыкновенное вещество в мире.
Показ фильма «Вода - удивительное вещество»
Учитель: знаете ли вы, что вода у древних химиков считалась самым главным элементом: «Вода - начало всех начал». А. Фалес, живший в v веке до нашей эры, утверждал, что окружающий мир возник из «первичной воды».
-
Водные источники у древних народов служили местом сборища, воде поклонялись как сверхъестественной силе, и она считалась матерью жизни и смерти.
-
Основатель греческой медицины Гиппократ, живший в 4 веке до нашей эры, при лечении на одно из первых мест ставил воду (основное средство гигиены).
-
В составе мантии Земли воды содержится в 10 - 12 раз больше, чем в Мировом океане.
-
В среднем соленость Мирового океана составляет около 3,5%. Наименее соленой является вода Финского залива и северной части Ботнического залива, входящих в акваторию Балтийского моря. Наиболее соленой является вода Красного моря.
-
Синий цвет чистой океанской воды объясняется избирательным поглощением и рассеянием света в воде.
-
Вода отражает 5% солнечных лучей, в то время как снег - около 85%, под лед океана проникает лишь 2% солнечного света.
-
«Где вода, там и жизнь» и «Земля умирает, если ушла вода» - эти восточные пословицы известны каждому.
Вода содержит все тайны жизни. Она позволяет понять назначение человека. Вода способна смыть с человека грязь. На вид темная, на деле - прозрачная . Это совершенство воды. Когда человек испытывает любовь , то вода становится очень красивой.
Закрепление полученных знаний.
-
Значение воды (пословицы.). Кроссворд.
Учитель: Сколько дней может прожить человек без воды?
Обучающиеся: Без воды человек может прожить очень не долго. Потребность в воде стоит на втором месте после кислорода. Без еды человек может прожить около шести недель, а без воды - 5-7 суток.
О значении воды говорится и в пословицах мира:
1. Где вода, там жизнь.
2. Вода - кровь земли.
3. Мать водица - всему царица.
4. Много воды, много травы.
5. Много снега, много хлеба.
6. Пей воду, вода не смутит ума.
Учитель. Разгадайте кроссворд. В нем тема нашего занятия является ключевым словом. У каждого ряда есть одна минута для обсуждения ответов на вопросы и записи их на листочке. Ряд, который первым заполнит кроссворд, получает 5 баллов.
По горизонтали. 1. Класс неорганических соединений. 2. Газ, необходимый для дыхания. 3. Общее название солей соляной кислоты. 4. Неметалл желтого цвета.
По вертикали - ключевое слово.



























Ответы на кроссворд
1. Основания. 2. Кислород. 3. Хлориды. 4. Сера. Ключевое слово: ВОДА
Подведение итогов урока:
Учитель. В августе 2008 года был проведен эксперимент на озере Байкал. На проведение этого эксперимента были отобраны люди, которые обратились к озеру со словами любви и радости. В результате, произошло повышение положительной энергии в пространстве. Люди увидели двойную радугу. Значит с любовью и благодарностью необходимо обращаться к воде. И прольется с неба на Землю живительная влага…
Исследователи выяснили, что Солнце способно издавать звук в виде колокола. Вода реагирует на это красивыми кристаллами с расходящимися лучами.
Вода нужна всем отраслям народного хозяйства. Больше всего потребляет ее сельское хозяйство, на втором месте - промышленность и энергетика, на третьем - коммунальное хозяйство. Промышленность нашей страны ежесекундно потребляет столько воды, сколько несет ее река Волга. На получение 1 т стали расходуется 150 т воды, бумаги - 250 т, синтетических волокон - 4000 т.
Ежегодное потребление воды в расчете на одного жителя Земли составляет 7- 8 т. Подсчитано, что если город потребляет в день 600 тысяч кубических метров воды, то он дает 500 тысяч кубических метров сточных вод. Во всем мире на обеззараживание сточных вод ежегодно тратится 5500 кубических километров чистой воды - втрое больше, чем на все другие нужды человечества.
В Москве самый высокий уровень водопотребления до 700 литров, в Лондоне - 170 литров, в Париже - 160 литров, в Брюсселе - 85 литров.
По данным Всемирной организации здравоохранения до 500 млн. заболеваний в год, возникающих на Земле, связаны с качеством воды и уровнем водопотребления.
За всю свою жизнь человек выпивает примерно 35 т воды. Потеря организмом человека более 10% воды может привести к смерти. Нет воды, нет жизни.
Воду нужно беречь, и хотя наша страна богата пресными водами, как никакая другая (только в озере Байкал содержится 20 % мировых запасов пресной воды), однако Россия, как никакая другая страна мира, бездумно и бездушно относится к охране пресной воды.
Проблема дефицита пресной воды в мире. Пути решения водной проблемы.
От «водного стресса» в мире страдают более 700 миллионов человек в 43 странах.
Основной ресурс воды для жизнедеятельности - речной сток. Общий объем воды на Земле - 13,5 млн км, а на одного человека - 250 -270млн м. Запасы пресной воды - содержатся в ледниках (Антарктика, Арктика, Гренландия) составляют 2,5%, соленые подземные, горные озера и воды - 1%, воды Мирового океана - 96,5%.
Региональная нехватка воды отмечается в странах Центральной Азии, Среднего Востока и Северной Африки, а также в Индии, Пакистане и США.
Получают воду из - за границы: Азербайджан, Латвия, Словакия, Узбекистан, Украина, Хорватия, Израиль, Молдова, Румыния и Туркменистан.

Пути решения водной проблемы:
- Сооружение водохранилищ;
- с начала 90-х годов на Земле эксплуатируются более 40 тыс. водохранилищ.
- внутрибассейновая переброска речного стока.
- опреснение морской воды.
- транспортировка Айсбергов.
Вода…
Задумайся над словом.
Здесь слышится журчанье ручейка.
И синие бескрайние просторы,
Встают пред нами, словно небеса.
А сколько же воды на этом свете
Мы тратим попусту, на всякие дела?..
Ведь мы не знаем слова «жажда»,
Не знаем слова и «жара».
А у других любая капля влаги
Ценнее золота, дороже серебра.
Давайте же беречь своё богатство!
Все воды: реки и моря.
И будем радоваться вместе,
Что так красива вся Земля!
Дополнительный материал к уроку
Знаете ли вы, что…
- Первый закон об охране вод был написан Петром 1;
- без воды в зеленом листе не могут образовываться сахар, крахмал, жиры, кислоты и другие вещества;
- многие химические процессы ускоряются в присутствии воды;
- чистота и прозрачность байкальской воды - результат жизнедеятельности рачков эпишура, пропускающих через себя всю воду озера трижды в год;
- без воды невозможно гниение растительных и животных организмов.
Загадки о воде.
-
Что видно, когда ничего не видно?
(туман)
-
Темным облаком летела, опустилась птицей белой, превратилась в человечка, постояла у крылечка, покатилась кувырком и запела ручейком.
(ВОДА)
-
Без крыльев летят,
Без ног бегут,
Без паруса плывут.
(облака).
Инструктаж по выполнению домашней работы:
1. Закончите уравнения химических реакций, укажите тип реакций.
а) SO2 + H2O →;
б) Ca + H2O →;
в) H2O + P2O5 →;
г) Na + H2O →;
д) BaO + H2O →;
е) K2O + H2O →;
ж) Al2S3 + H2O →.
2. п. 6 стр. 47-53; упр. 2 и п. 17 стр. 143-149; упр. 1; 4
3. Пофантазируйте и продолжите рассказ: «Если бы я стал(а) капелькой воды, то…»
Можно составить рассказ о путешествии капельки воды в природе.
«Вода… Ты не имеешь
ни вкуса ни цвета ни запаха, тебя невозможно
описать тобой наслаждаешься.
Ты не просто необходима
для жизни, ты и есть
сама жизнь. Ты божество,
ты совершенство, ты самое большое богатство на свете »
Антуан де Сент - Экзюпери