- Учителю
- Урок по теме: Вычисления по химическим уравнениям (8 класс)
Урок по теме: Вычисления по химическим уравнениям (8 класс)
Урок №
8 класс
Тема: «Вычисления по химическим уравнениям»
Чему бы ты не учился,
ты учишься для себя.
Петроний
(древнеримский писатель)
Цели урока:
-
Образовательные:
-
познакомить учащихся с основными способами решения задач по химическим уравнениям;
-
продемонстрировать и объяснить алгоритмы решения задач по химическим уравнениям.
-
Развивающие:
-
продолжить формирование навыков работы с текстом задачи, умение аргументированно выбирать способ решения учебной задачи, умение составлять уравнения химических реакций, вычислять количество вещества, массу одного вещества по известному количеству вещества или массе другого вещества по химическим уравнениям;
-
развивать умение анализировать, сравнивать, выделять главное, делать выводы;
-
развивать качества личности - трудолюбие, аккуратность, настойчивость в достижении цели.
-
Воспитательные:
-
воспитывать терпимость к другим, самостоятельность в принятии решений, умение объективно оценивать результаты своего труда;
-
формирование ответственности.
Оборудование: периодическая система химических элементов Д. И. Менделеева, таблица растворимости.
Базовые понятия и термины: количество вещества, масса, молярная масса, постоянная «Авогадро», химическая реакция, реагенты, продукты реакции, коэффициенты.
Тип урока: комбинированный.
Методы обучения: объяснительно-иллюстративные; словесные - беседа, рассказ; репродуктивные; частично поисковые; творческие - химический эксперимент; практические - решение задач.
Формы работы: фронтальная, индивидуальная, парная, групповая.
Структура урока
-
Организационный этап.
-
Проверка домашнего задания.
-
Актуализация опорных знаний.
-
Изучение нового материала.
1. Алгоритм действий при решении задач по химическим уравнениям.
-
Закрепление знаний.
-
Подведение итогов урока.
-
Домашнее задание.
Ход урока
-
Организационный этап.
Приветствие, создание у учащихся положительного эмоционального настроя, включение в деятельность.
Я приветствую тех, кто уже проснулся, в хорошем настроении, хотел бы узнать что-то новое, хочет общаться. Один из великих философов сказал: " ГДЕ ЕСТЬ ЖЕЛАНИЕ, НАЙДЕТСЯ ПУТЬ!". Мы сегодня на уроке с большим желанием будем решать задачи, определяя свой рациональный путь. Итак, тема нашего урока «Вычисление по химическим уравнениям». Эпиграфом к нашему уроку хочу предложить следующее высказывание: "Чему бы ты не учился - ты учишься для себя.". Только свой труд в изучении химии может принести результаты.
-
Проверка домашнего задания.
1. Проверка выполнения письменных заданий проводится устно.
2. При необходимости, если есть вопросы по домашнему заданию, то оно разбирается письменно у доски (Д/З §36, упр. 3; тестовые задания 1-4 по учебнику Г. Е. Рудзитис, Ф. Г. Фельдман «Химия 8 класс»).
-
Актуализация опорных знаний.
Один ученик у доски по карточке выполняет задание. Задание: дана ортофосфатная кислота массой 85 г. Вычислить количество вещества и количество молекул ортофосфатной кислоты, которая соответствует этой массе.
Пока ученик решает задачу, учитель проводит опрос учащихся по предыдущим темам.
•Беседа
-
Дайте определение понятий: молярная масса, количество вещества, моль, постоянная «Авогадро».
•Работа с иллюстративным материалом
-
Какие химические величины обозначают эти буквы? (слайд 1)
-
Что обозначают эти единицы измерения? (слайд 2)
-
Что рассчитывают по этой формуле? (слайд 3)
-
Какой ученый изображен на портрете? (слайд 4)
-
Какие химические величины обозначают эти буквы? (слайд 5)
-
Как называется это число? (слайд 6)
-
Какое отношение насекомое моль имеет к количеству вещества в химии? (слайд 7)
-
Какую формулу мы не упомянули при изучении темы: «Количество вещества»? (слайд 8)
Послесловие к слайду 7:
Моль: русское обозначение моль; международное: mol; от лат. moles - количество, масса, счетное множество - единица измерения количества вещества. В международной системе единиц (СИ), одно из семи основных единиц СИ. Моль принят в качестве основной единицы СИ на XIV генеральной конференции по мерам и весам в 1971 году. Существует легенда, что когда возникла проблема названия единицы измерения количества вещества, то один из ученых биологов, присутствующий на этой конференции, увидел в конференц-зале моль, хлопнул в ладоши и вскрикнул: «Моль!». Другие ученые восприняли этот возглас как вариант названия количества вещества.
После беседы учителя с классом проверяется задача, которую решал ученик у доски.
Послесловие к сладу 8:
В пустой слайд ученики вписывают недостающую формулу.
•Мотивация
В средние века алхимики не знали, что с помощью вычислений можно определить какая масса вещества должна вступить в реакцию или образоваться в результате реакции. Они брали для экспериментов произвольные порции веществ и по их остаткам выясняли, какая масса каждого вещества прореагировала. В настоящее время расчеты не только масс, но и количество вещества реагентов и продуктов реакций, объемов газов осуществляют по химическим уравнениям. При этом используют значение относительных атомных, молекулярных, формульных или молярных масс. Благодаря таким расчетам химик или инженер-технолог может целенаправленно осуществлять химические превращения, получать продукты реакции в необходимом количестве, избегая избытка исходных веществ. Сегодня на уроке мы будем учиться решать задачи с использованием химических уравнений. Давайте вспомним: какую информацию дает химической реакции; сформулируйте закон сохранения массы веществ?
-
Изучение нового материала.
Химия очень интересная и в то же время сложная наука. Для того чтобы знать и понимать химию, надо не только усваивать материал, но и уметь применять полученные знания. Для того, чтобы решать задачи необходимо воспользоваться алгоритмом действий. Напомню, что коэффициенты в уравнении указывают на соотношение количеств вещества реагентов и продуктов реакции:
2Ca + O2 = 2CaO
2 моль 1 моль 2 моль
n(Ca):n(O2):n(CaO)=2:1:2
Учитель читает условие задачи и показывает решение ее с использованием алгоритма.
•Задача
Какая масса гидроксида лития образуется в результате взаимодействия четырех моль оксида лития с достаточным количеством воды?
Дано:
n(Li2O)=4 моль
H2O
Найти:
m(LiOH)
Решение:
1. Составляем химическую реакцию и превращаем в химическое уравнение
Li2O + H2O = 2LiOH
2. Под формулами Li2O и LiOH записываем их количество вещества, согласно их коэффициентам, а над формулами согласно условию задачи (по дано).
4 моль х моль
Li2O +H2O = 2LiOH
1 моль 2 моль
3. Составляем пропорцию
;
При взаимодействии 4 моль оксида лития с водой получилось 8 моль гидроксида лития
4. Записываем формулу количества вещества когда нам дана масса: . Из этой формулы выражаем массу: .
5. Находим молярную массу LiOH. M(LiOH)=7+16+1=24 г/моль.
6. Подставляем значение в последнюю формулу: m=8 моль*24 г/моль= 192 г.
7. Записываем ответ.
Физминутка
Раз - подняться, потянуться,
Два - нагнуться, разогнуться,
Три - в ладоши три хлопка,
Головою три кивка.
На четыре - руки шире,
Пять - руками помахать,
Шесть - на место тихо сесть.
-
Закрепление знаний
Учитель предлагает классу решить задачу, которая будет сопровождаться химическим экспериментом.
•Задача
Какая масса осадка образуется при взаимодействии сульфата купрума с гидроксидом калия массой 36г.
Ученики должны увидеть в результате химического эксперимента, который демонстрирует учитель, что действительно образовался осадок и по таблице растворимости определить вещество, которое выпало в осадок.
-
Подведение итогов урока
Опрос учащихся:
-
Что вы нового узнали на уроке?
-
Чему научились?
-
Сформулировать алгоритм решения задач по химическому уравнению.
Учитель предлагает ученикам определить собственные проблемы и достижения в решении задач по уравнениям химических реакций. Какие пути преодоления сложностей в решении задач видят ученики?
Учитель оценивает учеников, которые активно проявляли себя на уроке.
-
Домашнее задание
Повторить §36, изучить §37, упражнение 1, 2 (по учебнику Г. Е. Рудзитис, Ф. Г. Фельдман «Химия 8 класс»).
Слайд №1
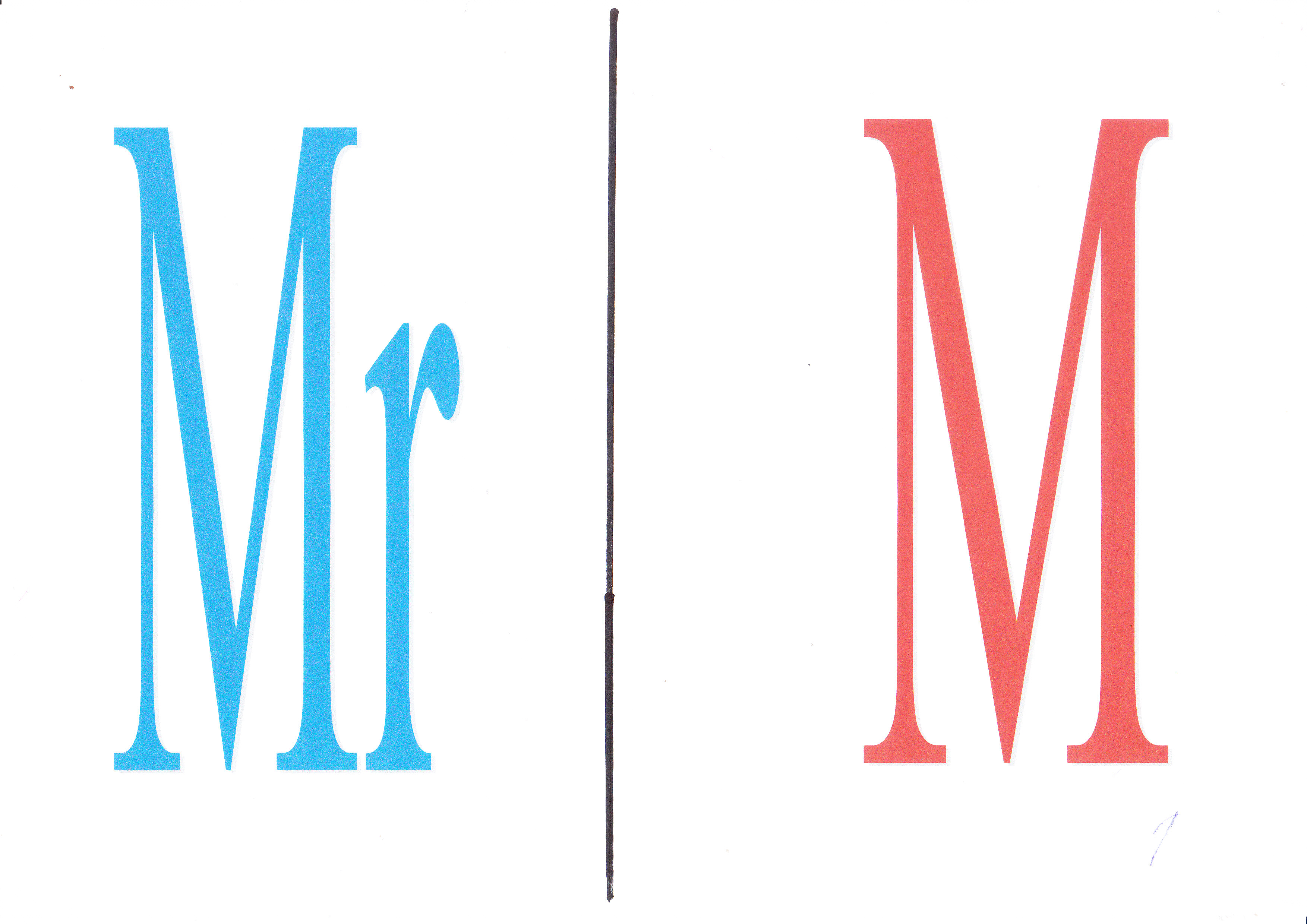
Слайд №2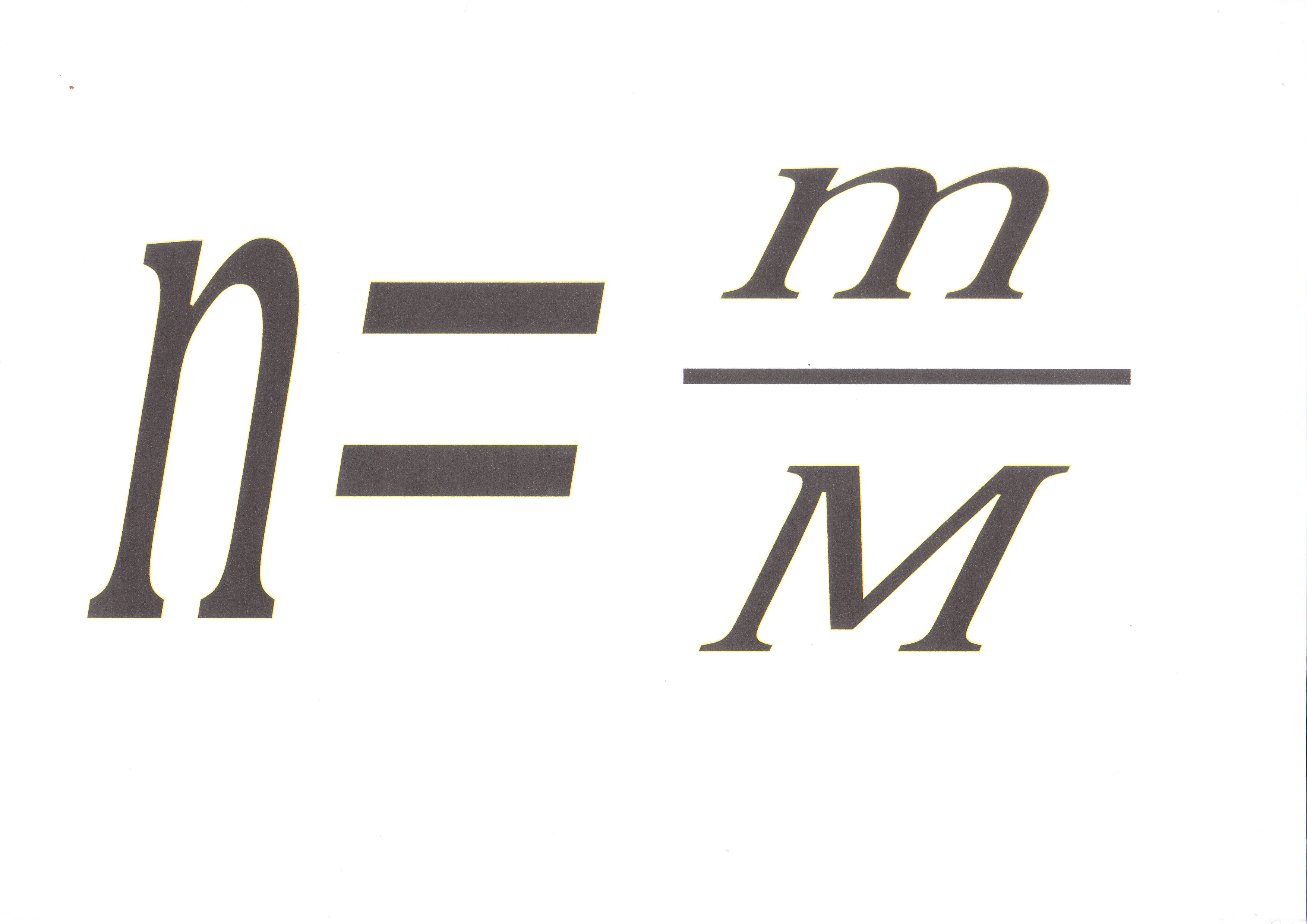
Слайд №3
</ 
Слайд №4
Слайд №5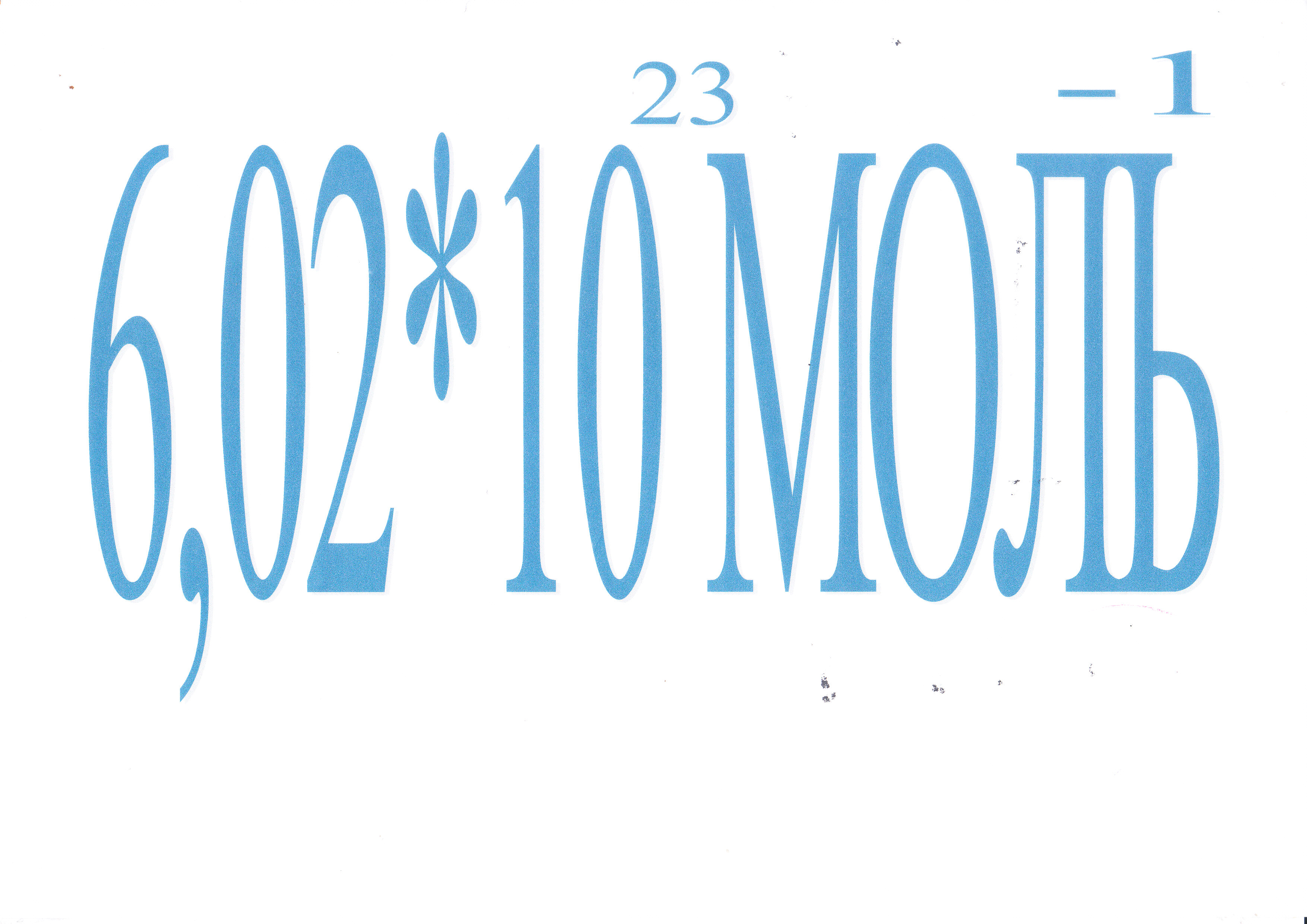
Слайд №6

Слайд №7
Слайд №8






