- Учителю
- Конспект открытого урока по химии на тему Строение атома
Конспект открытого урока по химии на тему Строение атома
ГОУ ТО «Тульская школа для обучающихся с ОВЗ №4»
Открытый урок в 8 классе по теме:
«Строение атома»
Учитель химии:
Ярош Д.И.
2015 - 2016 учебный год
Цели урока:
1.Обучающая:
рассмотреть физический смысл порядкового номера элемента, научить школьников описывать состав атомных ядер.
2.Развивающие:
сформировать у учащихся личностную мотивацию, познавательный интерес к данной теме; развить интеллектуальные и творческие способности учащихся, диалектическое мышление; углубить знания о взаимосвязи строения атома и структурой ПСХЭ;
3.Воспитательная:
развить познавательный интерес к устройству окружающего мира
Задачи урока:
1. Познакомить учащихся с историей установления сложного строения атома, с частицами, составляющими атом и их характеристиками.
2. Отработать умение записывать массовое число, порядковый номер элемента рядом с его символом, определять число протонов, нейтронов и электронов атомов любых химических элементов.
3. Показать, что этимологическое начало понятия "атом" ("неделимый") не соответствует действительности - атом делим.
4. Дать понятие о составе атома и атомного ядра. Раскрыть взаимосвязь понятий: протон, нейтрон, электрон, массовое число.
Тип урока: изучение нового материала.
Межпредметные связи: физика, история
Основные понятия (впервые вводимые):
1. Заряд ядра атома.
2. Электрон, протон, нейтрон.
Ход урока:
« Как рыба об лед, испокон веков билась мысль мудрецов в своём стремлении к единству во всем, то есть в искании начала всех начал».
Д. И. Менделеев.
-
Проверка усвоения изученного.
-
Что такое период? (горизонтальные ряды элементов, в пределах которых свойства элементов изменяются последовательно) Сколько периодов? Какие периоды бывают?
-
Что такое группа? Группы делятся на …?
-
Запишите массы атомов: магния, кальция, кремния, железа, серы.
-
Прежде чем перейти к новой теме мы напишем Химический диктант.
Найди элемент по адресу, укажи его порядковый номер. (использовать ПСХЭ Д.И.Менделеева),
2период, 5группа главная (азот)
2период, 3группа главная (бор)
3период, 2группа главная (магний)
5период, 2группа побочная (кадмий)
2период, 7группа главная (фтор)
4период, 3группа побочная (скандий)
4период, 6группа побочная (хром)
4 период,4группа главная (германий)
4период, 4группа побочная (титан)
7период, 1группа главная (франций)
2. Объяснение нового материала
Если вы внимательно изучали химию, то поняли, что вопрос: «Из чего всё состоит?»,- является основным в этой науке.
Этим ученые похожи на детей. Вспомните себя, наверное, многие разбирали, ломали игрушки только для того, чтобы узнать из чего она состоит. Ломать сегодня мы ничего не будем, но посмотрим на хорошо знакомую нам игрушку - матрёшку (учитель демонстрирует матрешку, открывая игрушку ещё и ещё …). Из чего состоит очередная матрёшка? Из более мелких матрёшек.
Химия - наука о веществах, из чего состоит вещество, где и что является началом всех начал? Это главный и первый вопрос.
Именно решению этой проблемы посвятим мы этот урок.
Представим себе:
Большую матрёшку ВЕЩЕСТВО
и з чего
состоит? из более мелких
з чего
состоит? из более мелких
 матрёшек МОЛЕКУЛЫ
матрёшек МОЛЕКУЛЫ
 что
дальше? АТОМЫ
что
дальше? АТОМЫ
 что
дальше? АТОМ - «неделимый»
что
дальше? АТОМ - «неделимый»
????
ТЕМА УРОКА: СТРОЕНИЕ АТОМА
Ещё 2,5 тысячи лет назад философ Демокрит предположил, что все вокруг состоит из маленьких неделимых частиц - «атомов».
Философы (мыслители) - люди, которые наблюдали, созерцали окружающий мир.
Как вы думаете какие наблюдения, какие явления природы навели философов на эту мысль?
Ответы учащихся:
( Вода состоит из маленьких капелек: дождь, брызги морских волн, испаряются и становятся невидимыми. Огонь - из мельчайших неделимых искр, камень дробиться до крупинок песка.)
Главная мысль этих наблюдений: крупное состоит из мелкого, мелкое из мельчайшего.
Демокрит считал, что атомы, как семена растений. Одни круглые, другие - пирамидальные, плоские, треугольные. Поэтому и состоящий из них мир неисчерпаемо богат в своих свойствах и качествах.
Атомы воды - гладкие, скользкие, круглые и поэтому вода растекается и не имеет формы.
Даже у огня учил Аристотель, есть свои атомы - они острые, колючие, поэтому огонь и жжется.
Обращаю ваше внимание, уже в то далекое время философы предполагали, что от строения зависят свойства вещества.
Как же узнать, как изучить строение объекта, если мы его не видим?
Если непосредственное наблюдение за объектом невозможно, все приписываемые ему свойства устанавливают на основании косвенных опытов.
Аналогично, судят о свойствах, какого - либо предмета, находящегося в закрытом ящике, коробке. На основании наблюдений за поведением этого ящика или коробки в различных условиях делают выводы о свойствах предметов, заключенных в них.
Предлагается проделать опыты:
- на партах учащихся различные по размеру закрытые коробочки с разным содержимым
( металлическими скрепками, горох, конфеты Чупа-чупс. и т. д.);
- учащиеся проделывают с ними разные манипуляции: трясут, пробуют удержать на ребре ладони, испытывают на действие магнита и т. д.
Подводят итог.
Вывод: нужны опыты, нужен эксперимент.
Прежде, чем мы выясним более подробно, что такое атом, ответьте на вопрос:
- Как вы представляете себе строение атома?
В 1911 году английский физик Эрнест Резерфорд исследовав строение и состав атома на основе радиоактивности, которая доказала сложность строения атома, предложил ядерную (планетарную) модель атома.
Эти опыты доказали делимость атома.
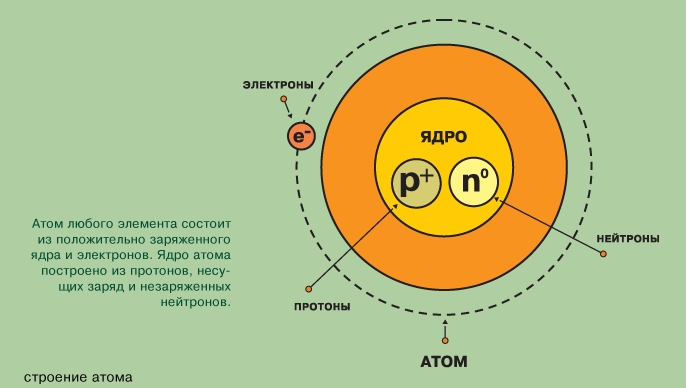
 АТОМ
АТОМ

ЯДРО (+) Электроны

 (-)
(-)
Протоны Нейтроны
(+) (0, нет заряда)
Атом состоит из элементарных частиц: протонов, электронов о нейтронов. Давайте рассмотрим их физические характеристики.
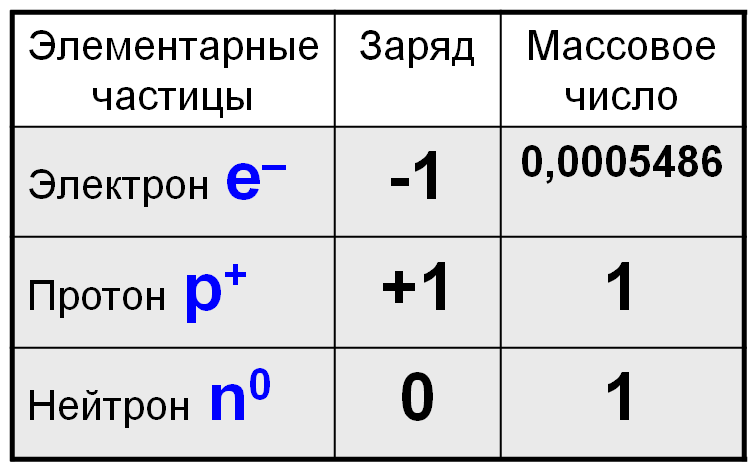
Теперь давайте расположим их в атоме:
Откроем ПС химических элементов. Отметим себе, что порядковый номер элемента, это не просто номер по порядку, а он имеет физический смысл.
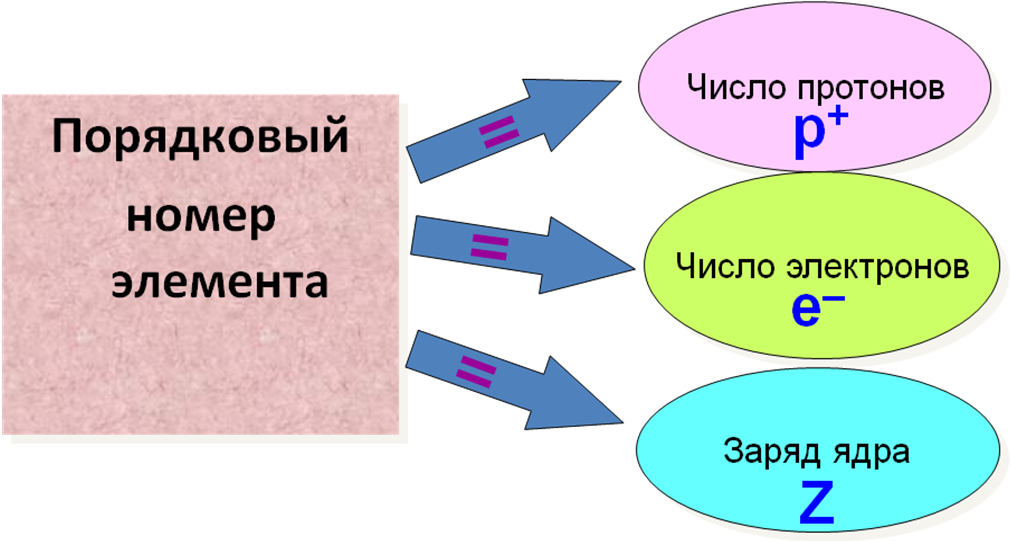
Если число электронов и число протонов равно порядковому номеру, то каким будет заряд ядра? (нейтральным)
 Давайте
отметим, что атом - электронейтральная частица.
Давайте
отметим, что атом - электронейтральная частица.
Давайте попробуем посчитать количество протонов, электронов и нейтронов в атоме гелия.
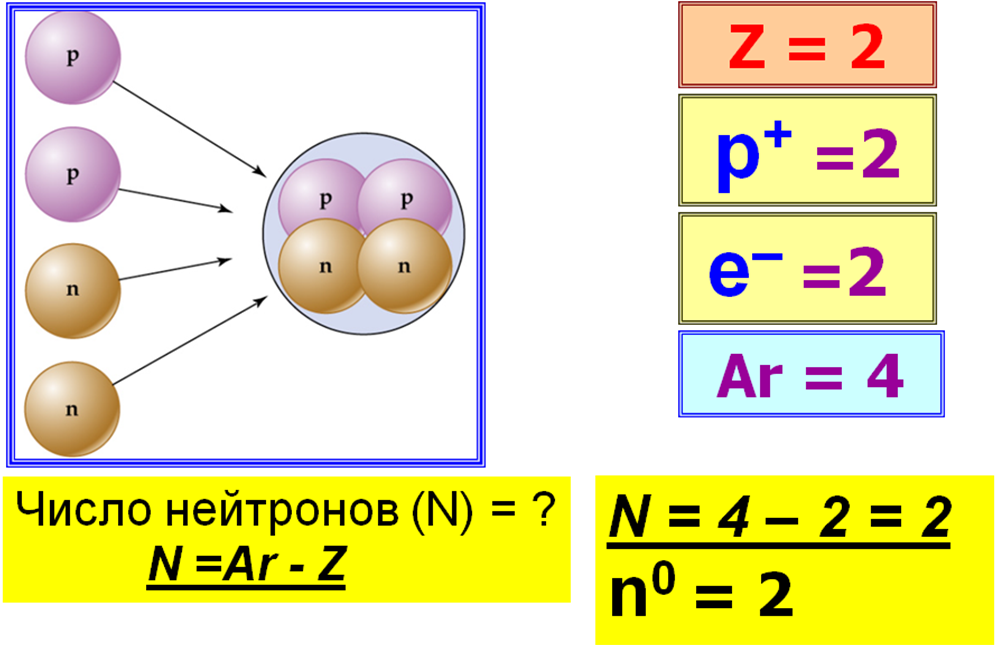
3. Закрепление материала:
Молодцы. Теперь давайте посчитаем количество элементарных частиц для атомов:
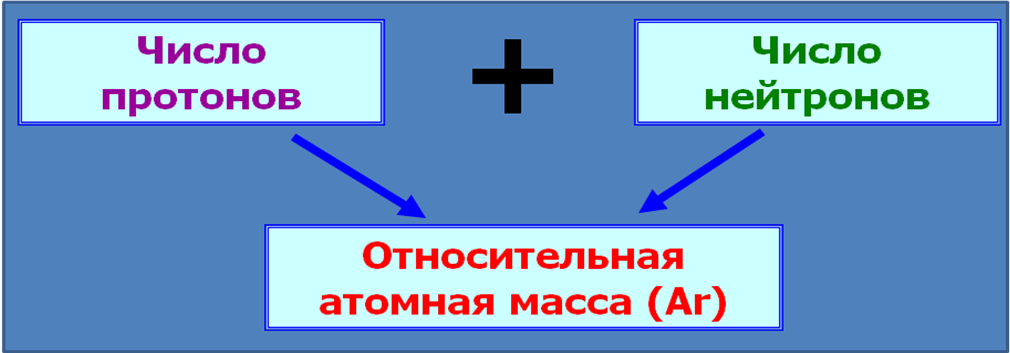
Водорода Z=1, e = p =1, Ar =1, 1-1=0, n =0
Углерода Z=6, e = p =6, Ar =12, 12-6=6, n =6
кислорода Z=8, e = p =8, Ar =16, 16-8=8, n =8
азота Z=7, e = p =7, Ar =14, 14-7=7, n =7
4. Выводы:
1. Атом - это сложная система, состоящая из ядра и электронов.
2. Ядро находится в центре атома и имеет очень маленький размер, но почти вся масса атома сосредоточена в ядре.
3. Ядро имеет положительный заряд, величина которого определяется числом протонов в нем.
4. Электроны движутся вокруг ядра, имеют очень маленькую массу и размеры, обладают отрицательным зарядом.
5. Атом электронейтрален, число протонов равно числу электронов и равно порядковому номеру элемента.
5. Тестовые задания:
Заряд ядра атома азота равен :
а) 7 б) 13 в) 4 г) 29 д) 11
Число протонов в ядре атома криптона :
а ) 36 б) 17 в) 4 г) 31 д) 6
Число нейтронов в ядре атома цинка :
а) 8 б) 35 в)11 г)30 д)4
Число электронов в атоме железа :
а) 11 б)8 в)56 г)26 д)30
6. Домашнее задание:
Заполни таблицу:

В оставшееся время можно предложить ученикам загадки:
Загадайте, пожалуйста, химический элемент. Его порядковый номер умножьте на 2, прибавьте к этому произведению 5. Теперь всю сумму умножьте на пять.
По очереди говорите мне ответ, а я скажу вам порядковый номер вашего загаданного элемента.
(Разгадка: От предложенного ответа необходимо отбросить последнюю цифру и вычесть от оставшегося числа 2. Получится порядковый номер задуманного элемента в таблице Д.И.Менделеева).
Очень положительный
С массою внушительной,
А таких, как он, отряд
Создает в ядре заряд.
Лучший друг его - нейтрон.
Догадались? Он-….(протон)!.
Зарядом я похвастать не могу,
А потому сижу в ядре и ни гу-гу.
А то еще подумают: шпион,
А я нейтральный и зовусь…(нейтрон)!
</ Он бежит по проводам,
Он бывает тут и там,
Свет зажег, нагрел утюг
…. - наш лучший друг.
Если в атом он попал -
То считай почти пропал:
Он с утра и до утра
Носится вокруг ядра. (электрон)