- Учителю
- Конспект конкурсного урока химии по теме Водород
Конспект конкурсного урока химии по теме Водород
 Районный конкурс
Районный конкурс
«Учитель года России-2017»
Конкурсное задание «Учебное занятие»
Чернова Надежда Викторовна
МБОУ Кринично-Лугская СОШ
Тема: Водород.
Эпиграф к уроку:
Если вчера человечество благоговело перед новым видом энергии -электричеством</</font>, а позавчера перед паровым котлом, то сегодня мы управляем реакцией распада атомного ядра, а завтра будем управлять реакцией синтеза ядер -создадим земные солнца!
Д. И.Щербаков
Цели:
Образовательные: организовать деятельность учащихся по систематизации и развитию знаний о водороде как самом распространенном химическом элементе во Вселенной; расширить их представления о химических и физических свойствах водорода, способах его получения и применении; на примере водорода показать окислительно-восстановительную двойственность неметаллов; закрепить умения работать с лабораторным оборудованием.
Развивающие: развивать умения устанавливать межпредметные связи между химией, биологией, физикой, историей, экологией, литературой, информатикой; выдвигать гипотезы и находить их подтверждения; продолжить развитие умений учащихся самостоятельно работать с дополнительной литературой и Интернет-ресурсами.
Воспитательные: создать условия для формирования научного мировоззрения, умения работать в группе, объективно оценивать работу товарищей, воспитывать коммуникационные способности учащихся; обеспечить условия для экологического просвещения учащихся.
Методические задачи:
-
Продолжить формирование понимания зависимости между составом, строением, свойствами и применением веществ на примере водорода;
-
Используя интерактивные формы организации урока, создать условия для усвоения обучающимися основных знаний по изучаемой теме;
-
Продолжить развитие умений обучающихся работать с информационно-коммуникатиционными источниками; развивать логическое мышление, умение анализировать и сравнивать;
-
Способствовать экологическому воспитанию обучающихся через знакомство с темами «Водород на службе у человека», «Водород в природе».
Методы: Эвристическая беседа, групповая работа, рассказ, лабораторные опыты, элементы игры.
Оборудование и реактивы: Прибор для получения газов, пробирки, цинк, соляная кислота, спиртовка, спички, лабораторный штатив, мультимедийный проектор, компьютер, стенд «Правила техники безопасности при проведении лабораторных опытов».
Ход урока
-
Организационный момент. Мотивирование к учебной деятельности.
Учитель. Здравствуйте, ребята!
Советский учёный Д.И.Щербаков говоря о развитии науки сказал:
Если вчера человечество благоговело перед новым видом энергии -электричеством, а позавчера перед паровым котлом,
то сегодня мы управляем реакцией распада атомного ядра,
а завтра будем управлять реакцией
синтеза ядер - создадим земные солнца!
Действительно человечество шагает семимильными шагами, наука не стоит на месте людям уже многое известно об источнике жизни на нашей планете -солнце
Фильм 10 интересных фактов о солнце
Попробуйте отгадать о каком элементе мы будем сегодня говорить?(слайд1)
Газ этот легок и летуч,
Он очень может быть могуч:
Его нагрев неосторожно,
Взорвать в округе все возможно,
А если с «О» соединить,
То можно воду получить.
Я много вам о нем сказала,
Его подробно описала.
Итак, подумав, пять минут,
Скажите, как его зовут?( водород)
Учитель. Какая же тема сегодняшнего урока ?
Учащиеся: «Водород».
Учитель: Вы ранее слышали об этом веществе? Что вы о нём знаете? А что хотели бы узнать?



Физические свойства
Строение атома
Положение в ПСХИ
Историю открытия
Способы получения
Химические свойства
применение
Исходя из этого кластера сформулируйте цель нашего урока.
Учащиеся: Более глубокое знакомство с химическим элементом и простым веществом водородом.
II.Основная часть.
1.Актуализация знаний.
Учитель. При изучении курса химии мы неоднократно встречались с водородом. Пришло время обобщить и расширить знания об этом химическом элементе, познакомиться с областями и перспективами его применения.
Проблема
Посмотрите внимательно на периодическую таблицу. Найдите в каком периоде и в какой группе находится водород? В первом периоде в первой и седьмой группах. А как вы думаете, почему водород в двух группах? Это проблема для вас? Сегодня мы с вами на уроке и будем работать над решением этой проблемы.
Историческая справка. В трудах химиков 16 и 17
веков неоднократно упоминалось о выделении горючего газа при
действии кислот на металлы. В 1766 году Г. Кавендиш собрал и
исследовал выделяющийся газ, назвав его "горючий воздух". Будучи
сторонником теории флогистона, Кавендиш полагал, что этот газ и
есть чистый флогистон. В 1783 году А. Лавуазье путем анализа и
синтеза воды доказал сложность ее состава, что в её состав входит
«горючий газ», а в 1787 А. Гитон де Морво французский химик
определил "горючий воздух" как новый химический элемент (Водород) и
дал ему название hydrogene (от греч. hydor - вода и gennao -
рождаю), что означает "рождающий воду"; этот корень употребляется в
названиях соединений Водорода и процессов с его участием (например,
гидриды, гидрогенизация). Современное русское наименование
"Водород" было предложено М. Ф. Соловьевым в 1824 году.
2. Этап усвоения новых знаний (20 мин.)
Ребята, для активизации вашей работы мы разделимся на 2 группы. И работать будем на время. В каждой команде вы должны будете выбрать капитана и хранителя времени. Капитан определяет кто из участников команды отвечает на поставленный вопрос, а хранитель времени следит за временем, выделенным на задание. Команда первой правильно ответившая на поставленный вопрос получает житон, если команда отвечает неверно право ответить переходит команде сопернице.
Давайте с вами разберемся, почему водород занимает двойственное положение в ПСХЭ.
-
Строение атома водорода
- Назовите «адрес проживания» водорода.
1. обсуждение в группе (1 минута)
(1 ученик работает у доски - составляет схему строения атома водорода, остальные пишут в тетради, демонстрируется слайд)
Характеризуя водород по положению в периодической системе
химических элементов Д. И. Менделеева, следует обратить внимание на
особенности строения атома водорода - самого простейшего из
химических элементов (состоит из ядра, представляющего собой один
протон, и одного электрона).
Символ - Н; порядковый номер - 1; массовое число - 1.
Наиболее распространенная степень окисления водорода + 1. Водороду свойственна валентность, равная единице.
Молекула водорода двухатомная, связь ковалентная неполярная.
Вывод: строение обусловливает разнообразие свойств водорода, его двойственное положение в системе Д. И. Менделеева - в I и VII группах, т.е. у него как у элементов 1 группы 1 электрон на внешнем уровне, а также до завершения первого уровня ему не хватает одного электрона как элементам 7 группы.
-
Физические свойства водорода
Демонстрация видеофрагмента «Водород»
Водород - газ без цвета и запаха, плохо растворим в воде, в 14,5
раз легче воздуха.
Водород - самый распространенный элемент во Вселенной. На Земле
водород содержится в воде, природном газе, нефти.
-
Химические свойства водорода
Учитель организует работу в группах по изучению химических свойств водорода и подводит к выводу об ОВ свойствах водорода
1 команда ; Выберите из предложенных реакций те, в каких водород является окислителем
2 команда выбирает реакции, в которых водород является восстановителем.
Учитель в это время даёт информацию:
При обычных условиях молекулярный Водород сравнительно мало активен, непосредственно соединяясь лишь с наиболее активными из неметаллов (с фтором, а на свету и с хлором). Однако при нагревании он вступает в реакции со многими элементами. Атомарный Водород обладает повышенной химической активностью по сравнению с молекулярным.
а) С кислородом Водород образует воду:
2Н2 + О2 = 2Н2О + Q (285,937 кДж/моль)
Восстановитель Н 0 - 1е = Н+1 - окисление
Окислитель О0 + 2е = О-2 - восстановление
При обычных температурах реакция протекает крайне медленно, выше 550°С - со взрывом. Пределы взрывоопасности водородо-кислородной смеси составляют (по объему) от 4 до 94% Н2, а водородо-воздушной смеси - от 4 до 74% Н2 (смесь 2 объемов Н2 и 1 объема О2 называется гремучим газом).
Не шутите с Водородом!
Он горит, рождая воду,
В смеси с Кислородом-братом
Он взрывается, ребята!
Вам скажу на всякий случай -
Эту смесь зовут « гремучей».
В
окислитель
восстановитель
процессе работы представители команд выходят к доске и
размещают карточки с примерами реакций по надписями
б) С галогенами Водород образует галогеноводороды, например:
Н2 + Cl2 = 2НСl хлороводород
в) С азотом Водород взаимодействует с образованием аммиака:
3Н2 + N2 = 2NН3
лишь на катализаторе и при повышенных температуpax и давлениях.
г) При нагревании Водород энергично реагирует с серой:
Н2 + S = H2S (сероводород)
д) С чистым углеродом Водород может реагировать без катализатора только при высоких температуpax:
2Н2 + С (аморфный) = СН4 (метан)
е) Водород непосредственно реагирует с некоторыми металлами (щелочными, щелочноземельными и другими), образуя гидриды:
Н2 + 2Li = 2LiH
Li0 - 1e = Li+1 окисление.
(Восстановитель)
H0 + 1e = H-1 восстановление. (Окислитель)
2. Взаимодействие со сложными веществами: CuO + H2 = Cu + H2O
Учитель. Ребята, а теперь объясните, почему водород в периодической системе химических элементов расположен в двух местах, исходя из полученных сегодня на уроке знаний. А почему в 7 группе он в скобках?
Вывод: С металлами водород является окислителем (как галогены), а с неметаллами и со сл. веществами- восстановителем (как ЩМ), поэтому его располагают и в 1 и 7 группах.
Водород, водород - элемент наоборот!
От щелочных металлов не отстал и
И к галогенам не пристал!
-
Основные способы получения
Проблемный вопрос: Если бы перед вами стояла задача: получить большое количество водорода:
- Какое сырье вы бы выбрали и почему?
Учащиеся: Воду! Она доступна, её много.
Учитель: Да, верно, вода - самый доступный источник водорода. Действительно, в промышленности получают водород из воды действием тока, идет реакция разложения воды с образованием двух веществ: водорода и кислорода.
.
-
В лаборатории водород получают при взаимодействии металлов с растворами кислот, например соляной:
Zn + 2HCl = ZnCl2 + Н2
Лабораторный опыт
3. Творческое задание для групп
Перед вами на карточках изображены два способа собирания водорода. Предложите название способа, и на каком физическом свойстве водорода он основан?
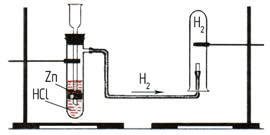
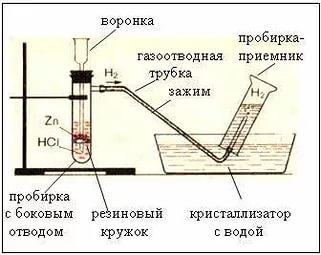
метод вытеснения воздуха методом вытеснения воды
водород легче воздуха водород не растворяется в воде
4. Области применения водорода. Работа с учебником
Следующим заданием для команд будет определить области применения водорода. Как только вы определили область применения водорода, вы её вписываете в приготовленный для вас кластер. Как только все ячейки кластера будут заполнены, представитель команды вывешивает его на доке, побеждает команда первой заполнившая кластер.
Учитель: Наработав в
достаточном количестве этот легкий газ,
люди сначала приспособили его для воздушных полетов.
В этом качестве первый элемент ПСХЭ Д.И. Менделеева применяли
вплоть до 1937 года, когда в воздухе сгорел крупнейший в мире,
размером в два футбольных поля, заполненный водородом немецкий
дирижабль «Гинденбург». Катастрофа унесла жизни 36 человек. С тех
пор аэростаты заправляют исключительно гелием. Гелий - газ более
плотный, но зато негорючий.
(Фильм об этой трагедии я вам приготовила для домашнего просмотра)
Советские аэростаты воздушного заграждения сыграли огромную роль в ВОВ. Они предназначались для защиты наиболее важных объектов от нападения пикирующих и низколетящих самолетов. Аэростатные заграждения наряду с другими средствами противовоздушной обороны препятствовали снижению немецких бомбардировщиков для прицельного бомбометания. В целом над Москвой за Великую Отечественную войну аэростатными заграждениями было уничтожено 150 самолетов противника.
Учитель: Ум человеческий безграничен он смог создать из водорода смертоносное оружие - водородную бомбу, которая по своей мощности в разы превышает ядерную бомбу. 1 марта 1954 году берегов кораллового острова Бикини американцы испытали до селе неизвестное оружие, последствия оказались ужасающими на площади в один миллион миль рыба оказалась отравленной , на площади в 4 тысячи миль люди получили радиоактивное заражение. Люди должны задуматься о том, что водород нужно использовать только в мирных целях, чтобы он приносил только пользу человечеству.
-
Кейс-технология
Перед вами выдержки из научно-популярной литературы, прочтите их и ответьте на вопрос в низу текста. На эту работу вам 3 минуты.

Ученые придумали, как использовать водород в качестве
горючего и при этом не взорваться. В газ стали добавлять
специальные присадки-ингибиторы (химические «тормоза»). Например,
пропилен. Всего 1% этого дешевого газа - и водород из грозного
оружия превращается в безопасный газ.
В 1979 г. компания BMW выпустила первый автомобиль, вполне успешно
ездивший на водороде, при этом не взрывавшийся и выпускавший из
выхлопной трубы водяной пар.
Вопрос: «Если водород обладает такими чудесными характеристиками,
- воскликните вы, - почему же его практически не используют
на автотранспорте?».
Этап закрепления новых знаний (10 мин.)
Индивидуальная работа с ноутбуками. Выполнение тестовых заданий по теме «Водород»
Оценивание до 36 % работы - «2»
36-64 % - «3»
65-85%- «4»
86-100% -«5»
5. Рефлексия
Сейчас мы с вами выполним творческое задание. Расскажем в стихотворной форме о свойствах водорода. Для этого вам предстоит составить синквейн
Пример: Водород
Лёгкий, летучий.
Горит, восстанавливает, окисляет.
Водород - основа жизни!
Нужный!
6.Домашнее задание: § 17, просмотр фильмов:
-Водород
-Взрыв водородной бомбы
-Гибель немецкого дирижабля «Гиндебург»
7.Итог урока
Сегодня я узнал….
Было трудно…..
Я понял, что…..
Меня удивило, что….
Урок дал мне для жизни…..