- Учителю
- ВАЖНЕЙШИЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. РЕАКЦИИ ИОННОГО ОБМЕНА. ВВОДНЫЙ ИНСТРУКТАЖ ПО ТБ
ВАЖНЕЙШИЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. РЕАКЦИИ ИОННОГО ОБМЕНА. ВВОДНЫЙ ИНСТРУКТАЖ ПО ТБ
УРОК 1. ВАЖНЕЙШИЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. РЕАКЦИИ ИОННОГО ОБМЕНА. ВВОДНЫЙ ИНСТРУКТАЖ ПО ТБ
Цель: обобщить знания учащихся.
ЗАДАЧИ:
Образовательная: обобщить, закрепить и систематизировать знания учащихся по темам: «Основные классы неорганических веществ. Реакции ионного обмена».
Развивающая: развивать познавательную активность учащихся, умение систематизировать материал. Совершенствовать навыки и умение учащихся при выполнении лабораторных опытов, вырабатывать умение наблюдать, делать выводы, объяснять ход эксперимента. Развивать умение работать в группах и индивидуально.
Воспитательная: воспитывать добросовестное отношение к учению, желание учиться активно, с интересом. Прививать любовь к химии.
Тип урока: урок усвоения и первичного закрепления новых знаний.
Ход урока
I. Организационный момент.
ТЕТРАДИ ДЛЯ КОНТРОЛЬНЫХ И ПРАКТИЧЕСКИХ РАБОТ
II. Изучение нового материала.
1. Беседа.
Сегодня мы с вами вспомним основные классы неорганических веществ и реакции ионного обмена. Это то, что нам будет встречаться на протяжении дальнейшего изучения химии.
Прежде чем перейти к основным классам неорганических соединений давайте вспомним основные химические понятия: молекулы, атом, химический элемент, вещества.
Молекулы - мельчайшие частицы многих веществ, обладающие химическими свойствами данного вещества и состоящие из атомов, соединенных между собой химическими связями.
Атом - мельчайшая частица химического элемента.
Определенный вид атомов с одним и тем же (+) зарядом ядра характеризует химический элемент.
Химический элемент - совокупность атомов с одинаковым зарядом ядра и числом протонов, совпадающим с порядковым (атомным) номером в таблице Менделеева.
Вещества бывают простые (Н2, О2 и т.д.) и сложные (H2SO4).
Давайте вспомним какие классы неорганических соединений вы учили в 8 классе: оксиды, основания, кислоты, соли.
2. Оксиды.
Оксиды - сложные вещества, состоящие из двух элементов, один из которых кислород в степени окисления -2.
Общая формула ЭxOyОсновные
(им соответствуют основания)
Na2O - NaOH
BaO - Ba(OH)2
Кислотные (соответствуют кислоты)
CO - H2CO3
SO3 - H2SO4
Амфотерные (в зависимости от реагента обладают или основными или кислотными свойствами)
Be(OH)2
BeO
H2BeO2
Химические свойства оксидов
Основные оксиды взаимодействуют:
-
С водой с образованием оснований:
BaO + H2O = Ba(OH)2
K2O + H2O = 2KOH
-
С кислотами с образованием соли и воды:
NiO + 2HNO3 = Ni(NO3)2 + H2O
-
Со щелочами не взаимодействуют (металлы главной подгруппы I группы - Li, Na, K, Rb, Cs, Fr)
-
С кислотными и амфотерными оксидами с образованием солей:
BaO + CO2 = BaCO3
Na2O + BeO = Na2BeO2
Кислотные оксиды взаимодействуют:
-
С водой с образованием кислот:
SO3 + H2O = H2SO4
-
C кислотами не взаимодействуют
-
Со щелочами с образованием соли и воды:
P2O5 + 6KOH = 2K3PO4 + 3 H2O
-
C основными и амфотерными оксидами с образованием солей:
SO3 + Na2O = Na2SO4
SO3 + BeO = BeSO4
Амфотерные оксиды взаимодействуют:
-
С водой не взаимодействуют
-
С кислотами и щелочами с образованием соли и воды:
Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O
Cr2O3 + 6NaOH = 2Na3CrO3 + 3H2O
-
С кислотными и щелочными оксидами с образованием солей.
-
Al2O3 + 3SO3 = Al2(SO4)3.
-
Амфотерный оксид + кислотный оксид = соль
ZnO + CO2 = ZnCO3
-
Амфотерный оксид + основный оксид = соль (при сплавлении)
ZnO + Na2O = Na2ZnO2
Al2O3 + K2O = 2KAlO2
Cr2O3 + CaO = Ca(CrO2)2
Получение оксидов
-
Горение простых веществ в кислороде:
2Mg + О2 = 2МgО
2Сu + О2 = 2СuО
-
Горение сложных веществ:
C2H5OH +3O2 = 2CO2 + 3H2O
-
Разложение при нагревании кислородсодержащих соединений - карбонатов, сульфитов, нитратов, гидроксидов:
ВаСО3 = ВаО + СО2,
Pb(NO3)2 = 2PbO + 4NO2 + O2,
4FeSO4 = 2Fe2O3 + 4SO2 + O2.
3. Кислоты.
Кислоты в растворах диссоциируют на протоны Н+ и кислотные остатки (катионы и анионы)
Классификация кислот
По содержанию атомов кислорода:
-
бескислородные (HCl, H2S);
-
кислородсодержащие (HNO3, H2SO4).
По количеству кислых атомов водорода:
-
одноосновные (HNO3);
-
двухосновные (H2SeO4);
-
трёхосновные (H3PO4, H3BO3);
-
многоосновные.
Химические свойства кислот
1) взаимодействуют со многими металлами, выделяя водород:
Zn +2HCI → ZnCI2 +
H2![]()
2) взаимодействие с основными и амфотерными оксидами:
H2SO4 + Na2O → Na2SO4 + 2H2O.
3H2SO4 + Al2O3 = Al2(SO4)3 + 3H2O
3) взаимодействуют с основаниями:
HCl + KOH = KCl + H2O
4) взаимодействуют с солями:N2CO3 + 2HCl = 2NaCl + CO2 + H2O
4. Основания (гидроксиды)
Основания - это сложные вещества, состоящие из ионов металлов и гидроксид-ионов.
Классификация оснований по следующим признакам:
1. По кислотности (по числу групп ОН- в молекуле основания): однокислотные - NaOH, KOH, многокислотные - Ca(OH)2, Al(OH)3.
2. По растворимости: растворимые (щелочи) - LiOH, KOH, нерастворимые - Cu(OH)2, Al(OH)3.
3. По силе (по степени диссоциации):
а) сильные - все растворимые основания NaOH, LiOH, Ba(OH)2, малорастворимый Ca(OH)2.
б) слабые - все нерастворимые основания Cu(OH)2, Fe(OH)3 и растворимое NH4OH.
4. По химическим свойствам: основные - Са(ОН)2, NaОН; амфотерные - Zn(ОН)2, Al(ОН)3.Взаимодействие с некоторыми простыми веществами (амфотерными металлами, кремнием и другими):
2NaOH + Zn + 2H2O →
Na2[Zn(OH)4] + H2![]()
2NaOH + Si + H2O → Na
2SiO3 + 2H2![]()
Взаимодействие с растворимыми солями с образованием осадков:
2NaOH + CuSO4 →
Cu(OH)2![]() + Na2SO4,
+ Na2SO4,
Ba(OH)2 + K2SO4
→ BaSO4![]() + 2KOH.
+ 2KOH.
5. Соли
Соли - это сложные вещества, состоящие из ионов металла и кислотного остатка.
Химические свойства
Некоторые соли разлагаются при прокаливании:
CaCO3 = CaO + CO2↑
Взаимодействуют с кислотами с образованием новой соли и новой кислоты. Для осуществление этой реакции необходимо, чтобы кислота была более сильная чем соль, на которую воздействует кислота:
2NaCl + H2 SO4 → Na2SO4 + 2HCl↑.
Взаимодействуют с основаниями, образуя новую соль и новое основание:
Ba(OH)2 + Mg SO4 → BaSO4↓ + Mg(OH)2.
Взаимодействуют друг с другом с образованием новых солей:
NaCl + AgNO3 → AgCl + NaNO3 .
Взаимодействуют с металлами, которые стоят в раду активности до металла, который входит в состав соли:
Fe + CuSO4 → FeSO4 + Cu↓.
Взаимодействуют с основными и амфотерными оксидами
2NaOH3 + Na2O = 2NaNO3 + H2O
3H2SO4 + Al2O3 + Al2(SO4)3 + 3H2O
Получение солей. 1.С использованием металлов
металл+неметалл
Mg+Cl2=MgCl2
металл+кислота
Zn+2HCl=ZnCI2+H2![]()
металл+соль
Fe+CuSO4=FeSO4+Cu
2.С использованием оксидов
основной оксид+кислота
CaO+2HCl=CaCl2+H2O
кислотный оксид+основание
CO2+Ca(OH)2=CaCO3![]() +H2O
+H2O
кислотный+основной оксиды
CaO+CO2=CaCO3
основной+амфотерный оксиды
Al2O3+CaO=Ca(AlO2)2
3.Реакция нейтрализации
кислота+основание
H2SO4+2NaOH=Na2SO4+2H2O
4.Из солей
соль+соль
AgNO3+NaCl=AgCl![]() +NaNO3
+NaNO3
соль+щелочь
CuSO4+2NaOH=Cu(OH)2![]() +Na2SO4
+Na2SO4
соль+кислота
Na2CO3+2HCl=2NaCl+H2O+CO2![]()
Кислые соли получают такими же способами, что и средние, но при других мольных соотношениях(при избытке кислоты)
NaOH+H2SO4=NaHSO4+H2O
Основные соли образуются при взаимодействии некоторых солей со щелочами (при избытке щелочи)
ZnCl2+NaOH=ZnOHCl![]() +NaCl
+NaCl
6. Реакции ионного обмена.
Реакции ионного обмена - реакции, протекающие между ионами в растворе электролитов.
Для составления уравнений реакций ионного обмена необходимо помнить следующее:
-
Диссоциации не подвергаются: оксиды, газообразные вещества, вода, нерастворимые в воде соединения
-
Реакция ионного обмена идёт до конца если образуется:
-
газ
-
осадок
-
вода
Алгоритм составления уравнений реакций ионного обмена:
1) Записывают уравнение в молекулярном виде и расставляют коэффициенты:

На этом шаге надо обратить внимание на 2 момента:
-
составление формул продукта реакции (Только по валентности. Можно воспользоваться и таблицей растворимости - заряд иона по модулю равен валентности иона. Напр., чтобы составить формулу, состоящую из катиона бария и сульфат-аниона, мы записываем их рядом. Заряд катиона бария - 2+ , а значит его валентность равна II, заряд сульфат аниона - 2-, а следовательно, валентность также равна II. Т.о. формула BaSO4) Повторить тему
Валентность</</font> -
расстановка коэффициентов (число атомов одного и того же элемента справа и слева должно быть одинаково)
2) Записывают уравнение в ионном виде.
Для этого необходимо посмотреть в таблицу растворимости. Если вещество растворимо - его записывают в виде ионов (на пересечение которых смотрели, чтобы определить растворимо ли вещество). Если вещество нерастворимо - записывают в молекулярном виде:
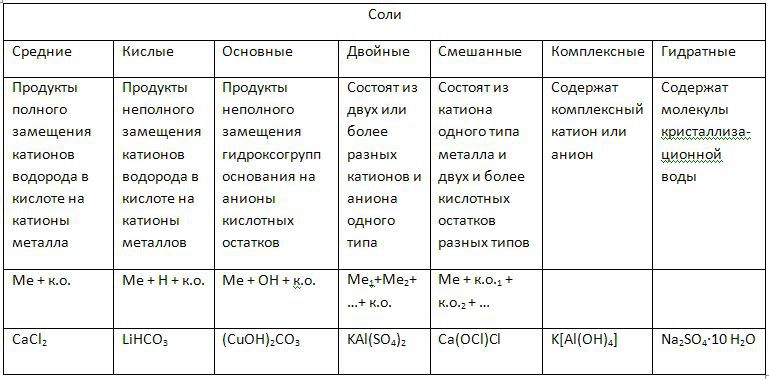
Хлорид бария - растворим, значит записываем его в виде ионов бария и хлора. При этом необходимо помнить о коэффициентах и индексах. (напр., BaCl2 состоит из бария и 2-х хлоров, поэтому индекс «2» мы будем ставить перед анионами хлора):
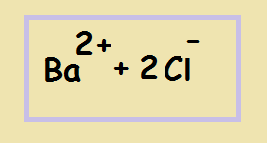
Смотрим на растворимость серной кислоты - растворима, записываем в виде протонов водорода и сульфат-анионов (т.к. в серной кислоте 2 атома водорода - значит при её диссоциации образуется 2 протона):
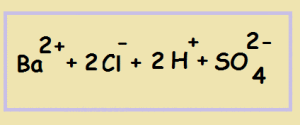
Далее переходим к продуктам реакции и снова смотрим, растворимы ли они. Сульфат бария - не растворим, значит его мы записываем в молекулярном виде:
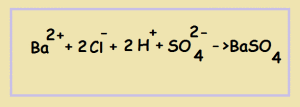
Соляная кислота: растворима, записываем в виде ионов. Т.к. перед формулой стоит коэффициент «2» - мы ставим его и перед ионами:
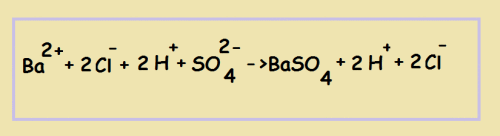
Т.о. появилась 2 строчка - уравнение в ионном виде.
3) Составляем уравнение в сокращённом ионном виде. Для этого мы вычёркиваем те ионы, которые повторяются слева и справа (т.е. не участвуют в реакции):
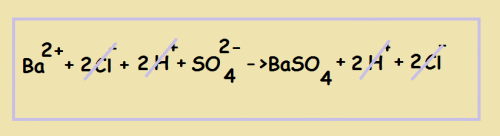
Оставшиеся частицы переписываем. Это и будет сокращённым ионным уравнением:
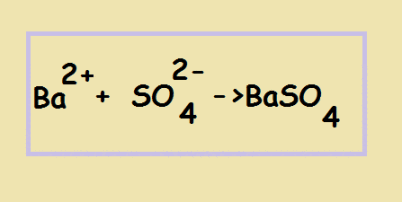
Т.о. мы видим, что в результате взаимодействия катионов бария с сульфат-анионами образуется нерастворимое в воде соединение - сульфат бария (осадок белого цвета)
III. Закрепление.
Задание 1.
Распределите вещества по классам: HNO3, Al2O3, FeO, H2SO4, NaCl, NaOH, Na2O, HCl, K2CO3.
Задание 2. Составьте ионные уравнения для следующих реакций
![]()
![]()
Задание 3.
Составим молекулярное и ионно-молекулярные уравнения реакции между растворами хлорида железа(III) и гидроксида натрия.
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
Fe3+ + 3Cl - + 3Na+ + 3OH - = Fe(OH)3↓ + 3Na+ + 3Cl -
Fe3+ + 3Cl - + 3Na+ + 3OH - = Fe(OH)3↓ + 3Na+ + 3Cl -
Fe3+ + 3OH - = Fe(OH)3↓
IV. Рефлексия.
Что нового вы узнали на уроке?
Что вызвало у вас затруднение?
V. Подведение итогов. Оценивание.
VI. Д/з.: Выучить записи в тетради.
Составить реакции ионного обмена:
1) KOH + HCl = KCl + H2O
2) CaO + 2HNO3 = Ca(NO3)2 + H2O
3) CuCl2 + 2KOH = 2KCl + Cu(OH)2↓
4) Al2(SO4)3 + 3BaCl2 = 3BaSO4↓ + 2AlCl3
5) K2S + 2HCl = 2KCl + H2S↑.
6) Na2CO3 + 2HNO3 = 2NaNO3 + H2O + CO2↑