- Учителю
- Урок по химии для 9 класса по теме Фосфор и его соединения
Урок по химии для 9 класса по теме Фосфор и его соединения
Тема: Фосфор и его соединения
Цель урока:
Познакомиться с фосфором - химическим элементом и простым веществом.
Задачи:
Образовательные:
Продолжить формирование умения устанавливать связь между строением атома фосфора, простого вещества фосфора и аллотропных модификаций; изучить свойства образованного им кислотного оксида, кислоты и области применения.
Развивающие:
Способствовать совершенствованию навыков самостоятельной работы; развивать логическое мышление учащихся, памяти, химического языка; умение самостоятельно делать выводы; развивать монологическую речь.
Воспитательные:
Способствовать развитию познавательного интереса к предмету, расширению кругозора учащихся; воспитывать культуру умственного труда, культуру общения; показать возможность использования полученных на уроках знаний в жизни, воспитывать в учениках средствами урока уверенность в своих силах.
Тип урока:
Урок изучения нового материала.
Методы:
-
По источнику передачи и восприятия информации:
А) словесные (рассказ, беседа, объяснение);
Б) наглядные (наблюдение опыта, таблиц (растворимости, Д.И. Менделеева, «Аллотропные модификации фосфора»).
2. По степени самостоятельности мышления учащихся:
А) репродуктивный (объяснительно - иллюстративный);
Б) продуктивный (частично - поисковый).
3. По характеру управления учебной работой:
А) под руководством учителя;
Б) самостоятельная работа.
4. По стимулированию интереса к учению - создание ситуации занимательности.
5. Методы контроля:
А) самоконтроль;
Б) контроль учителя.
Средства обучения:
1) Учебно - технические (мультимедийное оборудование)
2) Дидактико - методические
(карточки - задания)
Форма организации учебной работы: фронтальная, индивидуальная, парная.
Хронометраж:
-
Оргмомент-(1 мин)
-
Актуализация знаний-(2мин)
-
Целеполагание - (2мин)
4. Объяснение нового материала- (25 мин)
5. Закрепление -(7 мин)
6. Подведение итогов занятия и выставление оценок-(3 мин)
Содержание
и ход урока
Обоснование деятельности учителя
Прогнозирование
деятельности учащихся
-
Оргмомент.
Учитель приветствует учеников, отмечает отсутствующих, оценивает готовность учащихся к уроку.
-
Актуализация знаний.
У каждого из нас есть свой адрес: это улица, дом, квартира. У химических элементов то же есть свой «дом».
Как он называется? (периодическая таблица химических элементов Д.И. Менделеева).
Какие адреса имеют химические элементы? (группу, подгруппу, период).
Какой номер квартиры у каждого из них? (порядковый номер).
3. Целеполагание.
Сегодня мы познакомимся с одним из удивительных жильцов этого большого дома.
А о ком идет речь, мы и должны выяснить из следующей загадки:
В руках алхимиков впервые
В подвале мрачном засиял,
И чудесами всех факиров
Он многие века снабжал.
(Фосфор)
Как бы вы сформулировали тему сегодняшнего урока?
(Фосфор и его соединения).
Сейчас мы отправимся в путешествие, чтобы лучше познакомиться химическим элементом фосфором. Для этого нам понадобится маршрутная карта (у учителя заранее заготовленная на доске, а у детей в тетради из предыдущего урока, когда изучался химический элемент азот).
Внимательно рассмотрите ее. Давайте вспомним, а на каких станциях мы побывали при изучении темы «Азот»? («Происхождение элемента», «Степень окисления» «Физические свойства», «Химические свойства», «Значение»). Сегодня мы побываем на этих станциях для того, чтобы познакомиться с фосфором. Каждая их этих станций поможет нам раскрыть особенности строения фосфора таким образом, что некоторые поделятся с нами новым материалом, на других мы будем выполнять задания.
-
И
 зучение
нового материала.
зучение
нового материала.
Станция № 1.
«Открытие элемента».
Слово учителя:
Элемент был назван «светоносным»
За то, что в полной темноте
Свет испускает белый фосфор
В воздушной находясь среде.
Элемент был открыт в 1669 году гамбурдским алхимиком Х. Брандом при перегонке сухого остатка от выпаривания мочи. Алхимик думал, что это философский камень, который способен превращать неблагородные металлы в благородные. Затем Х. Брандт продает свой секрет дрезденскому алхимику Крафту, который оказался более предприимчивым. Изготовив достаточное количество фосфора, Крафт отправляется в длительный вояж по Европе, где с большим успехом демонстрировал его свойства знатным особам, извлекая большую выгоду. Только спустя 74 года, Один из ведущих химиков того времени Андрей Маркграф открыл более совершенный способ получения фосфора и опубликовал его в « Записках Берлинской академии». С этого момента начинается систематическое изучение светоносного элемента и его соединений. Итак, теперь мы знаем, как и кем был открыт фосфор, давайте выясним, какова систематика этого элемента. Переходим на станцию №2

Станция №2
«Положение элемента в периодической таблице Д.И. Менделеева».
Перед вами стоит следующая задача:
Определить местоположение элемента в периодической таблице Д.И. Менделеева по следующему плану.
-
Порядковый номер
-
Группа (подгруппа)
-
Период
-
Распределение электронов по уровням
-
Электронная формула
Делаете задание самостоятельно, используя таблицу Д.И. Менделеева, а
к доске идет 1 человек. Задание сразу проверяется.
Знания, полученные на этой станции, помогут сделать задания на следующей станции. Таким образом, мы уже с вами переходим на станцию №3
Настроить учащихся на рабочий ритм урока.
Обеспечить комфортную обстановку на уроке, снять напряжение, активизировать познавательную деятельность учащихся.
Подготовить к постановке цели урока.
Самостоятельная постановка темы урока способствует положительному настрою на работу.
Ученики должны осознать, что именно им придется изучить и освоить, какова основная задача предстоящей работы.
Усилить эмоциональный аспект при изучении темы «Фосфор».
Использовать репродуктивный метод, с целью формирования умения давать характеристику элемента.
Осуществить обратную связь с учащимися с целью корректировки неточности в усвоении понятий.
Готовность класса к уроку.
Вспоминают необходимые знания, используя ранее изученный материал.
Анализируют сказанное, делают свои предположения.
Ученики становятся активными участниками урока.
Создается ясная и четкая перспектива работы. Учащиеся принимают учебную задачу.
На этом этапе реализуются образовательная задача. Учащиеся узнают новые факты, связанные с открытием фосфора.

Отрабатывают навыки работы с периодической таблицей Д.И. Менделеева.

Активность учащихся оценивается накоплением плюсиков.

Станция №3
«Степень окисления элемента»
Перед вами ребята стоит следующая задача: найти высшую и низшую степень окисления, а также промежуточную степень окисления. Прежде чем выполнить задание, давайте вспомним: чему равна высшая степень окисления, а чему низшая. ( Высшая = номеру группы, а низшая № - 8)
Вы делаете самостоятельно в тетради, а к доске идет 1 ученик.
Высшая степень окисления =+5
Низшая степень окисления =-3
Следующее задание заключается в том, чтобы
закончить уравнения химических реакций и выяснить, какими свойствами обладает фосфор - окислительными или восстановительными по отношению к металлу и неметаллу.
2P+3Mg =Mg3P
(окислитель)
4P+5O2 =2P2O5
(восстановитель)
Итак, мы выяснили окислительные и восстановительные способности фосфора, а теперь попытаемся выяснить следующую способность фосфора. Переходим на станцию №4.
Станция №4
«Физические свойства».
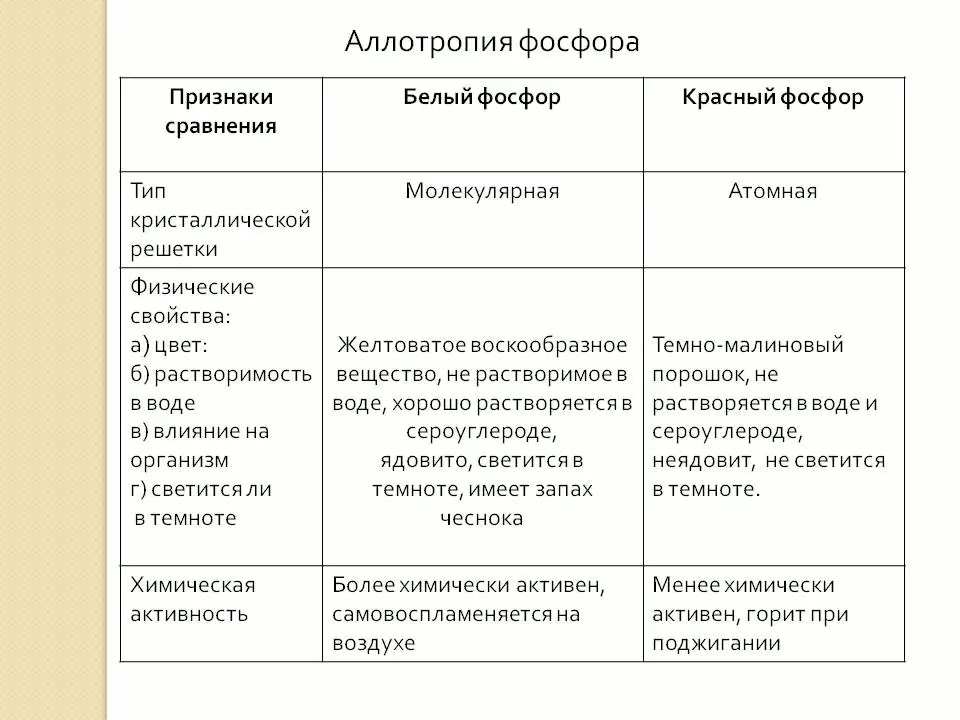
Давайте вспомним, что такое аллотропия. Какие вы знаете аллотропные модификации? При изучении каких тем вы с ними сталкивались?
(это способность одного химического элемента образовывать несколько простых веществ, например кислород и озон, сера ромбическая, сера пластическая).
Рассказ учителя:
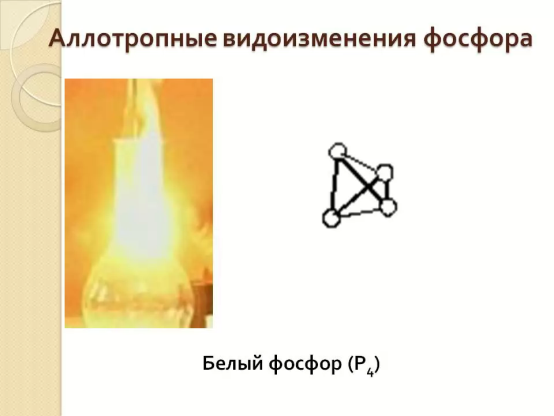
Есть фосфор белый, фосфор красный -
Две аллотропных формы есть.
Вот белый: это яд опасный, Слегка нагреешь - вспыхнет весь.
Используется плакат «Аллотропные модификации фосфора»
Водородное соединение фосфора называвется фосфин. Оно менее прочное соединение, чем аммиак, и более реакционноспособное.
Существует очень много суеверий и легенд, рассказывающих о том, что на кладбищах и болотах блуждают огни. Фантазия народная испокон веков заселяла кладбища душами грешников, выходящими по ночам из могил. Дело в том, что эти огни обязаны своим происхождением биохимическим и химическим процессам. Растительные и животные остатки содержат фосфор. Попадая в почву, они под действием влаги, тепла и микроорганизмов разлагаются. В результате выделяется фосфин, который активно реагирует с кислородом воздуха. Реакция сопровождается выделением большого количества тепла. Здесь происходит воспламенение фосфористого водорода. Чтобы подтвердить выше сказанное давайте напишем уравнение химической реакции горения фосфина. Перед этим вспомним правило: Что образуется при горении сложных веществ? (оксиды тех элементов, которые входят в состав этого сложного вещества).
Вы делаете самостоятельно задание, а к доске идет 1 ученик.
2РН3 + 4О2 =Р2О5+ 3Н2О
Задание проверяется.
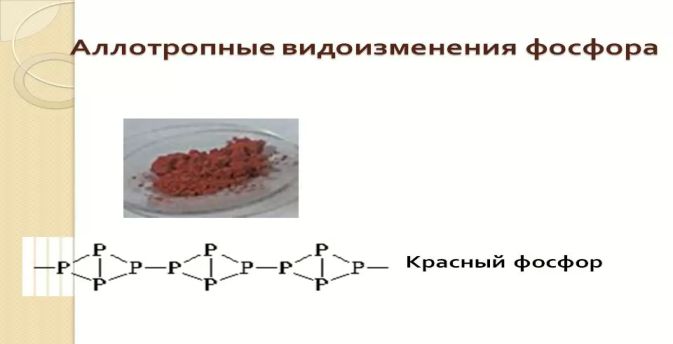
Известен людям фосфор красный,
Ведь спички зажигают все.
В составе смеси безосной
Он есть на каждом коробке.
Запомним в спичечной головке
Смесь серы с солью Бертолле
Мы чиркнем спичкой о головку
И в миг окажемся в тепле. (Учитель демонстрирует горения спички). Интересно отметить, что спички появились только 120 лет назад, а до конца 19 века огонь добывался исключительно при помощи кремня и огнива.
Итак, красный фосфор используется в производстве спичек. Что произойдет, если взять большое количество красного фосфора и бертолетовой соли? Смотрим на экран.
1) Наблюдение взрыва красного фосфора и бертолетовой соли.
Давайте теперь посмотрим как красный фосфор превращается в белый. Демонстрация опыта
2)Превращение красного фосфора в белый
Вопрос:
Посмотрите внимательно на таблицу и ответьте:
В чем причина резкого отличия красного фосфора от белого.
(отличие в результате разного строения кристаллических решеток). Мы выяснили способность фосфора образовывать аллотропные модификации. Теперь выясним способность фосфора вступать в химические реакции. Переходим на станцию №5.
Станция № 5 «Химические свойства»
Давайте составим генетический ряд фосфора
P-P2O5-H3PO4
А как доказать, что фосфорный ангидрид действительно обладает кислотными свойствами.
Давайте посмотрим на экран.
3) Наблюдение взаимодействия фосфорного оксида с водой.
Давайте вспомним типичные свойства кислотных оксидов и кислот.
Вопрос:
Что получается при взаимодействии
1.кислотного оксида с водой?
2.кислотного оксида с основанием?
3.кислотного оксида с основным оксидом?
4.кислоты с основанием?
5.кислоты с металлом? Будет ли проходить эта реакция?
6.кислоты с солью?
7.кислоты с основным оксидом?
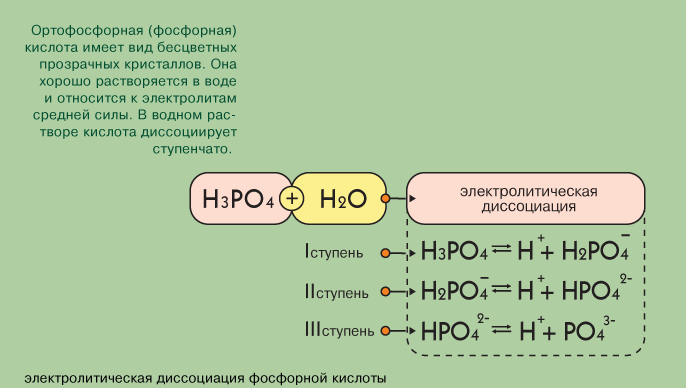
Рассмотрим фосфорную кислоту.
Какая она? (трехосновная), значит фосфорная кислота способна образовывать 3 ряда солей. Давайте вспомним диссоциацию фосфорной кислоты.
В первом случае образуется дигидрофосфат ион, во втором - гидрофосфат ион, в третьем - фосфат ион.
А теперь перед вами задание.
Составьте формулы
-
дигидрофосфата кальция
-
гидрофосфата кальция
-
фосфата кальция.
К доске идет 1 человек, а все остальные учатся составлять самостоятельно в тетради с дальнейшей проверкой. Мы с вами выяснили физические, химические свойства фосфора, его систематическое положение. Возникает вопрос:
а каково значение фосфора? Чтобы это выяснить,
мы переходим на станцию № 6. 
Станция № 6
«Значение».
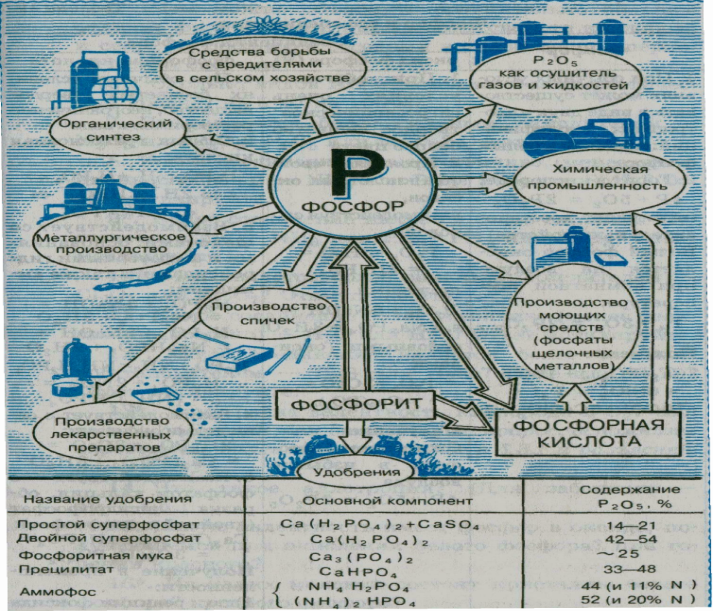
Посмотрите внимательно на лист (области применения фосфора). Прочитайте стихотворение и найдите подтверждение написанных слов о фосфоре по рисунку. Давайте ответим на вопрос:
где же нашел применение фосфор?
( в производстве спичек, лекарственных препаратов, органическом синтезе металлургическом производстве и т.д.)
-
Закрепление
Свойства кислоты и кислотных оксидов мы повторили, а теперь давайте попробуем закончить уравнения химических реакций и расставить коэффициенты.
(у каждого ученика карточка с заданием, работа на 2 варианта).
Давайте проверим то, что вы написали. Поменяйтесь своим вариантом с соседом и проверьте правильность написания работы (на обратной стороне доски готовые задания, с помощью которых учащиеся сверяют написанное). Поставьте 5 баллов, если ни одной ошибки в работе, 4 балла - 1 ошибка, 3 балла - 2 ошибки, 2 балла - 3 ошибки.
-
Подведение итогов занятия. Выставление оценок.
Загляните внимательно к себе в тетрадь. У вас получился небольшой опорный конспект. Давайте теперь вспомним тему нашего урока. Скажите:
-
что вам было интересно на уроке?
-
с какими трудностями столкнулись?
-
Имеют ли для вас знания полученные на уроке?
Спасибо за урок.
Развить у учащихся логическое мышление (на основе причинно - следственной связи) путем создание проблемной ситуации.
Подготовить учащихся к формулировке вывода путем наводящих вопросов.
Дать возможность сформулировать ответ наилучшим образом.
На этом этапе реализуются образовательные задачи. Учащиеся знакомятся с аллотропными модификациями фосфора, знакомятся с водородным соединением фосфином и связанных с ним новых сведений.
Осуществить обратную связь с учащимися с целью корректировки неточности в усвоении понятий.
Фронтальная беседа дает возможность выявить степень подготовленности класса к дальнейшей работе, в которой необходимо будет составить уравнения химических реакций.
Повторить в занимательной форме свойства кислот и кисло ных оксидов.
Осуществить обратную связь с учащимися с целью корректировки понятий.
Познакомить с областями применения фосфора, анализируя стихотворение о фосфоре.
Продолжить развивать умения составлять уравнения химических реакций.
Дать возможность учащимся оценить работу своей деятельности.
Придать логическую завершенность работе на уроке с помощью обращения детей к теме, поднятой в начале урока. Выявить степень усвоения учащимися материала на уроке.
Выставление оценок учащимся, активно работавшим на уроке.
Анализируют предложенную работу. Формируется навык построения доказательных рассуждений.

Анализируют задание, делают самостоятельно выводы.
Учащиеся обращаются к уже имеющимся знаниям (ученики могут поправлять друг друга).
Анализируют, делают выводы о различии свойств белого и красного фосфора. Добавляя новые факты, у учащихся поддерживается интерес к обучению.
Учащиеся учатся писать уравнение химической реакции применяя правило.




Во время устных ответов учащиеся внимательно слушают друг друга, дополняют ответы, развивая тем самым монологическую речь.
Припоминают необходимые сведения, которые помогут в дальнейшем написать уравнения химических реакций.
С помощью репродуктивного задания учащиеся учатся составлять формулы солей по образцу.
Учащиеся в занимательной форме наилучшим образом запоминают области применения фосфора.
Вот светоносец знаменитый
Приходит чрез века опять
Не для того, чтобы светиться,
Чтоб урожаи поднимать.
Он стал фосфористою бронзой
Даёт отличное литьё
Питает фосфор клетки мозга
И входит в спичек коробок
Ребята оценивают работу своих товарищей, осознают значимость урока.
Учащиеся аргументировано высказывают свое мнение, при этом у них развивается умение слушать друг друга.


Проект урока
«Фосфор и его соединения»

7