- Учителю
- Интегрированный урок химии, физики, математики в 10 классе «Скорость химических реакций»
Интегрированный урок химии, физики, математики в 10 классе «Скорость химических реакций»
Скорость химических реакций.
Урок химии. 10 класс
Микулёнок Н.Н., учитель химии,
Коледа Г.Ф., учитель физики,
Татаева В.К., учитель математики
Цель: сформировать целостное представление о скорости химической реакции
Задачи:
-
Познакомить учащихся с понятием скорости химических реакций.
-
Развивать общеучебные умения и навыки, логическое мышление, умение анализировать, делать вывод, интеллектуальные и творческие способности учащихся.
-
Стимулировать познавательную активность учащихся путём создания проблемной ситуации
-
Воспитывать умение работать в группах, толерантность.
-
Сформировать представление о единой картине мира через единство предметов естественнонаучного цикла.
Оборудование: реактивы и химическая посуда для проведения демонстрационного опыта и лабораторного эксперимента «Факторы, влияющие на скорость химической реакции», мультимедийная презентация.
Использованные технологии: проблемное обучение, технология кооперации в обучении, технология развивающего обучения.
Тип урока: интегрированный урок изучения нового материала
ХОД УРОКА
Предварительно класс делится на 4 группы.
-
Мотивация и целеполагание; активизация познавательной деятельности: Слово учителя химии: Прежде, чем мы приступим к изучению нового материала, мне хотелось бы продемонстрировать небольшой эксперимент. Посмотрите, пожалуйста, на СЛАЙД № 2 и сделайте свои предположения по поводу течения реакций взаимодействия:
-
Раствора сульфата меди ( II) и железа
-
Растворов хлорида меди ( II) и гидроксида натрия
Будут ли протекать реакции между данными парами веществ, и какие признаки реакции мы должны увидеть?
( Учащиеся выдвигают свои предположения)
Прошу желающего провести данные реакции за демонстрационным столом и записать на доске уравнения химических реакций.
После проведения реакции учащиеся отмечают, что в первом случае признаки реакции проявляются не сразу.
Создаётся проблемная ситуация:
-
Почему мы не увидели признаков реакции, неужели наши предварительные рассуждения относительно хода реакции были неверны?
Но пока на доске составляются уравнения реакций, раствор постепенно начинает менять свою окраску. Учащиеся снова делают свои предположения, а учитель подводит итог: всё дело в том, что при данных условиях эти две реакции протекают с различной скоростью.
Учитель или учащиеся на основе сделанного вывода формулируют тему урока и записывают её в тетрадь. Вместе формулируют задачи на урок : дать определение скорости химической реакции, вывести формулы для расчёта скорости реакции и научиться вычислять скорость реакции по формулам.
-
Актуализация знаний учащихся по физике:
Учитель физики: что является количественной характеристикой движения?
Учащиеся : скорость
Учитель физики: что называется скоростью равномерного прямолинейного движения?
Учащиеся : векторная физическая величина, модуль которой численно равен модулю перемещения за единицу времени, а направление совпадает с направлением перемещения.
Учитель физики: Запишите формулу для расчёта скорости в физике и расшифруйте условные обозначения.
Учащиеся: ![]() , где
, где ![]() - модуль скорости
- модуль скорости
![]()
![]()
СЛАЙД №3
Учитель физики: Какова единица измерения скорости в СИ?
Учащиеся: 1![]() ( метр в секунду)
( метр в секунду)
-
Изучение нового материала.
Учитель химии: А что называется скоростью химической реакции?
Как измеряется скорость химической реакции?
Учитель с учащимися формулируют понятие «скорости реакции», записывают формулу ![]() ( СЛАЙД № 4,5) ( т.к. в ходе химической реакции расходуются исходные вещества , значит уменьшается их химическое количество, а химическое количество продуктов реакции будет соответственно возрастать, то скорость химической реакции будет определяться химическим количеством вещества , прореагировавшего или образовавшегося в единицу времени в единице объёма системы).
( СЛАЙД № 4,5) ( т.к. в ходе химической реакции расходуются исходные вещества , значит уменьшается их химическое количество, а химическое количество продуктов реакции будет соответственно возрастать, то скорость химической реакции будет определяться химическим количеством вещества , прореагировавшего или образовавшегося в единицу времени в единице объёма системы).
Учитель химии: Как вы уже знаете отношение величины химического количества вещества (х) к объёму V называется…..
Учащиеся : концентрация этого вещества - С.
Учитель химии: В таком случае ![]() . Поэтому для измерения скорости химической реакции удобнее пользоваться следующими величинами: концентрация веществ в моль/ дм3 и время протекания реакции в секундах (с).
. Поэтому для измерения скорости химической реакции удобнее пользоваться следующими величинами: концентрация веществ в моль/ дм3 и время протекания реакции в секундах (с).
Как количественно можно характеризовать скорость гомогенной реакции?
Учащиеся :Скорость гомогенной реакции можно количественно охарактеризовать изменением концентрации любого участника реакции в единицу времени:![]() (
(![]() c2-c1;
c2-c1; ![]() 2-t1). СЛАЙД № 6
2-t1). СЛАЙД № 6
Учитель химии: Какие реакции называются гомогенными? Какова единица измерения скорости гомогенной реакции?
Учащиеся: моль
дм3 с
Учитель химии: В качестве примера рассмотрите гомогенную реакцию между веществами А и В (А+В = С+Д)
с учителем математики, вспомните правило раскрытия модуля.
Учитель математики. Вспомним правило раскрытия модуля в математике
Учащиеся: ![]()
Учитель математики: Построим график зависимости концентрации веществ от времени протекания реакции ( СЛАЙД № 7)
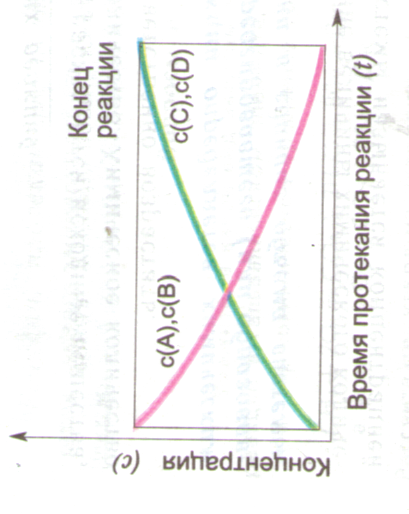
Скорость химической реакции ![]() будет равна ( СЛАЙД № 8)
будет равна ( СЛАЙД № 8)
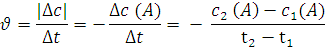
Знак "-" перед дробью ставиться потому, что несмотря на убывание концентрации вещества А , т.е. на отрицательное значение разности с2 (А) - с1(А), скорость реакции может быть только положительной величиной.
Скорость химической реакции можно измерить по изменению концентрации не только одного из реагентов, но и продуктов реакции - концентрация продуктов реакции будет возрастать, тогда в правой части уравнения необходимо поставить знак «+» (СЛАЙД № 9):
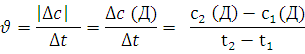
Учитель химии: По изменению концентрации одного вещества можно судить о соответствующих изменениях концентрации всех остальных, так как они связаны одним уравнением.
По мере уменьшения концентрации вещества А скорость реакции будет уменьшаться, следовательно скорость реакции можно определить только для определённого промежутка времени, и в химии обычно рассматривается мгновенная скорость реакции, т.е. скорость в данный момент реакции.
А какие реакции называются гетерогенными? Как можно охарактеризовать скорость гетерогенной реакции?
Ответ учащихся.
Если в гетерогенной среде происходит реакция, то реагирующие вещества соприкасаются между собой не по всему объёму, а только на поверхности. Так , например, ионы Cu2+ и SO42 реагируют только с теми атомами металла железа (опыт а), которые содержатся на поверхности.
Как вы думаете, что бы произошло, если бы мы железо измельчили?
Учащиеся: Поверхность соприкосновения увеличилась бы и скорость этой реакции тоже увеличилась.
Учитель: В связи с этим определение скорости гетерогенной реакции другое и формула другая (СЛАЙД № 10)
![]() , где S- площадь поверхности.
, где S- площадь поверхности.
Дайте определение скорости, используя формулу?
Учащиеся: скорость гетерогенной реакции определяется числом молей веществ, вступивших в реакцию или образующихся в реакции в единицу времени на единице поверхности.
-
Закрепление материала.
РЕШЕНИЕ ЗАДАЧ.
-
Начальная концентрация оксида серы (IV) в реакции окисления его до оксида серы (VI) была 2 моль\дм3, а через 50 сек стала 0,5 моль\ дм3. В этом случае чему будет равна скорость? (СЛАЙД № 11)
Решение (СЛАЙД № 12)
![]() гом=-
гом=-![]() =-
=- ![]() = 0,03 моль/дм3.с
= 0,03 моль/дм3.с
-
В
 ычислите среднюю скорость реакции А+В 2С, если начальная концентрация вещества А равна 0,22 моль/дм3 , а через 10 секунд стала 0,215 моль/дм3 . Как изменилась за это время концентрация вещества В? (СЛАЙД № 13)
ычислите среднюю скорость реакции А+В 2С, если начальная концентрация вещества А равна 0,22 моль/дм3 , а через 10 секунд стала 0,215 моль/дм3 . Как изменилась за это время концентрация вещества В? (СЛАЙД № 13)
РЕШЕНИЕ: (СЛАЙД № 14)
![]() гом= -
гом= - ![]() =-
=- ![]() =-
=-![]() =0,2 моль/ л
=0,2 моль/ л![]() с
с
-
Обобщение материала. Прочитайте параграф 21,стр.130-131 до факторов, влияющих на скорость реакции и выполните задания в группах.
Задание на развитие памяти и речевых навыков учащихся: составьте рассказ на тему «Скорость химической реакции, используя слова и словосочетания для каждой из трёх частей рассказа, озаглавьте их.
Набор слов для рассказа: (СЛАЙД № 15)
-
Химическая реакция, хаотическое движение частиц, столкновение частиц, определённая ориентация частиц, достаточный запас энергии взаимодействующих частиц.
-
Изменение концентрации реагирующих ( образующихся ) веществ в единицу времени,
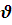 =
= 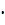 С \
С \ 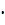 t
t -
Изменение числа молей реагирующих ( образующихся) веществ в единицу времени на единице поверхности,
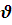 =
= 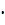 n\
n\  t. S
t. S
По истечении 5 минут представители групп зачитывают рассказ.
-
Рефлексия ( СЛАЙД № 16)
1. Какие знания вы приобрели на данном уроке?
2.С какими понятиями познакомились?
-
Много ли времени нужно затратить дома на изучение материала?
-
Что не усвоили? Почему?
-
Домашнее задание :
Учитель биологии:
Какие вещества называются катализаторами в химии?
Как называются биологические катализаторы? (ферменты)
Подготовьте сообщение о роли биологических катализаторов -ферментов а процессах жизнедеятельности организмов.( СЛАЙД № 17)
Учитель химии:
выучить пар.21
стр.130-132 выполнить задания №№5, 10 (СЛАЙД № 18)