- Учителю
- Пробный экзамен по химии в форме ОГЭ, по материалам ФИПИ
Пробный экзамен по химии в форме ОГЭ, по материалам ФИПИ
Пробный экзамен по химии в 9 классе
Часть1
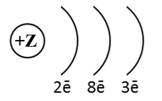
Схема строения электронных оболочек соответствует атому химического элемента
-
2-го периода IIA группы
-
2-го периода IIIA группы
-
3-го периода IIIA группы
-
3-го периода IIA группы
-
В ряду химических элементов Al → P →Cl
-
увеличивается электроотрицательность
-
уменьшаются заряды ядер атомов
-
возрастают металлические свойства
-
уменьшаются радиусы атомов
-
уменьшается число электронов во внешнем электронном слое атомов
-
Химическая связь в сульфиде калия
-
ионная
-
ковалентная полярная
-
ковалентная неполярная
-
металлическая
-
В каком веществе степень окисления атомов фосфора равна +3?
-
PH3
-
H3PO4
-
P4О6
-
Ca3P2
-
Вещества, формулы которых CuSO4 и HCl, являются соответственно
-
оснóвным оксидом и солью
-
солью и кислотой
-
основанием и кислотой
-
солью и основанием
-
Протекание химической реакции всегда сопровождается
-
изменением агрегатного состояния
-
выделением или поглощением энергии
-
изменением цвета вещества
-
изменением занимаемого объёма
-
7. Наибольшее число ионов образуется в растворе при полной диссоциации 1 моль
-
HNO3
-
MgCl2
-
NaOH
-
KMnO4
-
Газ не выделяется при взаимодействии водных растворов
-
HNO3 и K2CO3
-
Nа2SO3 и H2SO4
-
Na2CO3 и Ba(OH)2
-
HCl и Na2S
-
Между какими веществами возможно взаимодействие?
-
сульфатом калия и карбонатом кальция
-
сульфатом бария и хлоридом натрия
-
сульфатом железа(III) и фосфатом калия
-
сульфатом аммония и нитратом алюминия
-
Калий взаимодействует с каждым из двух веществ:
-
Ca и O2
-
Cu и N2
-
HCl и S
-
H2O и NaOH
-
11. В реакцию с соляной кислотой вступает
-
нитрат серебра
-
нитрат бария
-
серебро
-
оксид кремния
-
Каждая из трёх солей - Na2CO3, K3PO4 и AgNO3 - реагирует с
-
медью
-
азотной кислотой
-
хлоридом кальция
-
гидроксидом калия
-
13. Верны ли следующие суждения о правилах хранения и приёма витаминов?
-
А. Витамин С можно потреблять в неограниченном количестве.
-
Б. Хранить и принимать витамины можно в течение неограниченного периода времени
-
верно только А
-
верно только Б
-
верны оба суждения
-
оба суждения неверны
-
14. В реакции, схема которой HCl + PbO2 → PbCl2 + Cl2 + H2O, восстановителем является
-
H+1
-
O-2
-
Pb+2
-
Cl-1
-
15. На какой диаграмме распределение массовых долей элементов соответствует количественному составуфосфата железа(II)?
-
1)
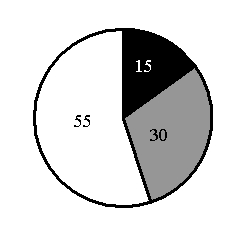 2)
2)
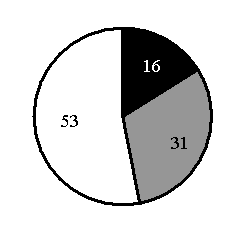 3)
3)
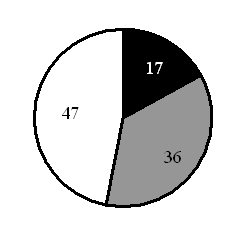 4)
4)
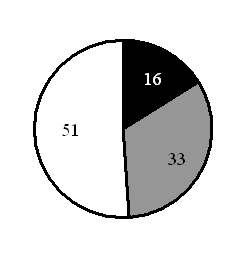
-
16. Общим для бериллия и углерода является:
-
наличие двух электронных слоёв в их атомах
-
существование соответствующих им простых веществ в виде двухатомных молекул
-
то, что они относятся к металлам
-
то, что значение их электроотрицательности меньше, чем у кислорода
-
образование ими высших оксидов с общей формулой ЭО2
-
17. В ряду химических элементов Mg → Al → Si
-
число заполненных электронных слоёв возрастает
-
радиус атома уменьшается
-
электроотрицательность атома уменьшается
-
валентность в высшем оксиде возрастает
-
металлический характер элемента увеличивается
-
18. Установите соответствие между названием вещества и реагентами, с которыми это вещество может взаимодействовать
-
-
19. Установите соответствие между веществами и признаком протекающей между ними реакции.
-
-
-
-
Часть2
-
20. Используя метод электронного баланса, составьте уравнение реакции
-
HBrO3 + H2S → S + Br2 + H2O
-
Определите окислитель и восстановитель.
-
21. При взаимодействии 7,1 г оксида фосфора(V) с избытком раствора гидроксида натрия получили 164 г раствора средней соли. Вычислите массовую долю соли в полученном растворе.
-
22. Для проведения эксперимента предложены следующие реактивы: растворы хлорида натрия, гидроксида натрия, серной кислоты, хлорида бария, металлическое железо. Вам также предоставлен комплект лабораторного оборудования, необходимого для проведения химических реакций.
-
Используя необходимые вещества только из этого списка, получите в результате проведения двух последовательных реакций раствор хлорида железа(II). Составьте схему превращений, в результате которых можно получить указанное вещество. Запишите уравнения двух реакций. Для второй реакции составьте сокращённое ионное уравнение.
4