- Учителю
- Разработка модулей по химии
Разработка модулей по химии
Акмолинская область
Жаркаинский район
Карасуская ОШ
Разработка модулей по химии
(из опыта работы учителя химии Ахметовой А.Е.)
2012 г.
Рассмотрено МО: протокол №5 от 22.05.12г.
Согласовано МС: протокол №1 от 29.09.12 г.
Утверждено педсоветом: протокол № 2 от 27.10.12г.
В пособии представлена разработка модуля из курса химии 9 класса: «Теория электролитической диссоциации», который содержит пакет предписаний для самостоятельной работы ученика и самопроверки.
Применение модульной технологии на уроках химии позволяет обеспечить стабильные знания, повысить интерес учащихся к изучению предмета и качество знаний, выстроить бесконфликтную педагогику.
Пособие предназначено для учителей химии общеобразовательных школ.
Составитель: Ахметова А.Е. учитель химии Карасуской основной школы.
Введение
Ум любого человека постоянно получает и сортирует информацию. Задача учителя состоит в том, чтобы дать уму подростков такую пищу, которая поддерживала бы стремление к новым знаниям и позволяла познать радость ученичества. Тогда радость быть учеником станет жизненной опорой в настоящее время, а самообразование - жизненной ценностью. Этому способствует применяемая мной в образовательном процессе модульная технология, которая позволяет учащимся осваивать программный материал с учетом индивидуальных познавательных способностей, а также дает возможность целенаправленно организовывать самообразовательную работу способных учеников.
Практика показывает, что большинство видов деятельности учащиеся выбирают не потому, что они им нравятся, а потому, что их к ним приучили. По моему мнению, каждый ученик должен сам выбирать результат обучения: школьник учится, а учитель лишь осуществляет мотивационное управление. Я убеждаюсь на собственном опыте, что самообразование - самое эффективное обучение, в результате этого процесса происходят целенаправленные изменения, т.е. саморазвитие личности. Систематическое самообразование ведет к положительному саморазвитию, а сформированная в школьные годы потребность в нем становиться жизненной ценностью, необходимым условием эффективной подготовки молодого человека к жизни в современном обществе.
С целью развития у учащихся стремления к знаниям, самообразованию, умению самостоятельно расширять и углублять свои знания обучение химии я осуществляю по технологии модульного обучения А.А. Жанпеисовой.
Главная цель модульной технологии обучения - развитие интеллектуальных и творческих способностей учащихся, умение самореализоваться в жизни.
Структура модуля
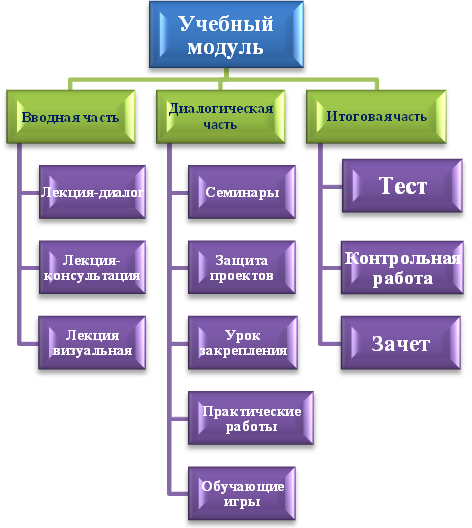
По модульной технологии содержание каждого учебного курса делится на учебные модули, состоящие из:
а) блоков модулей содержания теоретического материала;
б) блоков алгоритмических предписаний умений и навыков.
Модуль представляет собой комплекс методических рекомендаций по нахождению и изучению материала, комплекса дидактических материалов и заданий для выходного контроля.
Особенностью учебного модуля является то, что на вводную и итоговую часть при любом количестве часов отводится по 1-2 часа. Все остальное время отведено на диалогическую часть, т.е. на закрепление материала.
Преимущества этой технологии заключается в том, что модульная технология обучения позволяет уже в водной части видеть не кусочек изучаемого материала, а материал в целом.
Я считаю, самая главная часть - это вводная часть модульного обучения. Так как во вводной части модуля учащиеся не только должны осознать, почему и для чего им нужно изучить данный раздел программы, что именно им надо усвоить и изучить, какова основная задача предстоящей работы.
Здесь проявляется талант и мастерство учителя, так как он кратко в течение 30 минут должен доступно для всех объяснить учебный материал по всей теме данного модуля, опираясь на опорные схемы, модульные карточки.
При изучении новой темы я стараюсь работать не только на среднего ученика, но и развивать сильного, при этом ставлю цель не только формировать багаж теоретических и фактических знаний, но и развитие логического мышления.
В диалогической части учитель должен хорошо ознакомиться с характеристиками основных методик коллективных способов обучения и с их особенностями и умело применять модульные карточки. В этой части модуля осуществляется закрепление и углубление знаний учащихся. Я считаю, что только многократное повторение и упражнение дают устойчивые и глубокие знания.
Итоговая часть модуля выполняет роль контроля и проверки знаний, умений и навыков учащихся.
Методы и формы работы модульного обучения на уроках
В современной педагогике накоплен богатейший арсенал модульных подходов, среди которых можно выделить следующие:
-
Творческие задания.
-
Разноуровневые задания.
-
Работа в малых группах.
-
Работа в парах сменного состава.
-
Обучающие игры (ролевые игры, имитации, деловые игры и образовательные игры).
Но данная технология обучения, описанная автором, наиболее применительна к предметам гуманитарного цикла и учащимся 5-7 классов, так как часто используются игровые методы в диалогической части модуля. Поэтому я заменила их на наиболее эффективные формы и методы обучения. Для повышения интереса и мотивации учащихся к изучению химии на своих уроках применяю элементы технологии критического мышления, проблемное изучение, а также метод проектов.
Наша память не хранит того, что не имеет для нас практической ценности. Значит, чтобы научиться чему-то, мы должны видеть связь новых знаний с жизнью. Установить такие связи мне позволяют уроки проблемного проектирования. Например:
- Предлагаю учащимся экспериментальные задачи, позволяющие обнаружить щелочи и кислоты в средах бытовой химии, разработать рекомендации по правилам их безопасного применения. Учащиеся индивидуально проводят экспериментальные исследования различных средств бытовой химии, которые применяют дома, затем участвуют в учебной дискуссии.
- Даю темы проектов для индивидуального самостоятельного изучения. При изучении кислот мною были предложены следующие темы проектов: «Яблочная кислота», «Молочная кислота», «Лимонная кислота» и «Аскорбиновая кислота». Ребята, используя различные литературные источники и дополнительный материал об органических кислотах, выполнили проекты и представили свои презентации. Таким образом, учащиеся сообщают друг другу новые знания и интересные научные факты - осуществляется взаимообучение.
- Еще одним примером является постановка проблемного вопроса при изучении карбоновых кислот: одинаковы ли общие химические свойства органических и неорганических кислот? Ребята выдвигают гипотезу и экспериментально доказывают ее на примере двух кислот - уксусной и соляной кислот.
- Также на своих уроках я создаю проблемные ситуации, например, при изучении соединений углерода: показываю демонстрационный опыт образования осадка при вдыхании в пробирку с известковой водой и исчезновении его при длительном вдыхании.
На таких уроках все школьники вовлечены в процесс обучения, воспринимают и усваивают необходимую информацию, поскольку она соответствует уровню их интеллекта и получена в результате собственных усилий. Учитель на данном уроке не сообщает готовые знания, а помогает учащимся решить учебную проблему как первооткрывателям. Такое обучение способствует также возникновению доверительных отношений между учениками и учителем, что еще больше повышает его эффективность и формирует устойчивую мотивацию к изучению предмета.
При всем разнообразии задач, стоящих перед современной школой, важнейшей стала задача преодоления мотивационного вакуума у учащихся основной и старшей школы.
Продолжая расширять и углублять знания учащихся, веду внеклассную работу - это работа над школьными научными проектами. Учащимися 9 класса выполнены два ярких проекта на темы «Сколько витамина С в яблоке?» и «Исследование влияния мыла на кожу человека». В первой работе ученица определила количество аскорбиновой кислоты в свежем и запеченном яблоках методом титрометрического количественного анализа. Оказалось, что в свежих яблоках витамина С больше, затем учащаяся сравнила полученные данные с литературными и объяснила некоторые расхождения опыта. На основе полученных результатов были сделаны выводы и предложены области их практического применения. Вторая работа была выполнена методом определения щелочи в составе мыла. Данные проекты являются среднесрочными.
Анализируя свои уроки, я пришла к выводу, что применение модульной технологии помогает дисциплинировать учащихся, изменить отношение ученика к уроку, способствует наилучшему воспитанию и усвоению учебного материала.
В данном методическом пособии предлагаю учителям химии модуль из курса 9 класса, разработанный в соответствии с учебной программой 2010 года. Представленный модуль требует ежегодной коррекции, т.к. необходимо учитывать индивидуальные особенности и уровень подготовленности учеников и ученического коллектива в целом.
Учебный модуль по теме:
«Электролитическая диссоциация и свойства электролитов», 9 класс
Количество часов: 10.
Структура модуля
Структура модуля
Кол-во часов
Содержание
Кол-во мин
Тип урока
Список литературы
Вводная часть
1
Постановка целей и задач. Вводная лекция с последующей самопроверкой.
45
Урок изучения нового материала
Энциклопедический словарь юного химика: Крицман В.А., Станцо В.В. - М.: Педагогика, 1982 - 336 с.
Диалогическая часть
2
Самостоятельная работа ученика с учебником на тему «Диссоциация солей, кислот и щелочей» с последующей взаимопроверкой
90
Урок совершенствования знаний, умений и навыков
Химия: Учебник для 9 класса общеобразовательных школ / Усманова М.Б., Сакарьянова К.Н. - Алматы: Атамура, 2009, -33с.
1
Индивидуально-групповая форма работы на тему "Реакции ионного обмена"
45
Урок приобретения новых знаний
Общая химия/ И.Г. Хомченко, с 29; Химия: Учебник для 9 класса общеобразовательных школ / Усманова М.Б., Сакарьянова К.Н. - Алматы: Атамура, 2009, -38с.
1
Изучение темы «Гидролиз солей» с помощью электронного учебника
45
Урок совершенствования знаний, умений и навыков
Электронный учебник «Химия, 9 класс»
1
Самостоятельная работа с текстом на тему ОВР
45
Урок приобретения новых знаний
WWW.уроки.net
1
Обобщающий урок-игра. Решение задач
45
Урок систематизации и закрепления знаний
1
"Решение экспериментальных задач"
45
Практическая работа №1
Итоговая часть
1
Зачет
45
Урок систематизации и закрепления знаний
1
Контрольная работа №1
45
Урок систематизации, контроля й
Основные задачи:
-
Расширение знаний учащихся о растворах и растворимости, о химических реакциях, идущих в водных растворах, о структуре веществ.
-
Усвоение учащимися полученных знаний о свойствах кислот, оснований и солей и их определения с точки зрения ТЭД;
-
Систематизировать сведения учащихся о электролитах и неэлектролитах. Подвести их к пониманию ТЭД.
Учащиеся должны знать:
-
Определения кислот, оснований и солей с точки зрения ТЭД;
-
Условия протекания реакций ионного обмена до конца;
-
Сильные, слабые электролиты и неэлектролиты;
-
Ионы, обуславливающие общность кислот, оснований и солей;
Учащиеся должны уметь:
-
Составлять уравнения реакций диссоциации кислот, оснований и солей;
-
Составлять уравнения реакций ионного обмена и гидролиза солей;
-
Определять качественный и количественный состав соединений;
-
Анализировать и излагать материал, пользуясь опорной схемой.
Урок №1
Дата:
Тема: «Электролиты и неэлектролиты. Механизм ЭЛД. Слабые и сильные электролиты. Степень диссоциации».
Форма урока: лекция
Оборудование: таблица растворимости, схемы растворения кристалла поваренной соли и ДАМ.
Ход урока:
1. Организационный момент
2. Знакомство с содержанием и структурой модуля
3. Определение целей и задач:
-
дать представление об электролитах и неэлектролитах, электролитической диссоциации, о механизме диссоциации; расширить знания учащихся о веществах и химических реакциях, о растворах и растворимости, о структуре веществ и видах химической связи.
-
Развивать логическое мышление, умение анализировать, систематизировать и обобщать полученные знания, способность к организации учебной деятельности;
-
Создать условия для воспитания нравственных качеств учащихся и чувства коллективизма.
-
Лекция (краткое изложение содержания темы)
Английский физик Майкл Фарадей еще в 30-е годы XIX века, изучая закономерности прохождения электрического тока через растворы, ввел термины "электролит", "электролиз", "ион," "катион", "анион". Электролит - вещество, раствор которого проводит электрический ток. Происходит это в результате движения в растворе заряженных частиц - ионов.
Причина появления в растворах заряженных частиц была совершенно непонятной. Само название "электролит" (от греч. Lysis - разрушение, растворение) предполагало, что ионы проявляются в растворе при пропускании через него электрического тока.
В 1887 году шведский физико-химик Сванте Аррениус, исследуя электропроводность водных растворов, высказал предложение, что в таких растворах вещества распадаются на заряженные частицы - ионы, которые могут передвигаться к электродам - отрицательно заряженному аноду. Это и есть причина электрического тока в растворах. Данный процесс получил название электролитической диссоциации (дословный перевод - расщепление, разложение под действием электричества). Такое название также предполагает, что диссоциация происходит под действием электрического тока. Дальнейшие исследования показали, что это не так: ионы являются только переносчиками зарядов в растворе и существуют в нем независимо от того, проходит через раствор ток или нет.
Теория Аррениуса, с одной стороны, объяснила, почему растворы электролитов проводят ток, с другой стороны - объясняла увеличение числа частиц в растворе. Например, в растворе сульфат алюминия Al2(SO4)3 распадается сразу на пять ионов: два катиона алюминия Al3+ и три сульфат-аниона SO42-. За создание теории электролитической диссоциации Аррениуса в 1903 году был удостоен Нобелевской премии по химии.
По степени диссоциации на ионы электролиты стали относить к сильным (полный распад на ионы) и к слабым (на ионы распадается только часть растворенного вещества). К сильным относятся щелочи, многие кислоты (серная, азотная, соляная), большинство солей. К слабым электролитам относятся уксусная , азотистая, сероводородная, угольная, сернистая, большинство органических кислот. Воду также можно отнести к слабым электролитам, так как лишь очень небольшая часть ее молекул находится в растворах в виде катионов Н+ и анионов ОН-. Фосфорная кислота - электролит средней силы.тело человека также содержит растворы электролитов и проводит электрический ток.
Ионы резко отличаются по своим физическим и химическим свойствам от нейтральных атомов. Например, атомы натрия реагируют с водой, а катионы натрия - нет; хлор - сильный окислитель и ядовит, а его анионы не являются окислителями и не ядовиты. Цвет анионов при гидротации может изменится. Например, негидротированные ионы меди бесцветны (безводный сульфат меди), а гидротированные - голубые.
-
Закрепление
Карточка самоконтроля.
-
Автор теории электролитической диссоциации.
-
Что называют электролитом?
-
Что называют неэлектролитом?
-
Что означает слово диссоциация?
6. Домашнее задание: § 3, А(1), В(1), С(1).
7. Итог.
Урок № 2-3
Дата:
Тема: «Диссоциация солей, кислот и щелочей»
Оборудование: ОС, классная доска, химические реактивы.
Ход урока:
-
Организационный момент.
-
Определение целей и задач:
-
Усвоение учащимися полученных знаний о свойствах кислот, оснований и солей и их определение с точки зрения ТЭД; отработка и закрепление умений составлять уравнения диссоциации кислот, оснований и солей.
-
Продолжать развивать умение анализировать, систематизировать и обобщать полученные знания, а также способность к организации учебной деятельности;
-
Способствовать воспитанию нравственных качеств учащихся и культуры поведения в коллективе.
3.Актуализация знаний.
Графический диктант (да - /, нет - =)
-
ТЭД была сформулирована шведским ученным С. Арениусом в 1887 г.
2. Электролиты - это вещества растворы которых проводят электрический ток.
3. Диссоциация - это процесс распада вещества на ионы при растворении его в воде или расплавлении.
4. Диссоциация не обусловлена гидратацией веществ.
5. Диссоциация - необратимый процесс.
6. Атомы и ионы одного и того же элемента отличаются по своим свойствам.
-
Самостоятельная работа на тему с последующей самопроверкой.
Ознакомьтесь с ниже указанной инструкцией. При возникновении вопросов обращайтесь к учителю.
Алгоритм работы
-
Изучите лист-инструкцию и задания на закрепление .
-
По плану напишите опорный конспект по § 6 на странице 118-124.
-
Ответив на вопросы взаимоконтроля, проверьте знания друг друга по данной теме.
-
У доски изложите новый материал, опираясь на свой конспект.
-
Выполните задания на закрепление, которые вам по силе.
Желаю успехов!!!
План конспекта
-
Рассмотрите диссоциацию растворимых оснований, кислот и солей. Приведите примеры.
-
Ионы обуславливающие общность свойств кислот и оснований.
-
Определение оснований, кислот и солей с точки зрения электролитической диссоциации.
-
Влияние индикаторов на растворы электролитов. Качественная характеристика ЭД.
Примечание: конспект необходимо составить таким образом, чтобы вы могли по нему пересказать рассматриваемый материал у доски.
5. Задания на закрепление
-
Лист взаимоконтроля.
Приблизительные вопросы:
А) Дайте определение основаниям, кислотам и солям с точки зрения электролитической диссоциации.
Б) Какой ион обуславливает общность свойств кислот? Приведите два примера.
В) Какой ион обуславливает общность свойств оснований? Приведите два примера.
Г) Какие ионы образуются в растворах солей? Приведите два примера.
Д) Какие ионы образуются в при диссоциации основных и кислотных солей?
Е) Как протекает реакция ЭД многоосновных кислот и многокислотных оснований?
2. Напишите уравнения процессов диссоциации: NaOH, Fe2(SO4)3, AlCl3, (FeOH)2Cl, H2CO3.
3. Модульная карточка
А
Б
В
Г
Д
1
Н2CO3
H2SO4
Ca(OН)Cl
AlCl3
NaOH
2
Ca(OH)2
CaSO4
Mg(OН)2
Н2SO3
Al(ОН)3
3
Cr2O3
Ва(ОН)Cl
НNО3
Fe(OН)Cl2
MgCl2
4
Н2S
Ca(HSO4)2
КCl
Cu(OH)2
НCl
5
ZnCl2
KOH
BaSO4
Н3PO4
CaCO3
1. Напишите уравнения диссоциации следующих веществ: Б1, В4, Д4, Г5, А1, Г2, А4.
2. Напишите уравнения диссоциации веществ под кодами: А2, Г4, Д2, Д1, В2, Б5.
3. Напишите уравнения диссоциации веществ под кодами: В1, Б2, Б3, Г3, Д3, Б4, А5.
4. Напишите уравнения диссоциации следующих веществ по первой ступени: Б1, В2, Г5, Г2, А4, Б4.
5. Укажите коды веществ, при диссоциации которых образуются следующие пары ионов: Zn2+ и Cl-, Mg2+ и OН-, Н+ и S2-, H+ и NO3- ,Al3+ Cl- .
4. Напишите формулы анионов, которые могут входить в состав кислых солей, образованных следующими кислотами: а) Н2 SO3;
б) Н3PO4.
5. Напишите формулы трех известных вам двухосновных кислот. Составьте уравнения их диссоциации по первой и второй ступеням.
6. Составьте формулы солей, которые образованны следующими катионами и анионами: а) Al3+ и NO3-; б) Na+ и SO32-; в) Mg2+ и НCO3-; г) FeOН2+ и Cl-.
-
Домашнее задание: § 6, № А(1,2), В(1,2).
-
Итог: оценивание работ и выставление оценок.
Урок №4
Дата:
Тема: «Реакции ионного обмена»
Оборудование: ОС, классная доска, таблица растворимости.
Реактивы: карбонат кальция тв., растворы соляной кислоты, сульфата меди, гидроксида натрия.
Ход урока:
-
Организационный момент
-
Определение целей и задач:
-
Усвоение и четкое знание определения реакции ионного обмена, условий протекания данной реакции до конца;
-
формирование умения составлять молекулярные, полные и сокращенные ионные уравнения реакции ионного обмена.
-
Актуализация знаний
Расположите следующие вещества в нужные графы и напишите уравнения их ЭД: Н2CO3, KOH, Н3PO4, NaOH, Н2S, НCl, AlCl3, Н2CO3, H2SO4, НNО3, Al(ОН)3.
Сильные электролиты
Слабые электролиты
4. Индивидуально-групповая форма обучения с применением разноуровневых заданий..
Вопросы и задания к индивидуально-групповой форме работы
3-й уровень
1. Изучив подробно параграф «Реакции ионного обмена» выполните следующие задания.
2. По следующим схемам реакций составьте уравнения в молекулярной и ионной формах:
А) ![]()
Б) ![]()
В) ![]()
3. Составьте уравнение реакций между нитратом магния и гидроксида калия в молекулярной, ионной и сокращенной ионной формах.
2-й уровень
1. Изучив подробно параграф «Реакции ионного обмена» выполните следующие задания.
2. Напишите уравнения реакций в молекулярной и ионной формах между следующими веществами: а) ![]() и
и ![]() ; б)
; б) ![]() и
и ![]() ; в)
; в) ![]() и
и ![]() ; г)
; г) ![]() и
и ![]() .
.
3. Дополните схемы реакций и составьте уравнения реакций в молекулярной, ионной и сокращенной ионной формах:
А) ![]()
Б) ![]()
Г) ![]()
Д) ![]()
Е) ![]()
1-й уровень
1. Изучив подробно параграф «Реакции ионного обмена» выполните следующие задания.
2. Напишите уравнения реакций в молекулярной ионной и сокращенной ионной формах между следующими веществами, находящимися в водном растворе: а) фторидом натрия и хлоридом кальция; б) сульфатом калия и хлоридом бария; в) сульфатом
3. Растворы каких веществ надо взять для осуществления следующих реакций:
![]()
![]()
![]()
![]()
5.Закрепление.
Карточка самопроверки
-
Что называют реакцией ионного обмена?
-
Условия протекания РИО до конца.
-
Какую реакцию называют обратимой?
-
Какую реакцию называют необратимой?
-
Домашнее задание: § 8, А(1), С(2).
-
Итог
Урок №5
Дата:
Тема: «Гидролиз солей»
Оборудование: электронный учебник «Химия, 9 класс», классная доска, таблица растворимости.
Реактивы: карбонат кальция тв., растворы соляной кислоты, сульфата меди, гидроксида натрия.
Ход урока:
-
Организационный момент
-
Определение целей и задач:
-
Сформировать понятие процесса гидролиза;
-
Учащиеся должны усвоить определение солей с точки зрения теории электролитической диссоциации;
-
Отработка и закрепление умения записывать уравнения реакции гидролиза в молекулярной, полной и сокращенной ионной форме
-
Актуализация знаний
-
Химический диктант.
1.Реакции ионного обмена протекают до конца, если ….
2. Необратимой реакцией называют …
3. Обратимой реакцией называют реакцию …
4. Щелочную среду фенолфталеин окрашивает в ….
5. Щелочную среду универсальный индикатор окрашивает в
-
-
Изучение темы с помощью электронного учебника «Химия 9 класс»
-
Изучив тему по электронному учебнику ответьте на следующие вопросы самоконтроля:
-
Какие типы солей подвергаются гидролизу?
-
Какие типы солей не подвергаются гидролизу?
-
Что называют гидролизом?
-
Какие типы солей гидролизуются в несколько степеней?
-
-
Закрепление.
-
1. Модульная карточка
А
Б
В
Д
1
Н2CO3
H2SO4
Ca(OН)Cl
NaOH
2
Ca(OH)2
CaSO4
Mg(OН)2
Al(ОН)3
3
Cr2O3
Ва(ОН)Cl
НNО3
MgCl2
4
Н2S
Ca(HSO4)2
КCl
НCl
5
ZnCl2
KOH
BaSO4
CaCO3
-
Напишите уравнения гидролиза солей под кодом 5В, 5Д, 5А в молекулярной, ионной и сокращенной ионной формах. Какова будет реакция среды?
-
Напишите уравнения гидролиза солей под кодом 4Б, 3Д, 4Г в молекулярной, ионной и сокращенной ионной формах. Какова будет реакция среды?
2. Какие из перечисленных солей будут подвергаться гидролизу: а) бромид калия; б) сульфид натрия; в) нитрат калия; г) нитрат меди (II)? Ответ поясните.
3. Укажите, какие из перечисленных ниже солей подвергаются гидролизу: а) хлорид бария; б) хлорид меди (II); в) фторид калия; г) иодид калия; д) гидросульфат калия. Напишите уравнения реакций гидролиза в сокращенной ионной, ионной и молекулярной формах.
4. Имеются уравнения реакций гидролиза в сокращенной ионной форме:
1) ![]()
2) ![]()
3) ![]()
6. Домашнее задание: §10, А(1,2), В(1), С(I вариант).
7. Итог
Урок №6
Дата:
Тема: «Окислительно-восстановительные реакции»
Оборудование: электронный учебник «Химия, 9 класс», классная доска, таблица растворимости.
Ход урока:
-
Организационный момент
-
Определение целей и задач:
-
изучить классификацию окислительно-восстановительных реакций;
-
Расширить знания учащихся об окислительно-восстановительных реакциях;
-
Учащиеся должны усвоить два способа уравнивания ОВР;
-
Отработка и закрепление умения записывать уравнения окислительно-восстановительных реакций и определять их типы.
-
Актуализация знаний
Графический диктант
-
Гидролизом солей называется взаимодействие ионов соли с ионами воды, в результате, которого образуются молекулы или ионы слабого электролита.
-
Соль, образованная слабой кислотой и сильным основанием не подвергается гидролизу.
-
Соль, образованная сильной кислотой и сильным основанием подвергается гидролизу.
-
Все кислые соли подвергаются гидролизу.
-
Соль, образованная слабым основанием и сильной кислотой подвергается гидролизу.
-
Кислую среду дает образование протонов в растворе.
-
Соль, образованная слабой кислотой и слабым основанием полностью подвергается гидролизу.
План для самостоятельного изучения темы
1. Изучи материалы темы (ниже указанно).
2. В случае возникновения вопросов, изучи материалы параграфа № 11 из учебника «Химия, 9 класс», автор О.С. Габриелян, Г.Г. Лысова, изд. «Дрофа», М., 2002.
3. Выполни упражнения.
1. Уравнения окислительно-восстановительных реакций.
Многие химические реакции уравниваются простым подбором коэффициентов. Но иногда возникают сложности: количество атомов какого-нибудь элемента в левой и правой частях уравнения никак не удается сделать одинаковым без того, чтобы не нарушить "равновесия" между атомами других элементов.
Чаще всего такие сложности возникают в уравнениях окислительно-восстановительных реакций. Для их уравнивания используют несколько способов, из которых мы пока рассмотрим один - метод электронного баланса.
Напишем уравнение реакции между алюминием и кислородом:
Al + O2 = Al2O3
Пусть вас не вводит в заблуждение простота этого уравнения. Наша задача - разобраться в методе, который в будущем позволит вам уравнивать гораздо более сложные реакции.
Итак, в чем заключается метод электронного баланса? Баланс - это равенство. Поэтому следует сделать одинаковым количество электронов, которые отдает один элемент и принимает другой элемент в данной реакции. Первоначально это количество выглядит разным, что видно из разных степеней окисления алюминия и кислорода:
0
0
+3 -2
Al
+
O2
=
Al2O3
Алюминий отдает электроны (приобретает положительную степень окисления), а кислород - принимает электроны (приобретает отрицательную степень окисления). Чтобы получить степень окисления +3, атом алюминия должен отдать 3 электрона. Молекула кислорода, чтобы превратиться в кислородные атомы со степенью окисления -2, должна принять 4 электрона:
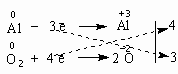
Чтобы количество отданных и принятых электронов выровнялось, первое уравнение надо умножить на 4, а второе - на 3. Для этого достаточно переместить числа отданных и принятых электронов против верхней и нижней строчки так, как показано на схеме вверху.
Если теперь в уравнении перед восстановителем (Al) мы поставим найденный нами коэффициент 4, а перед окислителем (O2) - найденный нами коэффициент 3, то количество отданных и принятых электронов выравнивается и становится равным 12. Электронный баланс достигнут. Видно, что перед продуктом реакции Al2O3 необходим коэффициент 2. Теперь уравнение окислительно-восстановительной реакции уравнено:
4Al + 3O2 = 2Al2O3
Все преимущества метода электронного баланса проявляются в более сложных случаях, чем окисление алюминия кислородом. Например, известная всем "марганцовка" - марганцевокислый калий KMnO4 - является сильным окислителем за счет атома Mn в степени окисления +7. Даже анион хлора Cl- отдает ему электрон, превращаясь в атом хлора. Это иногда используют для получения газообразного хлора в лаборатории:
+7
-1
0
+2
KMnO4
+
KCl
+
H2SO4
=
Cl2
+
MnSO4
+
K2SO4
+
H2O
Составим схему электронного баланса:
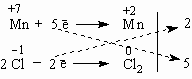
Двойка и пятерка - главные коэффициенты уравнения, благодаря которым удается легко подобрать все другие коэффициенты. Перед Cl2 следует поставить коэффициент 5 (или 2 5 = 10 перед KСl), а перед KMnO4 - коэффициент 2. Все остальные коэффициенты привязывают к этим двум коэффициентам. Это гораздо легче, чем действовать простым перебором чисел.
2KMnO4 + 10KCl + 8H2SO4 = 5Cl2 + 2MnSO4 + 6K2SO4 + 8H2O
Чтобы уравнять количество атомов К (12 атомов слева), надо перед K2SO4 в правой части уравнения поставить коэффициент 6. Наконец, чтобы уравнять кислород и водород, достаточно перед H2SO4 и H2O поставить коэффициент 8. Мы получили уравнение в окончательном виде.
Метод электронного баланса, как мы видим, не исключает и обыкновенного подбора коэффициентов в уравнениях окислительно-восстановительных реакций, но может заметно облегчить такой подбор.
** Окислительно-восстановительные реакции играют огромную роль в природе и технике. Без этих реакций невозможна жизнь, потому что дыхание, обмен веществ, синтез растениями клетчатки из углекислого газа и воды - все это окислительно-восстановительные процессы.
В технике с помощью реакций этого типа получают такие важные вещества как аммиак (NH3), серную (H2SO4)и соляную (HCl) кислоты и многие другие продукты. Вся металлургия основана на восстановлении металлов из их соединений - руд. Большинство химических реакций - окислительно-восстановительные. Приведем важнейшие определения, связанные с окислительно-восстановительными реакциями.
Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
Окислителями называются вещества, присоединяющие электроны. Во время реакции они восстанавливаются.
Восстановителями называются вещества, отдающие электроны. Во время реакции они окисляются.
Поскольку окислитель присоединяет электроны, степень окисления его атомов может только уменьшаться. Наоборот, восстановитель теряет электроны и степень окисления его атомов должна повышаться.
Окисление всегда сопровождается восстановлением и, наоборот, восстановление всегда связано с окислением.
Число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем.
Если каждый атом окислителя может принять иное количество электронов, чем отдает атом восстановителя, то необходимо так подобрать количество атомов того и другого реагента, чтобы количество отдаваемых и принимаемых электронов стало одинаковым. Это требование положено в основу метода электронного баланса, с помощью которого уравнивают уравнения окислительно-восстановительных реакций.
Различают три основных типа окислительно-восстановительных реакций:
1) Реакции межмолекулярного окисления-восстановления (когда окислитель и восстановитель - разные вещества);
2) Реакции диспропорционирования (когда окислителем и восстановителем может служить одно и то же вещество);
3) Реакции внутримолекулярного окисления-восстановления (когда одна часть молекулы выступает в роли окислителя, а другая - в роли восстановителя).
Рассмотрим примеры реакций трех типов.
1. Реакциями межмолекулярного окисления-восстановления являются все уже рассмотренные нами в этом параграфе реакции.
Рассмотрим несколько более сложный случай, когда не весь окислитель может быть израсходован в реакции, поскольку часть его участвует в обычной - не окислительно-восстановительной реакции обмена:
0
+5
+2
+2
Cu
+
HNO3
=
Cu(NO3)2
+
NO
+
H2O
Часть частиц NO3 участвует в реакции в качестве окислителя, давая оксид азота NO, а часть ионов NO3 в неизменном виде переходит в соединение меди Cu(NO3)2. Составим электронный баланс:
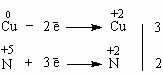
Поставим найденный для меди коэффициент 3 перед Cu и Cu(NO3)2. А вот коэффициент 2 следует поставить только перед NO, потому что весь имеющийся в нем азот участвовал в окислительно-восстановительной реакции. Было бы ошибкой поставить коэффициент 2 перед HNO3, потому что это вещество включает в себя и те атомы азота, которые не участвуют в окислении-восстановлении и входят в состав продукта Cu(NO3)2 (частицы NO3 здесь иногда называют "ионом-наблюдателем").
Остальные коэффициенты подбираются без труда по уже найденным:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
2. Реакции диспропорционирования происходят тогда, когда молекулы одного и того же вещества способны окислять и восстанавливать друг друга. Это становится возможным, если вещество содержит в своем составе атомы какого-либо элемента в ПРОМЕЖУТОЧНОЙ степени окисления. Следовательно, степень окисления способна как понижаться, так и повышаться. Например:
+3
+5
+2
HNO2
=
HNO3
+
NO
+
H2O
Эту реакцию можно представить как реакцию между HNO2 и HNO2 как окислителем и восстановителем и применить метод электронного баланса:
+3
+3
+5
+2
HNO2
+
HNO2
=
HNO3
+
NO
+
H2O
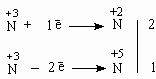
Получаем уравнение:
2HNO2 + 1HNO2 = 1HNO3 + 2NO + H2O
Или, складывая вместе моли HNO2:
3HNO2 = HNO3 + 2NO + H2O
3. Реакции внутримолекулярного окисления-восстановления происходят тогда, когда в молекуле соседствуют атомы-окислители и атомы-восстановители. Рассмотрим разложение бертолетовой соли KClO3 при нагревании:
+5
-1
0
KClO3
=
KCl
+
O2
Это уравнение также подчиняется требованию электронного баланса:
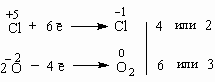
Здесь возникает сложность - какой из двух найденных коэффициентов поставить перед KClO3 - ведь эта молекула содержит и окислитель и восстановитель? В таких случаях найденные коэффициенты ставятся перед продуктами:
KClO3 = 2KCl + 3O2
Теперь ясно, что перед KClO3 надо поставить коэффициент 2.
2KClO3 = 2KCl + 3O2
Внутримолекулярная реакция разложения бертолетовой соли при нагревании используется при получении кислорода в лаборатории.
Мы рассмотрели важнейшие типы окислительно-восстановительных реакций и метод электронного баланса, но не пока не касались вопроса составления уравнений таких реакций.
Распространенное заблуждение заключается в том, что вы можете сразу предсказать продукт (или продукты) окислительно-восстановительной реакции. Это не так. Лишь по мере накопления опыта, особенно в лаборатории, вы сможете делать все больше и больше правильных предсказаний. А пока следует научиться уравнивать реакции, реагенты и продукты которых заранее известны.
2. Задачи на закрепление.
1) Уравняйте следующие реакции с участием кислорода:
а) Li + O2 = Li2O
б) NH3 + O2 = N2 + H2O
в) NH3 + O2 = NO + H2O (идет с катализатором)
г) NO2 + H2O + O2 = HNO3
д) AgNO3 = Ag + NO2 + O2 (при нагревании)
е) PH3 + O2 = P2O5 + H2O
ж) P2O3 + O2 = P2O5
2) Исходя из электронного строения атомов элементов и закономерностей Периодической таблицы, напишите молекулярные формулы соединений кислорода со следующими элементами: кремнием (Si), селеном (Se) (два), стронцием (Sr), бором (B), скандием Sc.
3) После сгорания металлического кальция на воздухе образовался белый порошок массой 5,6 г. Какова была масса металлического кальция, взятого для опыта?
3. Домашнее задание: § 9, В(2,3)
4. Итог
Урок № 7
Дата:
Тема: Обобщающий урок. Решение задач
Оборудование: карточки с заданиями, классная доска, таблица растворимости.
Ход урока:
-
Организационный момент
-
Определение целей:
-
Обобщить знания учащихся о электролитической диссоциации солей, кислот и оснований, а также условий протекания реакций ионного обмена и гидролиза;
-
Совершенствовать умения экспериментально обнаруживать химические вещества в растворе, на основе теоретических знаний выполнять практические задания, сравнивать, обобщать, логически рассуждать, работать с наглядным материалом;
-
Воспитывать ответственное отношение к собственному здоровью (в связи или вредом поступления в организм некоторых ионов солей).
На доске висит карта маршрута восхождения к вершине «ТЭД», на столе - образцы соединений.
1. Постановка целей. Ребята на протяжении нескольких уроков мы прилагали усилия и готовили необходимое снаряжение (теоретические и практические знания), чтобы совершить увлекательное путешествие и покорить вершину под названием «ТЭД». Для этого вам предстоит выполнить ряд заданий: пройти маршрут, состоящий из трех препятствий, обозначенных на маршрутной карте, выбрать правильный путь к намеченной цели, потом выполнить групповые задания и заполнить предлагаемую вам схему.
Итак, у нас две команды. Выберите своего капитана. Капитан будет координировать работу своей команды, отмечать на маршрутной карте найденный путь и называть ключевое слово, которое сложится из букв, соответствующих вашим заданиям. Капитан будет не только помогать, но и оценивать работу своей команды в течение всего урока.
Каждый из вас должен выполнить свое задание и внести лепту в преодолении трудностей, стоящих на пути вашего отряда. Не забывайте, что вы - команда, где все придут на помощь друг другу. У каждого из вас лежит руководство к уроку (Приложение). Как всегда, оно будет для вас хорошим помощником.
2. Интеллектуальная разминка. Активизация мыслительной деятельности учащихся.
1) мозговой штурм. Без раздумий устно сказать, как будут диссоциировать вещества указанные на доске.
Первая команда: серная кислота, гидрофосфат натрия, хлорид кальция.
Вторая команда: азотная кислота, годроксохлорид железа (2), нитрат натрия.
2) дайте общие определения с точки зрения ТЭД приведенным ниже группам веществ.
I команда
А) HCl, HNO3, H2CO3, H3PO4.
II команда
B) NaCl, Ca(OH)Cl, NaHSO4.
3) С какими понятиями или явлениями по теме у вас ассоциируются следующие слова и словосочетания?
I команда: а)соленная вода; б) электропроводимость.
II команда: а) причины; б) достаток.
3. Обобщающее повторение.
Повторение проводится по в форме прохождения маршрута. На работу в парах отводится 4 мин, а каждой команде - по 3 мин.
Учитель. Переходим к третьему этапу урока. Каждый из вас получил задания маршрута вашей команды и маршрутов других команд. У 1-ой команды - маршрут А, у 2-ой команды - маршрут Б.
Выполняя задания одно за другим, вы переходите от одной буквы к другой. Из букв составляется слово. Капитаны отмечают путь своего отряда на маршрутной карте.
МАРШРУТ А
Задание 1. Соединения, при диссоциации которых в растворе образуются гидроксид-ионы называются …
-
Кислотами; 2) основаниями.
(ответ. 2, буква «Т».)
Задание 2. Выберите уравнение протекающее до конца.
А) CaSO4 + Na2CO3 = CaCO3 + Na2SO4;
Б)Ca(HCO3) + Ca(OH)2 = 2CaCO3 + 2H2O;
В) NaCl + KNO3 = NaNO3 +KCl.
1) а, б; 2) в.
(ответ. 1, буква «О».)
Задание 3. Какие соли не подвергаются гидролизу?
-
Образованные сильными кислотами и слабыми основаниями;
-
Образованные сильными кислотами и сильными основаниями.
(Ответ. 2, буква «М».)
Ключевое слово - АТОМ.
МАРШРУТ К
Задание 1. Соединения, при диссоциации которых в растворе образуются катионы водорода называются …
-
Кислотами; 2) солями.
(Ответ. 1, буква «Р».)
Задание 2. Выберите уравнение протекающее не до конца.
А) CaSO4 + Na2CO3 = CaCO3 + Na2SO4;
Б)Ca(HCO3) + Ca(OH)2 = 2CaCO3 + 2H2O;
В) NaCl + KNO3 = NaNO3 +KCl.
1) а, б; 2) в.
(Ответ. 2, буква «Е».)
Задание 3. Какие соли подвергаются гидролизу?
-
Образованные сильными кислотами и сильными основаниями;
-
Образованные сильными кислотами и слабыми основаниями.
(Ответ. 2, буква «М».)
4. Обобщающее повторение. РИО, гидролиз, решение задач на избыток и недостаток.
Повторение проводится в форме групповой работы. Капитаны становятся координаторами, организующими работу своей группы, а также отвечающими за заполнение таблицы по итогам работы. Капитаны также принимают участие в оценке деятельности членов своей команды и своей группы в целом. На выполнение индивидуального задания отводится 5 мин. Затем учащиеся совместно заполняют таблицу, учитель обобщает результаты работы всех групп.
Ученикам, выполняющим практические задания, напоминаются правила техники безопасности.
Задания различаются по уровню сложности, т.е. используется дифференцированный подход в соответствии со способностями учеников.
Задания 1-ой команде.
Задание 1. Составьте уравнение реакции между нитратом магния и гидроксидом калия в молекулярной, ионной и сокращенной ионной формах.
Задание 2. Какова будет реакция среды (кислая или щелочная) в водных растворах следующих солей: а) нитрат серебра; б) карбонат калия; гидрокарбонат калия; г) сульфат цинка?
Задание 3. Определите концентрацию раствора серной кислоты, если концентрация сульфат-ионов составляет 3*10-3 моль/л и α=0,01.
Задание 4. Сколько литров водорода (н.у.) выделится при взаимодействии 40 г цинка с раствором серной кислоты объемом 200 мл и массовой долей 0,2 (ρ=1,143 г/мл)?
Задания 2-ой команде.
Задание 1. Составьте уравнение реакции между карбонатом натрия и хлоридом бария в молекулярной, ионной и сокращенной ионной формах.
Задание 2. Составьте уравнения реакций гидролиза следующих солей в молекулярной, ионной и сокращенной ионной формах: а) гидросульфит натрия; б) фторид натрия; в) хлорид магния; г) сульфит натрия. Укажите реакцию среды в растворах этих солей.
Задание 3. Рассчитайте концентрацию ионов алюминия и сульфат-ионов, если концентрация раствора сульфата алюминия 0,001 моль/л и степень диссоциации 90%.
Задание 4. Сколько литров углекислого газа (н.у.) выделится при взаимодействии мрамора, массой 20 г, со 120 мл 15%-ной (ρ=1,075 г/мл) соляной кислотой?
5. Итоговое тестирование
Выберите правильные утверждения.
Вариант 1
-
При растворении в воде вещества распадаются на ионы.
-
Диссоциация не обусловлена гидратацией веществ.
-
Под действием электрического тока ионы приобретают направленное движение.
-
Диссоциация - это распад.
-
Многоосновные кислоты диссоциируют одноступенчато.
-
Молярной концентрацией называется величина, показывающая количество молей растворенного вещества в 1 литре раствора.
-
Реакция обратима, если в результате не образуется ни осадок, ни газ и ни вода.
-
Реакция ионного обмена протекает до конца, если в результате образуется только газ.
-
По химической природе соли подразделяются на 4 группы.
-
Соли, образованные слабой кислотой и слабым основанием полностью гидролизуются
Вариант 2.
-
При растворении в воде вещества не распадаются на ионы.
-
Диссоциация обусловлена гидратацией веществ.
-
Ассоциация - это распад.
-
Высокое содержание катионов водорода дает кислую среду раствора.
-
Реакцией нейтрализации называется реакция взаимодействия сильных кислот с сильными основаниями.
-
Кислые соли диссоциируют одноступенчато.
-
Серная кислота - это сильный электролит.
-
Гидролизом соли называется взаимодействие ионов соли с ионами волы, в результате, которого образуются молекулы или ионы слабого электролита.
-
Реакция ионного обмена необратима, если в результате образуются газ, осадок или слабый электролит.
-
Универсальный индикатор в щелочной среде окрашивается в красный цвет.
6. Домашнее задание: А(1,2,3), В(1,2), С(3)
7. Итог
Урок № 8
Дата:
Тема: "Решение экспериментальных задач"
Тип урок: Практическая работа №1
Оборудование: карточки с заданиями, классная доска, таблица растворимости.
Ход урока:
-
-
Организационный момент
-
Определение целей:
-
-
Обобщить и систематизировать знания по теме ТЭД;
-
Повторить и закрепить тему ТЭД;
-
Способствовать воспитанию ответственности и бережного отношения к окружающим.
3. Выполнение практической работы по электронному учебнику «Химия 9 класс».
Оформить работу в тетради для практических работ, записав все необходимые уравнения реакций. Сделать вывод.
4. Домашнее задание: выполните тестовые задания на странице 56-59.
5.Итог.
Урок № 9
Дата:
Тема: Зачет
Оборудование: карточки с заданиями, классная доска, таблица растворимости.
Ход урока:
1.Организационный момент
-
Определение целей:
-
Выявить уровень знаний учащихся по теме ТЭД;
-
Релейные зачет
Вопросы к зачету.
-
-
Какие вещества называются электролитами и неэлектролитами?∆
-
Вещества, с какими типами связей подвергаются диссоциации?∆
-
Что называют Электролитической диссоциацией?∆
-
Основные положения ТЭД.∆
-
Дайте определения солям, кислотам и основаниям с точки зрения ТЭД. Приведите 3 примера. Напишите уравнения диссоциации.
-
Что называется степенью электролитической диссоциации?∆
-
От каких факторов и как зависит степень диссоциации?
-
Вода, хоть и в очень незначительной степени, диссоциирует на ионы. Можно ли утверждать, что вода проявляет и кислотность, и основность?○
-
На какие группы делятся электролиты по значению степени диссоциации?
-
Правомерно ли утверждать, что свойство растворов электролитов - это свойства ионов ?○
-
Каковы условия протекания реакции ионного обмена до конца? Приведите по 3 примера на каждый случай.
-
Какую реакцию называют реакцией нейтрализации? Приведите 3 примера. Напишите уравнения реакций.
-
Опишите алгоритм решения задачи на избыток и недостаток.○
-
Какой ион обуславливает общность свойств кислот?○
-
Какой ион обуславливает общность свойств оснований?
-
Какие ионы образуются в растворах солей? Приведите пример.○
-
Как протекают реакции электролитической диссоциации многоосновных кислот и многокислотных оснований?○
-
∆ - задания на «3»
- задания на «4»
○ - задания на «5»
4. Итог
Урок № 10
Дата:
Тема: Контрольная работа №1
Оборудование: карточки с заданиями, классная доска, таблица растворимости.
Ход урока:
-
-
Организационный момент
-
2.Определение целей:
-
Обобщение и систематизация знаний по теме ТЭД
-
Повторение и закрепление темы ТЭД;
3.Контрольная работа.
Вариант I
-
Напишите уравнения электролитической диссоциации следующих соединений:
а) Na2SO4
б) FeOHCl
-
Составьте общие и ионные уравнения реакций
a) Al(NO3)3 + LiOH =
б) Na 2CO3 + KCl =
Напишите в каких случаях идет реакция, а в каких нет.
-
Напишите уравнения гидролиза сульфата цинка и фосфата калия (полные и ионные). Какова среда растворов?
-
Сколько литров водорода (н.у.) Выделится при взаимодействии 40 г цинка с раствором серной кислота объемом 200 мл и массовой долей 0,2 (плотность 1,143 г/мл).
Вариант II
1. Напишите уравнения электролитической диссоциации следующих соединений:
а) H3PO4
б) KHSO4
2. Составьте общие и ионные уравнения реакций
А) NaNO3 + ZnCl2 =
Б) FeCl3 + NaOH =
3.Напишите в каких случаях идет реакция, а в каких нет.
4.Напишите уравнения гидролиза хлорида натрия и хлорида меди (полные и ионные) Какова среда растворов?
5.Рассчитайте объем сероводорода (н.у.), выделившегося при взаимодействии сульфида железа (11), массой 205 г, с раствором соляной кислоты, содержащей 160 г HСl.
4. Итог.