- Учителю
- КТП химия 9 класс Габриелян
КТП химия 9 класс Габриелян
Муниципальное бюджетное общеобразовательное учреждение
«Основная общеобразовательная школа №9»
РАССМОТРЕНО
на заседании МО учителей естественно
математического цикла
Протокол №______
от«___»___2016 г.
СОГЛАСОВАНО
_______ заместитель директора
Васильева Е.А.
«___»________2016г.
РАССМОТРЕНО
на заседании педагогического совета
Протокол № _____
от «___» 2016 г.
УТВЕРЖДЕНО
приказом директора МБОУ «ООО школа №9»
№ ______
от « » 2016 г.
Календарно-тематическое планирование
по химии для 9 класса
(ФКГОС ООО)
Составитель: Шишова Л.Л.,
учитель химии
2016-2017 учебный год
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Календарно - тематическое планирование по химии для 9 класса, базовый уровень, составлена на основе авторской программы курса химии для 8-9 классов О.С.Габриеляна для общеобразовательных учреждений (Программа курса химии для 8-11 классов общеобразовательных учреждений /О.С. Габриелян. - 8-е изд.,стереотип. - М.: Дрофа, 2011).
Рабочая программа обеспечена следующим учебно-методическим комплектом:
Габриелян О. С. «Химия. 9 класс». Учебник для общеобразовательных учреждений. - М.: Дрофа, 2010 г.
Календарно - тематическое планирование в 9 классе составлено из расчета 34 учебные недели, 68 часов в год, 2 часа в неделю.
КАЛЕНДАРНО-ТЕМАТИЧЕСКИЙ ПЛАН
п/п
Наименования разделов и тем
Часы учебного времени
Плановые сроки прохождения
Примечание
Повторение основных вопросов курса8 класса и введение в курс 9 класса
6
1
Вводный инструктаж по технике безопасности в кабинете химии. Характеристика элемента на основании его положения в периодической системе химических элементов Д. И. Менделеева.
1
06.09
2
Классификация веществ. Химические свойства простых веществ. Свойства оксидов в свете теории электролитической диссоциации.
1
07.09
3
Свойства кислот, оснований и солей в свете теории электролитической диссоциации.
1
13.09
4
Понятие о переходных элементах. Амфотерность. Генетический ряд переходного элемента.
1
14.09
5
Периодический закон и периодическая система химических элементов Д. И. Менделеева в свете учения о строении атома.
1
20.09
6
Контрольная работа №1 по теме «Повторение основных вопросов курса 8 класса»
1
27.09
ТЕМА 1. Металлы
15
7
Положение металлов в периодической системе химических элементов Д. И. Менделеева. Строение атомов.
1
28.09
8
Общие физические свойства металлов.
1
04.10
9
Сплавы, их свойства и значение.
1
05.10
10
</<font color="#000000">Химические свойства металлов как восстановителей. Электрохимический ряд напряжений металлов.
1
11.10
11
Способы получения металлов: пиро-, гидро- и электрометаллургия.
1
12.10
12
Коррозия металлов и способы борьбы с ней.
1
18.10
13
Обобщение знаний по теме: «Общие свойства металлов»
1
19.10
14
Щелочные металлы
1
25.10
15
Общая характеристика элементов главной подгруппы II группы.
1
26.10
16
Алюминий.
1
08.11
17
Важнейшие соединения алюминия. Применение алюминия и его соединений.
1
09.11
18
Железо: строение атома, физические и химические свойства простого вещества.
1
15.11
19
Соединения железа. Качественные реакции на Fe2+ и Fe3+.
1
16.11
20
Обобщение по теме «Металлы». Подготовка к контрольной работе.
1
22.11
21
Контрольная работа № 2 по теме «Металлы».
1
23.11
ТЕМА 2.Практикум № 1Свойства металлов и их соединений
3
22
Практическая работа № 1. Осуществление цепочки химических превращений металлов.
1
29.11
23
Практическая работа № 2. Получение и свойства соединений металлов.
1
30.11
24
Практическая работа № 3. Решение экспериментальных задач на распознавание и получение веществ
1
06.12
ТЕМА 3. Неметаллы
23
25
Общая характеристика неметаллов
1
07.12
26
Водород
1
13.12
27
Сравнительная характеристика галогенов.
1
14.12
28
Основные соединения галогенов.
1
20.12
29
Применение галогенов и их соединений в народном хозяйстве. Краткие сведения о хлоре, броме, фторе и йоде.
1
21.12
30
Кислород: строение атома, аллотропия, свойства и применение.
1
27.12
31
Сера
1
28.12
32
Оксиды серы (IV) и (VI), их получение, свойства и применение. Сероводородная и сернистая кислоты.
1
17.01
33
Серная кислота и ее соли, их применение в народном хозяйстве.
Качественная реакция на сульфат-ион.
1
18.01
34
Обобщение знаний по теме: «Водород. Кислород. Галогены. Сера».
1
24.01
35
Азот: строение атома и молекулы, свойства простого вещества.
1
25.01
36
Аммиак: строение, свойства, получение и применение.
1
31.01
37
Соли аммония. Оксиды азота (II) и (IV).
1
01.02
38
Азотная кислота, ее свойства и применение. Нитраты и нитриты. Азотные удобрения
1
07.02
39
Фосфор: строение атома, аллотропия, свойства белого и красного фосфора, их применение.
1
08.02
40
Основные соединения фосфора. Фосфорные удобрения.
1
14.02
41
Углерод: строение атома, аллотропия, свойства, применение.
1
15.02
42
Оксиды углерода (II) и (IV), их свойства и применение. Качественная реакция на углекислый газ.
1
21.02
43
Угольная кислота. Карбонаты. Качественная реакция на карбонат-ион.
1
22.02
44
Кремний: строение атома, кристаллический кремний, его свойства и применение. Оксид кремния (IV), его природные разновидности
1
28.02
45
Силикаты. Значение соединений кремния в живой и неживой природе. Понятие о силикатной промышленности.
1
01.03
46
Обобщение знаний по теме «Углерод и кремний». Подготовка к контрольной работе
1
07.03
47
Контрольная работа №3 по теме «Неметаллы»
1
08.03
ТЕМА 4Практикум № 2Свойства неметаллов и их соединений
3
48
Практическая работа № 4. Решение экспериментальных задач по теме «Подгруппа кислорода».
1
14.03
49
Практическая работа № 5.Решение экспериментальных задач по теме «Подгруппы азота и углерода».
1
15.03
50
Практическая работа № 6.Получение, собирание и распознавание газов.
1
21.03
ТЕМА 5. Органические соединения
10
51
Предмет органической химии. Причины многообразия органических соединений. Химическое строение органических соединений.
1
22.03
52
Предельные углеводороды на примере метана и этана.
1
04.04
53
Непредельные углеводороды на примере этилена.
1
05.04
54
Спирты.
1
11.04
55
Одноосновные предельные карбоновые кислоты. Сложные эфиры.
1
12.04
56
Жиры.
1
18.04
57
Понятие об аминокислотах. Реакции поликонденсации.
1
19.04
58
Белки, их строение и биологическая роль.
1
25.04
59
Углеводы.
1
26.04
60
Полимеры.
1
02.05
ТЕМА 6. Обобщение знаний по химииза курс основной школы
8
61
Физический смысл порядкового номера элемента в периодической системе химических элементов Д. И. Менделеева, номеров периода и группы.
1
03.05
62
Закономерности изменения свойств элементов и их соединений в периодах и группах в свете представлений о строении атомов элементов. Значение периодического закона.
1
09.05
63
Типы химических связей и типы кристаллических решеток. Взаимосвязь строения и свойств веществ
1
10.05
64
Классификация химических реакций по различным признакам.
1
15.05
65
Простые и сложные вещества. Металлы и неметаллы. Генетические ряды металла, неметалла и переходного металла.
1
17.05
66
Оксиды, гидроксиды и соли: состав, классификация и общие химические свойства в свете теории электролитической диссоциации.
1
19.05
67
Итоговая контрольная работа №4 за курс основной школы.
1
23.05
68
Заключительный урок.
1
24.05
ФОРМЫ И СРЕДСТВА КОНТРОЛЯ
Контрольная работа №1 по теме «Повторение основных вопросов курса 8 класса»
Вариант 1
Часть А. Тестовые задания с выбором ответа
1. Химический элемент, имеющий схему строения атома +14 )2 )8 )4 , в Периодической системе занимает положение:
А. 4-й период, главная подгруппа III группы.
Б. 2-й период, главная подгруппа VI группы.
В. 3-й период, главная подгруппа IV группы.
Г. 3-й период, главная подгруппа II группы.
2. Строение внешнего энергетического уровня 3s23p5 соответствует атому элемента:
А. Магния. Б. Серы. В. Фосфора. Г. Хлора.
3. Элемент с наиболее ярко выраженными неметаллическими свойствами:
А. Кремний. Б. Магний. В. Сера. Г. Фосфор.
4.Оксид элемента Э с зарядом ядра +16 соответствует общей формуле:
А. Э2О Б. ЭО В. Э2О3 Г. ЭО3
5. Характер свойств высшего оксида химического элемента с порядковым номером 7 в Периодической системе:
А. Амфотерный Б. Кислотный В. Основный
6. Основные свойства наиболее ярко выражены у высшего гидроксида:
А. Бария. Б.Бериллия. В.Кальция. Г. Магния
7. Схема превращения Сu+2 Cu0 соответствует химическому уравнению:
А. CuO + H2 = Cu + H2O Б. CuO + 2HCl = CuCl2 + H2O
В. Cu + Cl2 = CuCl2 Г. 2Cu + O2 = 2CuO
8. Сокращённое ионное уравнение реакции Ba2+ + SO42- = BaSO4 соответствует взаимодействию:
А. Бария и раствора серной кислоты.
Б. Оксида бария и соляной кислоты.
В. Оксида бария и раствора серной кислоты.
Г. Хлорида бария и раствора серной кислоты.
9. Формула вещества, реагирующего с раствором гидроксида кальция:
А. HCl. Б.CuO. В. H2O. Г. Mg.
10. Элементом Э в схеме превращений Э ЭО2 Н2ЭО3 является:
А. Азот. Б. Магний. В. Алюминий. Г. Углерод.
Часть В. Задания со свободным ответом
В11. Соотнесите.
Формула оксида:
1. CuO. 2. CO2. 3. Al2O3. 4. SO3.
Формула гидроксида:
А. H2SO4. Б. Al(OH)3 .В. Cu(OH)2. Г. CuOH. Д. H2CO3.
В12. Запишите уравнения реакций между растворами гидроксида элемента с порядковым номером 3 и водородного соединения элемента с порядковым номером 9 в Периодической системе. Назовите все вещества, укажите тип реакции.
Ответы
Вариант №1.Часть А.
А2
А3
А4
А5
А6
А7
А8
А9
А10
В
Г
В
Г
Б
А
А
Г
А
Г
Часть В.
В11.(6 баллов)
1 - В, 2 - Д, 3 - Б, 4 - А.
В12.(8 баллов)
LiOH + HF = LiF + H2O обмена, нейтрализации
гидроксид лития + фтороводород = фторид лития + вода.
Вариант 2
Часть А. Тестовые задания с выбором ответа
1. Химический элемент, имеющий схему строения атома +8 )2 )6 , в Периодической системе занимает положение:
А. 2-й период, главная подгруппа VII группы.
Б. 2-й период, главная подгруппа VI группы.
В. 3-й период, главная подгруппа VI группы.
Г. 2-й период, главная подгруппа II группы.
2. Строение внешнего энергетического уровня 2s22p1 соответствует атому элемента:
А. Бора. Б. Серы. В. Кремния. Г. Углерода.
3.Элемент с наиболее ярко выраженными металлическими свойствами:
А. Калий Б. Литий В. Натрий Г. Рубидий
4.Оксид элемента Э с зарядом ядра +11 соответствует общей формуле:
А. Э2О Б. ЭО В. ЭО2 Г. ЭО3
5. Характер свойств высшего оксида химического элемента с порядковым номером 6 в Периодической системе:
А. Амфотерный. Б. Кислотный. В. Основный.
6.Кислотные свойства наиболее ярко выражены у высшего гидроксида:
А. Алюминия Б. Кремния В. Углерода Г. Фосфора
7. Схема превращения С0 C+4 соответствует химическому уравнению:
А. СО2 + СаО = СаСО3 Б. СО2 + Н2О = Н2СО3
В. С + 2СuО = 2Сu + СО2 Г. 2С + О2 = 2СО
8.Сокращённое ионное уравнение реакции Н+ + ОН- = Н2О соответствует взаимодействию:
А. Гидроксида меди (II) и раствора серной кислоты.
Б. Гидроксида натрия и раствора азотной кислоты.
В. Оксида меди (II) и соляной кислоты.
Г.Цинка и раствора серной кислоты.
9.Формула вещества, реагирующего с оксидом меди (II):
А. H2O. Б. MgO. В. CaCl2. Г. H2SO4.
10.Элементом Э в схеме превращений Э Э2О5 Н3ЭО4 является:
А. Азот. Б. Сера. В. Углерод. Г. Фосфор.
Часть В. Задания со свободным ответом
В11.Соотнесите.
Формула гидроксида:
1.H3PO4. 2.Ba(OH)2 . 3. Fe(OH)3 . 4. H2SO4..
Формула оксида:
А. FeO .Б. Fe2O3. В. BaO. Г. SO3. Д. P2O5.
В12. Запишите уравнения реакций между растворами гидроксида элемента с порядковым номером 20 и водородного соединения элемента с порядковым номером 17 в Периодической системе. Назовите все вещества, укажите тип реакции.
Ответы
Часть А.
А2
А3
А4
А5
А6
А7
А8
А9
А10
Б
А
Г
А
Б
Г
В
Б
Г
Г
Часть В.
В11.
1 - Д, 2 - В, 3 - Б, 4 - Г.
В12.
Са(OH)2 + 2HСl = CaCl2 + 2 H2O обмена, нейтрализации
гидроксид кальция + соляная кислота = хлорид кальция + вода.
Контрольная работа № 2
МЕТАЛЛЫ
ВАРИАНТ- 1.
А 1. Электронная формула атома магния:
1) 1s2 2s2 3) 1s2 2s3
2) 1s2 2s2 2p1 4) 1s2 2s2 2p6 3 s2
А 2. Электронная формула внешнего энергетического уровня атомов элементов главной подгруппы II группы ПС:
1) n s1 2) n s2 3) n s2 n p1 4) n s2 n p2
А 3. Простое вещество с наиболее ярко выраженными металлическими свойствами:
1) бериллий 3) магний
2) кальций 4) стронций
А 4. Наиболее энергично взаимодействует с водой:
1) калий 3) кальций
2) скандий 4) магний
А 5. С разбавленной серной кислотой не взаимодействует:
1) железо 3) платина
2) никель 4) цинк
А 6. Верны ли следующие суждения о щелочных металлах?
А. Во всех соединениях они имеют степень окисления + 1.
Б. С неметаллами они образуют соединения с ионной связью.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
Часть 2.
В задании В1 на установление соответствия запишите последовательность цифр без пробелов и других символов.
В1. Установите соответствие между элементом и формулой его высшего оксида
ЭЛЕМЕНТ ВЫСШИЙ ОКСИД
А) Cs 1) ЭО3
Б) Al 2) Э2О5
В) Ca 3) Э2О
Г) K 4) Э2О3
5) ЭО
6) Э2О7
Часть 3
Запишите номер задания и дайте полный ответ.
С 1. По схеме превращений составьте уравнения реакций в молекулярном виде. Для превращения № 3 запишите полное и сокращенное ионные уравнения. Назовите все вещества.
Cu(OH)2 CuO CuSO4 Cu(OH)2
Ответы:1
2
3
4
5
6
4
2
4
1
3
3
Часть 2.
В1. А- 3 Б- 4 В- 5 Г-3
Часть 3
С 1
Cu(OH)2 = CuO + H2O.
CuO+ SO3 =Cu SO4
CuSO4+ KOH= Cu(OH)2+K2 SO4
ВАРИАНТ - 2
Часть 1.
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А 1. Электронная формула атома лития:
1) 1s2 2s2 3) 1s2 2s1
2) 1s2 2s2 2p1 4) 1s2 2s2 2p6 3 s1
А 2. Электронная формула внешнего энергетического уровня атомов щелочных металлов:
1) n s1 2) n s2 3) n s2 n p1 4) n s2 n p2
А 3. Простое вещество с наиболее ярко выраженными металлическими свойствами:
1) алюминий 3) галлий
2) бор 4) индий
А 4. Наиболее энергично взаимодействует с водой:
1) барий 3) магний
2) кальций 4) стронций
А 5. С соляной кислотой не взаимодействует:
1) железо 3) платина
2) никель 4) цинк
А 6. Верны ли следующие суждения?
А. Гидроксид алюминия взаимодействует с гидроксидом натрия
Б. Гидроксид алюминия взаимодействует с серной кислотой
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны.
Часть 2.
В задании В1 на установление соответствия запишите последовательность цифр без пробелов и других символов.
В1. Установите соответствие между формулой гидроксида и формулой соответствующего ему оксида:
ФОРМУЛА ФОРМУЛА
ГИДРОКСИДА ОКСИДА
А) ЭОН 1) Al2O3
Б) Э(ОН)3 2) Na2O
В) Н3ЭО3 3) MgO
Г) Э(ОН)2 4) NO
5) CO
6) SO3
Часть 3
Запишите номер задания и дайте полный ответ.
С 1. По схеме превращений составьте уравнения реакций в молекулярном виде. Превращение № 1 рассмотрите с точки зрения ОВР. Назовите все вещества.
Zn ZnO ZnCl2 Zn(OH)2
Ответы1
2
3
4
5
6
3
1
4
4
3
2
Часть 2.
В1. А- 2 Б-1 В- 6 Г-3
Часть 3
С 1
2Zn + O₂ = 2ZnO
ZnO + 2HCl = ZnCl2 + H2O
ZnCl2+2KOH - Zn(OH)2+2KCl
Контрольная работа №3 по теме «Неметаллы»
1 вариант
А1. В каком ряду представлены простые вещества-неметаллы:
1) хлор, никель, серебро 3) железо, фосфор, ртуть
2) алмаз, сера, кальций 4) кислород, озон, азот
А2. Химическому элементу 3-го периода V группы периодической системы Д.И.Менделеева соответствует схема распределения электронов по слоям:
1) 2,8,5 2) 2,3 3) 2,8,3 4) 2,5
А3. У элементов подгруппы углерода с увеличением атомного номера уменьшается:
1) атомный радиус 3) число валентных электронов в атомах
2) заряд ядра атома 4) электроотрицательность
А4. Наиболее прочная химическая связь в молекуле
1) F2 2) Cl2 3) O2 4) N2
А5. Взаимодействие аммиака с хлороводородом относится к реакциям:
1) разложения 2) соединения 3) замещения 4) обмена
А6. Сокращенное ионное уравнение реакции Ag+ + Cl- AgCl
соответствует взаимодействию между растворами:
1) карбоната серебра и соляной кислоты
2) нитрата серебра и серной кислоты
3) нитрата серебра и соляной кислоты
4) сульфата серебра и азотной кислоты
А7. Горящая свеча гаснет в закрытой пробкой банке, потому что:
1) не хватает кислорода 3) повышается содержание азота
2) повышается температура 4) образуется водяной пар, гасящий пламя
А8. С помощью раствора серной кислоты можно осуществить превращения:
1) медь сульфат меди (II) 3) карбонат натрия оксид углерода ( IV)
2) углерод оксид углерода (IV) 4) хлорид серебра хлороводород
Часть В.
В1. Неметаллические свойства в ряду элементов Si P S Cl слева направо:
1) не изменяются 3) ослабевают
2) усиливаются 4) изменяются периодически
Ответом к заданию В2 является последовательность букв. Запишите выбранные буквы в алфавитном порядке.
В2. Смещение равновесия системы N2 + 3H2 <=>2 NH3 + Q в сторону продукта реакции произойдет в случае:
А) увеличения концентрации аммиака
Б) использования катализатора
В) уменьшения давления
Г) уменьшения концентрации аммиака
В3. Какой объем (н.у.) хлороводорода можно получить из 2 моль хлора?
Часть С.
С1. Найти массу серной кислоты, необходимой для нейтрализации 200 г 20%-ного раствора гидроксида натрия.
2 вариант
Часть А.
К каждому заданию части А даны несколько ответов, из которых только один правильный. Выберите верный, по Вашему мнению, ответ.
А1. О кислороде как о простом веществе говорится в предложении:
1) растения, животные и человек дышат кислородом
2) кислород входит в состав воды
3) оксиды состоят из двух элементов, один из которых - кислород
4) кислород входит в состав химических соединений, из которых построена живая
клетка
А2. В атоме фосфора общее число электронов и число электронных слоев соответственно
равны: 1) 31 и 4 2) 15 и5 3) 15 и 3 4) 31 и 5
А3. Сумма протонов и нейтронов в атоме углерода равны:
1) 14 2) 12 3) 15 4) 13
А4. Ковалентная полярная химическая связь характерна для:
1) KCl 2) HBr 3) P4 4) CaCl2
А5. Реакция, уравнение которой 3N2 + H2 <=> 2NH3 + Q , относят к реакциям:
1) обратимым, экзотермическим 3) обратимым, эндотермическим
2) необратимым, экзотермическим 4) необратимым, эндотермическим
А6. Для того, чтобы доказать, что в пробирке находится раствор угольной кислоты,
необходимо использовать: 1) соляную кислоту 3) тлеющую лучинку
2) раствор аммиака 4) раствор гидроксида натрия
А7. Признаком реакции между соляной кислотой и цинком является:
1) появление запаха 3) выделение газа
2) образование осадка 4) изменение цвета раствора
А8. Сокращенному ионному уравнению Ba2+ + SO42- BaSO4 соответствует
Взаимодействие между: 1) фосфатом бария и раствором серной кислоты
2) растворами сульфата натрия и нитрата бария
3) растворами гидроксида бария и серной кислоты
4) карбонатом бария и раствором серной кислоты
Часть В.
В1. С уменьшением порядкового номера в А(главных)подгруппах периодической системы Д.И.Менделеева неметаллические свойства химических элементов :
1) не изменяются 3) изменяются периодически
2) усиливаются 4) ослабевают
Ответом к заданию В2 является последовательность букв. Запишите выбранные буквы в алфавитном порядке.
В2. Какие из перечисленных условий не повлияют на смещение равновесия в системе
H2 + Cl2 <=> 2HCl - Q : А) понижение температуры
Б) повышение температуры
В) введение катализатора
Г) понижение концентрации HCl
Д) понижение давления
В3. Какой объем газа ( н.у.) выделится при полном сгорании 600 г угля?
Часть С.
С1. При обработке 300 г древесной золы избытком соляной кислоты, получили 44,8л(н.у.) углекислого газа. Какова массовая доля (%) карбоната калия в исходном образце золы?
Ответы и решения
№ А1 А2 А3 А4 А5 А6 А7 А8 В1 В2 В3 С1
1 4 1 4 4 2 3 1 3 2 ВГ 89,6л 49г
2 1 3 2 2 1 1 3 2 2 ВД 1120л 92%
1 вариант (С1)
1) Составлено уравнение реакции H2SO4 + 2NaOH = Na2SO4 + 2H2O
2) Рассчитана масса гидроксида натрия
m(NaOH)=200*20/100=40(г)
3) Найдена масса серной кислоты m(H2SO4)=98*40/80=49(г)
2 вариант (С1)
1) Составлено уравнение реакции K2CO3 + 2HCl= 2KCl + CO2 + H2O
2) Рассчитана масса карбоната калия
m(K2CO3)=138*44,8/22,4=276(г)
3) Определена массовая доля карбоната калия в образце золы
w(K2CO3)=276*100/300=92(%)
Итоговая контрольная работа №4
Задание 1 . Три электрона находятся во внешнем электронном слое атома
1) углерода
2) мышьяка
3) алюминия
4)лития
Задание 2 . Неметаллические свойства у кремния выражены сильнее,
чем у
1) углерода
2) азота
3) алюминия
4) фосфора
Задание 3 . Соединениями с ковалентной неполярной и ионной связью являются соответственно
1) оксид фосфора и оксид натрия
2) хлорид натрия и хлор
3) азот и сульфид натрия
4) хлорид кальция и хлороводород
Задание 4 . В каком веществе степень окисления азота равна −3?
1) Mg (NO3)2
2) NO2
3) N2O3
4) NH4Cl
Задание 5 . Названия только простых веществ записаны в ряду:
1) оксид магния, оксид серы(IV)
2) углекислый газ, угарный газ
3) железо, аммиак
4) алмаз, графит
Задание 6. К химическим явлениям относится процесс
1) кипения спирта
2) плавления серы
3) испарения воды
4) горения серы
Задание 7 . Общее количество положительных и отрицательных ионов, образовавшихся при полной диссоциации 0,5 моль нитрата алюминия, равно
1) 0,5 моль
2) 1 моль
3) 2 моль
4) 4 моль
Задание 8 . Верны ли следующие утверждения об углекислом газе?
А. Количество углекислого газа в атмосфере постоянно растёт благодаря деятельности человека.
Б. Углекислый газ - самый вредный компонент выхлопных газов.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
Задание 9. При выполнении задания из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны.
В ряду химических элементов S -P-Si происходит уменьшение (ослабление)
1) числа протонов в ядрах атомов
2) числа электронных слоев в атомах
3) радиуса атомов
4) металлических свойств
5) кислотного характера свойств высших оксидов
Задание 10. Для глицерина верны следующие утверждения:
1) молекула содержит одну группу - OH
2) является нерастворимой в воде жидкостью
3) все атомы в молекуле соединены только одинарными связями
4) вступает в реакцию с натрием
5) горит с образованием угарного газа и водорода
Задание 11. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
HCl+CrO3 Cl2+ CrCl3+H2O
Определите окислитель и восстановитель
Задание 12. При сжигании сульфида железа(II) на воздухе образовалось 32 кг оксида железа(III). Какой объём воздуха (н.у.) для этого потребовался? Объёмная доля кислорода в воздухе составляет 21 %.
Ответы:1
2
3
4
5
6
7
8
9
10
3
3
3
4
4
4
3
1
15
34
Задание 11
1) Составим электронный баланс:
Cr+6+ 3 e Cr+3
2Cl- -2 e Cl20
2) Указано, что Cr+6 - окислитель, а Cl- - восстановитель;
3) Расставлены коэффициенты в уравнении реакции:
12 HCl + 2CrO3 3Cl2 + 2CrCl3 + 6H2O
Задание 12
1) Составим уравнение реакции: 4FeS + 7O2 =2Fe2O3 + 4SO2
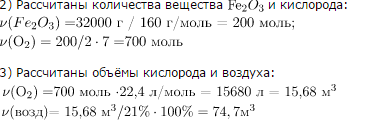
ПРАКТИЧЕСКИЕ РАБОТЫ
Практическая работа № 1 (смотреть в учебнике, стр. 84)
Практическая работа № 2 (смотреть в учебнике, стр. 84-85)
Практическая работа № 3 (смотреть в учебнике, стр. 86-87)
Практическая работа № 4 (смотреть в учебнике, стр. 187-188)
Практическая работа № 5 (смотреть в учебнике, стр. 188-189)
Практическая работа № 6 (смотреть в учебнике, стр. 189-192)
Критерии и нормы оценки знаний обучающихся
1. Оценка устного ответа.
Отметка «5» :
- ответ полный и правильный на основании изученных теорий;
- материал изложен в определенной логической последовательности, литературным языком;
- ответ самостоятельный.
Ответ «4» ;
- ответ полный и правильный на сновании изученных теорий;
- материал изложен в определенной логической последовательности, при этом допущены две-три несущественные ошибки, исправленные по требованию учителя.
Отметка «З» :
- ответ полный, но при этом допущена существенная ошибка или ответ неполный, несвязный.
Отметка «2» :
- при ответе обнаружено непонимание учащимся основного содержания учебного материала или допущены существенные ошибки, которые учащийся не может исправить при наводящих вопросах учителя, отсутствие ответа.
2. Оценка экспериментальных умений.
- Оценка ставится на основании наблюдения за учащимися и письменного отчета за работу. Отметка «5»:
- работа выполнена полностью и правильно, сделаны правильные наблюдения и выводы;
- эксперимент осуществлен по плану с учетом техники безопасности и правил работы с веществами и оборудованием;
- проявлены организационно - трудовые умения, поддерживаются чистота рабочего места и порядок (на столе, экономно используются реактивы).
Отметка «4» :
- работа выполнена правильно, сделаны правильные наблюдения и выводы, но при этом эксперимент проведен не полностью или допущены несущественные ошибки в работе с веществами и оборудованием.
Отметка «3»:
- работа выполнена правильно не менее чем наполовину или допущена существенная ошибка в ходе эксперимента в объяснении, в оформлении работы, в соблюдении правил техники безопасности на работе с веществами и оборудованием, которая исправляется по требованию учителя.
Отметка «2»:
- допущены две (и более) существенные ошибки в ходе: эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которые учащийся не может исправить даже по требованию учителя;
- работа не выполнена, у учащегося отсутствует экспериментальные умения.
3. Оценка умений решать расчетные задачи.
Отметка «5»:
- в логическом рассуждении и решении нет ошибок, задача решена рациональным способом;
Отметка «4»:
- в логическом рассуждении и решения нет существенных ошибок, но задача решена нерациональным способом, или допущено не более двух несущественных ошибок.
Отметка «3»:
- в логическом рассуждении нет существенных ошибок, но допущена существенная ошибка в математических расчетах.
Отметка «2»:
- имеется существенные ошибки в логическом рассуждении и в решении.
- отсутствие ответа на задание.
4. Оценка письменных контрольных работ.
Отметка «5»:
- ответ полный и правильный, возможна несущественная ошибка.
Отметка «4»:
- ответ неполный или допущено не более двух несущественных ошибок.
Отметка «3»:
- работа выполнена не менее чем наполовину, допущена одна существенная ошибка и при этом две-три несущественные.
Отметка «2»:
- работа выполнена меньше чем наполовину или содержит несколько существенных ошибок.
- работа не выполнена.
При оценке выполнения письменной контрольной работы необходимо учитывать требования единого орфографического режима.