- Учителю
- Методическая разработка: Способы получения коробоновых кислот, отдельные представители корбоновых кислот.
Методическая разработка: Способы получения коробоновых кислот, отдельные представители корбоновых кислот.
Департамент здравоохранения города Москвы
Государственное бюджетное образовательное учреждение
среднего профессионального образования
Медицинское училище № 13

Методическая разработка
теоретического занятия
(для преподавателя)
«Способы получения карбоновых кислот, отдельные представители. Соли карбоновых кислот»
Пояснительная записка
Данная методическая разработка предназначена для проведения теоретического занятия по дисциплине «Химия» по теме «Способы получения карбоновых кислот, отдельные представители и их значение. Соли карбоновых кислот»
В соответствии с рабочей программой целью данного теоретического занятия является получение студентами знаний о способах получения, отдельных представителях карбоновых кислот, о их значении для жизнедеятельности человека, о солях карбоновых кислот и их применении. Большое внимание уделяется использованию карбоновых кислот и их солей в медицине.
Занятие по теме « Карбоновые кислоты» является вторым, поэтому проводится с учетом знаний, полученных на первом уроке.
Занятие проводится в форме лекции, для лучшего усвоения нового материала создана призинтация. На первом занятии по теме « Карбоновые кислоты» учащиеся получили опережающие задания, сделать призентации по теме занятия, что позволяет развивать информационно- познавательную компетентность, формировать навык самообразования, развивать интерес к химии как к науке.
Методическая разработка содержит следующие части: методический блок с указанием целей, межпредметных связей, хронокартой, мотивацией (которая позволяет рассматривать кислоты не только как кислородосодержащие органические соединения, но и как источник химических ожогов); блок контроля исходного уровня знаний с указанием примерных вопросов для фронтального опроса; примерным текстом лекции; блок контроля эффективности обучения, содержащий задания в тестовой форме, позволяющие и преподавателю, и студентом выявить те разделы лекции, в усвоении которых возникли трудности. В конце занятия предусмотрена рефлексия, которая позволяет студентам оценить степень достижения целей, проанализировать причины затруднений, возникших на занятии.
Тема: «Способы получения карбоновых кислот, их отдельные представители. Соли карбоновых кислот»
Учебная дисциплина: Химия
Форма проведения: лекция
Тип занятия: комбинированное занятие
Время: 90 мин.
Место проведения занятия:кабинет химии
Цели занятия:
Учебные (слайд презентации №2):
студент должен знать:
-
Продолжить знакомства с кислородосодержащими соединениями на примере карбоновых кислот;
-
Рассмотреть генетическую связь между различными классами органических соединений на примере получения карбоновых кислот;
-
Углубить знания о кислотах на примере подробного изучения их отдельных представителей;
-
Рассказать о применении карбоновых кислот и их солей в медицине;
Развивающие:
-
Развивать способность к целеполаганию, планированию своей деятельности на уроке;
-
Развивать химическую речь, аргументированно отвечать на вопросы;
-
Развивать логическое мышление, способность к сравнению;
-
Развивать информационно- познавательную компетентность, формировать навык самообразования;
-
Развивать интерес к химии как к науке;
Воспитательные:
-
развивать интерес студентов к изучаемому вопросу и актуальности темы;
-
продолжить воспитывать заинтересованное отношение к учебе, активность и самостоятельность на занятии;
Конечные цели обучения и воспитания по теме сформулированы в виде профессиональных и общих компетенций.
1. Общие компетенции
Компетенции
-
Способность самостоятельно работать с информацией
-
Готовность выступать перед аудиторией
-
Готовность взаимодействовать и сотрудничать с другими студентами и преподавателем
-
Готовность использовать новые информационные технологии и современные методы, приемы, средства передачи и хранения информации

История:
«История развития химии как науки»
Фармакология:
« Применение карбоновых кислот для изготовления лекарственных препаратов
Биология:
«Участие карбоновых кислот в синтезе АТФ»
Сестринское дело в терапии:
«Виды ожогов Лечение химических ожогов»
Математика:
«Пропорции», «Процентные соотношения»


Химия:
«Способы получения карбоновых кислот, отдельные
представители.»
Безопасность жизнедеятельности и медицина катастроф
«Неотложная помощь при химических и термических ожогах»



Клиническая фармакология:
«Клиническая фармакология ЛС для лечения
щжогов»
Основы реабилитации:
«Реабилитация больных с ожогами различной степени»
Сестринское дело в хирургии:
«Ожоги.Консервативные методы лечения ожогов»
Оснащение:
Материальное: уксусная, стеариновая, пальметиновая кислоты
Техническое: компьютер с мультимедийным проектором.
Методическое:
-презентация по теме «Способы получения карбоновых кислот»;
-презентация « Уксусная и муравьиная кислота», « Щавелевая кислота», « Салициловая кислота», «Пальметиновая и стеариновая кислота»
-задания в тестовой форме.
Рекомендации к поведению студентов
Рекомендуется педагогика сотрудничества, партнерские взаимоотношения преподавателя и студентов (учитывая индивидуальные особенности), взаимоотношения студентов между собой должны носить деликатный характер.
Для повышения мотивации в учебе необходимо создание комфортных условий в учебном коллективе: не опаздывать на занятия, выполнять требования преподавателя, активно принимать участие в беседе, стремиться к качественному выполнению самостоятельной аудиторной работы, которая подвергается анализу и коррекции со стороны преподавателя.

Основные этапы
Содержание этапов занятия
Методы и приемы обучения
Средства обучения
Время
1.
Организационный момент
- проверка присутствующих и готовность учащихся к занятию;
2 мин
2.
Актуализация и коррекция опорных знаний
Проверка качества усвоения материала, изученного на предыдущем уроке
Фронтальный опрос
10
мин
3.
Мотивация учебной деятельности
Актуализация знаний о карбоксильных производных органических веществ
Изложение с элементами беседы
Слайд презентации №1
10 мин
4.
Изложение нового материала
Изложение основных понятий и терминов, объяснение способов получения карбоновых кислот. Знакомство с отдельными представителями карбоновых кислот, их солями
Лекция с элементами беседы, презентации студентов, решение практических задач.
Мультимедийная презентация, практические задачи
45 мин
5.
Проверка эффективности усвоения материала
Тестирование
(2 варианта по 15 вопросов)
Самостоятельная работа
Тестовые задания
15 мин
6.
Самопроверка результатов тестирования, обсуждение вопросов, вызвавших затруднение
Проверка результатов тестирования
Самопроверка результатов тестирования
8 мин
7.
Решение кроссворда
Решение кроссворда
Самостоятельная работа
Задание с кроссвордом
5 мин
8.
Подведение итогов занятия и оценка знаний студентов
Обсуждение, повторение и закрепление нового материала.
Итоговый, дифференцированный опрос
6 мин
9.
Домашнее задание
Объяснение ключевых моментов домашнего задания
1 мин
В поликлинику обратился пациент с жалобами на ожог руки. Но обратил внимание на страный ожог. Сильнейшая боль не прекращалась, пораженный участок сначала побелел, как бы покрываясь инеем, потом стал похожим на воск, вокруг него появилась красная кайма. Что должна делать медсестра?
(Слайд презентации№ 3)
Сестринский процесс предполагает более тесное сотрудничество медицинской сестры и пациента, поэтому уже при первом осмотре важно понимать с каким ожогом мы имеем дело.
По источнику поражающего действия ожоги делятся на термические, электрические и химические. Химические ожоги возникают в результате воздействия на кожу едких жидкостей, щелочей, окислителей, концентрированных неорганических и органических кислот, вызывая различные по глубине повреждения. Химические ожоги имеют значительный удельный вес среди всех травматических повреждений. Частота ожоговой травмы здесь составляет до 12-2О% к числу всех прочих видов травм.
В химической промышленности ожоги чаще вызываются кислотами (43%).
Как вы думаете, чем химические ожоги отличаются от термических,
электрических и лучевых ожогов?
Химические ожоги в отличие от других ожогов возникают не в результате воздействия внешней энергии, а в результате физико-химических изменений, происходящих в области травмы. Химические вещества продолжают разрушать ткани до тех пор, пока не произойдет полная нейтрализация вредных веществ. Важно знать, каким веществом вызван ожог.
Что нужно делать при химическом ожоге кислотой?
Необходимо промыть пораженные участки тела проточной водой или в воде в большом резервуаре. Ожоги следует промывать длительно примерно 30-60 минут. Раны необходимо промывать до уменьшения чувства боли и жжения.
После обильного промывания проточной водой рекомендуется обработка мыльной водой и 2% раствором питьевой соды.
Таким образом, первая помощь при химических ожогах заключается в удалении агрессивных химических веществ, наложении асептической повязки и введении при необходимости обезболивающих средств.
Следует помнить, что вдыхание, например уксусной кислоты может оказывать общее токсическое действие.
Что делать в этом случае?
При токсическом воздействии путем вдыхания, пострадавшего, прежде всего, следует вывести на свежий воздух, ослабить одежду, при необходимости сделать искусственное дыхание, обеспечить тепло и покой.
Какие же существуют правила техники безопасности при работе с кислотами, в том числе органическими?
Прежде всего, важно отметить, что основным методом борьбы с химическими ожогами должна быть профилактика этих травм. Что достигается неукоснительным соблюдением ряда простых, но эффективных правил, таких как: аккуратно маркировать емкости с едкими веществами; не оставлять их открытыми на краю стола; хранить едкие химические вещества в безопасных местах, желательно вне дома, покупать их в количестве необходимом для однократного применения; использовать перчатки и спецодежду при работе с агрессивными веществами и т.д.
Летальность: Среди пострадавших от химических ожогов летальность
составляет 2,6%. Причиной смерти чаще является шок и сепсис при обширных поражениях.
Мы говорили о том, что рану необходимо обработать 2% раствором питьевой
соды.
Как приготовить такой раствор?
Задача
Приготовить 200г. 2% раствора NaHCO3
Решение: 100г. воды-------------2г NaHCO3
200г. воды---------------------Хг NaHCO3
Х=4г.
Вопросы фронтального опроса (ответы см. приложение №1)
1.Дайте определение карбоновым кислотам.
2. Охарактеризуйте строение карбоксильной группы (с записью на доске).
3.Приведите классификацию карбоновых кислот: а) по основности, б) по строению углеводородного радикала.
4.Запишите на доске общую формулу насыщенных карбоновых кислот
5.Каковы основные физические свойства карбоновых кислот
6. Каковы общие химические свойства кислот?
7.Напишите реакцию муравьиной кислоты с магнием
8.Напишите реакцию уксусной кислоты с оксидом кальция
9.Напишите реакцию этановой кислоты c гидроксидом натрия
10.Напишите реакцию пропановой кислоты с гидрокарбонатом натрия
11.Напишите реакцию уксусной кислоты с метанолом
БЛИЦ ОПРОС ( слайд презентации№4 )
12.Какую кислоту содержат кисломолочные продукты? (молочную кислоту)
13.Об образовании какой кислоты свидетельствует прогорклый вкус и специфический запах масла? ( масляная кислота)
14. 400 грамм этой кислоты образуется в организме человека? Она может содержаться в моче, коже, поте. Что это за кислота? (уксусная кислота)
15.Почему болят икры ног после быстрого бега? ( молочная кислота)
План лекции:
1.Способы получения карбоновых кислот в промышленности;
2.Лабораторные способы получения карбоновых кислот;
3.Способы получения муравьиной кислоты;
4.Получение уксусной кислоты как основного источника синтеза многих органических соединений;
5.Получение ароматических кислот;
6.Практические задачи;
7.Основные представители одноосновных карбоновых кислот: муравьиная, уксусная, щавелевая, салициловая, стеариновая и пальметиновая:
8.Соли карбоновых кислот.
1. Способы получения карбоновых кислот в промышленности
Способы получения карбоновых кислот разнообразны. Первоисточником получения карбоновых кислот является природный газ и нефть. Это обуславливает ведущую роль в экономике нашей страны нефтехимической и газовой промышленности.
Завод по производству уксусной кислоты
(слайд презентации№5)
В промышленности одноосновные карбоновые кислоты получают окислением первичных спиртов и альдегидов.
(слайд презентации№6)
Промышленный способ получения карбоновых кислот
Окисление первичных спиртов и альдегидов (кислородом на катализаторе: KMnO4; K2Cr2O7)
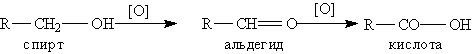
2 Лабораторные способы получения карбоновых кислот
Лабораторные методы получения отличаются от промышленных массой полученного продукта. Сырьем для производства карбоновых кислот служат не природные материалы, а продукты синтеза.
(слайд презентации№7)
Некоторые кислоты имеют специфические способы получения
3. Способы получения муравьиной кислоты
( слайд презентации№8)
Нагревание оксида углерода (II) c гидроксидом натрия
CO + NaOH -- H-COONa --H2SO4 H-COOH
формиат натрия
В промышленности муравьиную кислоту получают оксида углерода (II) и гидроксида натрия при нагревании и давлении. На образовавшийся формиат натрия действуют серной кислотой и выделяют в свободном виде муравьиную кислоту.
Разработан экономически более выгодный способ получения муравьиной кислоты с помощью каталитического окисления метана.
( слайд презентации№9)
Каталитическое окисление метана
2CH4 + 3O2 -- 2H-COOH + 2H2O
4. Получение уксусной кислоты как основного источника синтеза многих органических соединений.
( слайд презентации№10)
Как мы уже говорили безводная уксусная кислота- кристаллическое вещество. Такая кислота называется «ледяной».
Уксусная кислота образуется при брожении с доступом кислорода спиртосодержащих жидкостей( виноградного вина). Под действием фермента происходит окисление спиртов:
![]()
( слайд презентации№11)
Впервые в мире кристаллы уксусной кислоты получил в 1793 г. академик Петербургской академии наук Товий Егорович Ловиц. Он назвал их «ледяным уксусом», или «ледяной кислотой», и описал запах и вкус этих кристаллов так: «Запах расплавленного ледяного уксуса резкий, невыносимый для носа. Вкус очень кислый. Одна капля этого уксуса на языке вызывает боль, ощутимую в течение двадцати часов…» таким образом химики исследовали вещества.
В настоящее время не является промышленным способом получения.
Большое значение имеет промышленный способ получения уксусной кислоты, основанный на окислении н-бутана кислородом при нагревании и в присутствии катализатора ацетата кобальта(II):
( слайд презентации№12)
2CH3-CH2-CH2-CH3 + 5O2 --t 4CH3COOH + 2H2O
н-бутан
Экономически выгодной для получения уксусной кислоты является реакция между метанолом и оксидом углерода (II) и метанола при нагревании, небольшом давлении, в присутствии катализатора йодида кобальта:
( слайд презентации№13)
CH3OH + CO CH3COOH
метанол
5.Получение ароматических кислот
Бензойную кислоту можно рассматривать как производное бензола, где один атом водорода заменен на карбоксильную группу? Ее получают окислением толуола.
5 ![]() + 6KMnO4 + 9H2SO4 -- 5
+ 6KMnO4 + 9H2SO4 -- 5
![]() + K2SO4 + 6MnSO4 +
14H2O
+ K2SO4 + 6MnSO4 +
14H2O
толуол бензойная кислота
6. Практические задачи
Задача №1(устно) ( слайд презентации№14)
Для лечения стоматита используют 0,5%-ный раствор никотиновой кислоты. В одной ампуле аптечного препарата содержится 1мл 1% раствора никотиновой кислоты. Рассчитайте во сколько раз нужно разбавить содержимое ампулы.
Ответ: в 2 раза
Задача №2( слайд презентации№15)
Одним из альтернативных методов снижения температуры является обтирание уксусной кислотой. Рассчитайте сколько необходимо взять уксусной кислоты для получения 200мл 3% раствора. Обычная уксусная кислота имеет концентрацию 70%.
Решение:
100г.--------------70г.
Хг.----------------3г.
Х=100х3/70=4,3г (уксусной кислоты необходимо для приготовления 100г. раствора)
Значит, для приготовления 200г. Раствора нужно взять 4,3х2=8,6г. уксусной кислоты.
Ответ:8,6г
Задача№3( слайд презентации№16)
Уксусная кислота широко используется в различных клинических исследованиях. Для определения сахара в моче проводят реакцию с ацетатом свинца ( проба Рубнера). К 5 мл неразбавленной крови прибавляют 20мл 5% -го раствора основного ацетата свинца и в течение одной минуты взбалтывают. Кровь, содержащая глюкозу, сохраняется красную окраску, а кровь, не содержащая глюкозу, становится коричневой. Напишите уравнение получения ацетата свинца.
7.Основные представители одноосновных карбоновых кислот: муравьиная, уксусная, щавелевая, салициловая, стеариновая и пальметинова.
Сначала поговорим об отдельных представителях одноосновных карбоновых кислот, т. е. содержащих одну карбоксильную групп.
Среди них муравьиная и уксусная кислота.
ПРЕЗЕНТАЦИЯ №1 «Муравьиная и уксусная кислота»
1.Уксусная и Муравьиная кислоты. (слайд1)
Уксусная (этановая кислота) - органическое вещество .
Слабая, предельная одноосновная карбоновая кислота. Производные уксусной кислоты носят название «ацетаты»
(слайд 2)
ФОРМУЛА уксусной кислоты :
CH3COOH.
Физические свойствава ( слайд 3)
Гигроскопична.
Неограниченно растворима в воде.
В уксусной кислоте хорошо растворимы неорганические соединения и газы, такие как HF, HCl, HBr, HI и др.
Абсолютная уксусная кислота называется ледяной,
ибо при замерзании образует льдовидную массу.
Уксусная кислота - бесцветная жидкость с характерным резким запахом и кислым вкусом
Химические свойства (слайд 4)
Обладает свойствами, характерными для предельных одноосновных кислот
(слайд 6)
В природе уксусная кислота распространена в свободном виде или в виде солей и сложных эфиров в растениях (в зеленых листьях), в выделениях животных (моче, желчи), образуется при гниении и брожении (в кислом молоке, сыре, вине). Брожение происходит под влиянием специфических бактерий "уксусного грибка".
Уксусную кислоту применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетилцеллюлозы, ацетона). Она используется в книгопечатании.
Поскольку пары уксусной кислоты обладают резким раздражающим запахом, возможно её применение в медицинских целях в качестве замены нашатырного спирта для выведения больного из обморочного состояния.
Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей. Опасными считаются растворы, в которых концентрация кислоты превышает 30 %. Концентрированная уксусная кислота способна вызывать химические ожоги. Токсикологические свойства уксусной кислоты не зависят от способа, которым она была получена. Смертельная доза составляет примерно 20 мл.
Муравьиная кислота
(метановая кислота) - первый представитель в ряду насыщенных одноосновных карбоновых кислот.
(слайд7)
Формула муравьиной кислоты :
HCOOH
(слайд 8)
Помимо муравьев, муравьиная кислота также содержится в хвое, фруктах и выделяется многими видами пчел вместе с жалом. В наши дни объёмы потребления муравьиной кислоты очень велики, её не добывают из муравьёв, а производят путём органического синтеза. Муравьиная кислота получила широкое применение в народной и традиционной медицине в виде спиртового раствора, который носит название муравьиный спирт. Также используются различные соли и эфиры, полученные из муравьиной кислоты искусственным путем. Такие соли носят название "форматиты" и имеют менее выраженные лечебные свойства.
(слайд 9)
Ещё древние люди смогли обнаружить необыкновенные болеутоляющие свойства этой смеси, а потому широкое применение получила муравьиная кислота в медицине.
Применение
Муравьиная кислота в медицине выступает как антисептическое, болеутоляющее, очищающее средство, но можно использовать его как противовоспалительное и бактерицидное средство. Изготавливается чаще в виде мази, которая носит лечебный характер и отличается особым составом. Муравьиная кислота в медицине также приобрела широкое применение в виде растворов или соединений при различных серьезных болезнях. Лечит такой раствор поражение суставов (это может быть артрит, ревматизм, артроз, остеохондроз, радикулит, а также остеоартроз, сколиоз и др.); при травмах (синяках, переломах, ушибах и пр.); при варикозном расширении вен; при грибковых заболеваниях; при вирусных заболеваниях, а также применение муравьиной кислоты в виде косметических средств, которые применяются для очищения кожи.
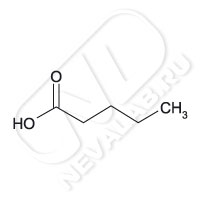
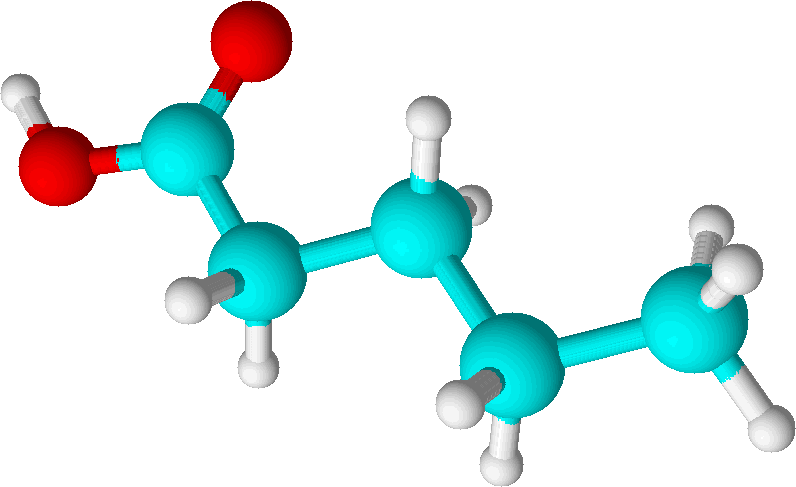
К классу предельных одноосновных кислот относится пентановая или ее травиальное название валериановая кислота.
ПРЕЗЕНТАЦИЯ №2 «Валериановая кислота»(Слайд 1)
Валериа́новая кислота́ (пента́новая кислота́) С4Н9COOH - одноосновная предельная карбоновая кислота
структурная молекулярная
 (слайд
3)
(слайд
3)
Впервые была описана Шеврёлем (в его классических "Recherches sur les corps gras" в 1817 году), который получил ее из ворвани дельфинов и тюленей; позже та же кислота была найдена в корне валерианы аптечной, откуда она и получила свое название. Как в различных растениях, так и животных, В. кислота встречается и в свободном состоянии, и в виде сложных эфиров. Природная кислота представляет смесь по крайней мере двух изомеров, из которых один вращает плоскость поляризации. (слайд 4)
н-пентановая кислота СН3-СН2-СН2-СН2-COOH
3-метилбутановая кислота СН3-CH(СН3)-СН2-СООН
2-метилбутановая кислота СН3-СН2-CH(СН3)-СООН
2,2-диметилпропановая кислота СН3-С(СН3)2-СООН(слайд 5)
Химический состав валерианы полностью не изучен. Основным активным веществом корневищ и корней валерианы является эфирное валериановое масло . Эфирное масло содержится в количестве 0,5-1 % и более. Валериановая кислота - Это бесцветная, буреющая на воздухе жидкость. В свежем состоянии обладает приятным запахом, но при продолжительном хранении, вследствие выделения свободных кислот, приобретает более резкий и неприятный запах. (слайд 6)

(слайд 7)
Искусственно Валериановая кислота получается окислением амильного алкогольного брожения (слайд 8)
Среди изомеров валериановой кислоты наибольшее значение имеет 3-метилбутановая кислота (изовалериановая кислота) СН3-CH(СН3)-СН2-СООН. Она применяется для синтеза лекарственных веществ: валидола, бромурала и др., В пищевой промышленности используют изоамиловый эфир изовалериановой кислоты (яблочная эссенция), также используется этиловый и пентиловый эфир валерьяновой кислоты. (слайд 9)
Во врачебной практике валериана и ее препараты применяются в качестве успокаивающего средства при нервном возбуждении, бессоннице и астме.
Эффективное действие валерианы лекарственной, особенно в комбинации с бромидами, весьма положительно сказывается при лечении спазматических состояний внутренних органов, имеющих гладкую мускулатуру, в частности, кишечника. Кроме того, в последние годы И. И. Флоринским было установлено благоприятное целебное действие валерианы при лечении заболеваний щитовидной железы. При применении валерианы при лечении щитовидной железы у больных устранялось тягостное ощущение сердцебиения и повышенная нервная возбудимость. Применение валерианы показано также при спазме коронарных сосудов с болевым синдромом.(слайд 10)

(слайд 11)
Молекулы двухосновных кислот содержат в своем составе две карбоксильные группы. Простейшая двухосновная кислота-щавелевая.
ПРЕЗЕНТАЦИЯ №3 «Щавелевая кислота» (слайд 1)
(слайд 2)
Впервые щавелевая кислота синтезирована в 1824 году немецким химиком Фридрихом Вёлером из дициана. Щавелевая кислота (или оксалат-ион C2O42−) является восстановителем (обесцвечивает раствор KМnO4).
(слайд 3)
Щавелевая кислота- представляет собой бесцветные моноклинные гигроскопичные кристаллы, легко растворимые в воде, ограниченно - в этиловом спирте и диэтиловом эфире, нерастворимые в хлороформе, петролейном эфире и бензоле.Щавелевая кислота это двухосновная предельная карбоновая кислота. Принадлежит к сильным органическим кислотам. Обладает всеми химическими свойствами, характерными для карбоновых кислот. Соли и эфиры щавелевой кислоты называются оксалатами. Щавелевая кислота образует кислые и средние эфиры, амиды, хлорангидрид.В природе содержится в щавеле, ревене и некоторых других растениях в свободном виде и в виде оксалатов калия и кальция.
(слайд 4)
Формула щавелевой кислоты
НСООН-НСООН
(слайд 5)
Применение щавелевой кислоты
-в химической промышленности (органический синтез, при производстве пластмасс, чернил, в синтезе красителей, как компонент пиротехнических составов);
-
в микроскопии (в качестве отбеливателя срезов);
-
в текстильной и кожевенной промышленности (протрава в ситцепечатании и при крашении шерсти и шелка, при дублении кожи);
-
при производстве синтетических моющих средств (в качестве отбеливающего и дезинфицирующего средства, средства для чистки и удаления мочевого камня, солей жесткости и ржавчины);
-
в системах очистки воды (химический способ очистки и снижения жесткости воды, очистка теплоносителей на АЭС);
(слайд 6)
В организме щавелевая кислота является
промежуточным продуктом обмена веществ, выделяется с мочой в виде
солей кальция.
При нарушениях минерального обмена соли щавелевой кислоты
(оксалаты) участвуют в образовании камней в почках и мочевом
пузыре.
(слайд 7)
В организме человека, а именно в пищеварительном канале, системе кровообращения, в семенных канатиках и органах выделения, постоянно совершаются червеобразные движения. Они по своей природе волнообразны и состоят из серии последовательных сокращений и расслаблений нервов и мышц. Эффективность и своевременность этих процессов во многом зависит от тонуса и физического состояния нервов и мышц. Важным элементом стимулирования этого процесса является щавелевая кислота.
Образование солей
При взаимодействии с основаниями (реакция нейтрализации), с активными металлами водород карбоксильной группы кислоты замещается на металл и образуются соли карбоновых кислот. Например:
( слайд презентации№17)
СH3-CОOH + NaOH = CH3-CОONa + H2
уксусная кислота ацетат натрия
( слайд презентации№18)
СH3-COОH + NH4OH = CH3-CОONH4 + H2O
уксуснокислый аммоний
Химические свойства солей карбоновых кислот
Соли карбоновых кислот и щелочных металлов как соли, образованные слабыми кислотами, сильно подвергаются гидролизу и в водных растворах имеют щелочную реакцию:
( слайд презентации№19)
CH3-CОONa + H2O = CH3-CОOH + NaOH
Более сильные минеральные кислоты вытесняют карбоновые кислоты из их солей:( слайд презентации№20)
CH3-CОONa + HCl= CH3-CОOH + NaCl
Для закрепления знаний студент с алгоритмом действий при оказании неотложной помощи при приступе бронхиальной астмы (прил.2).
Инструкция для студентов к выполнению заданий в тестовой форме
Вы получили задания в тестовой форме. Каждое задание содержит 4 варианта ответа. Выберите 1 правильный ответ, отметьте в соответствующем квадратике. Будьте внимательны при чтении формулировки задания и выборе ответа.
После выполнения заданий осуществите взаимопроверку, используя эталоны ответа (на слайде презентации).
Обратите внимание на те вопросы, которые вызвали затруднение и на которые вы дали неверный ответ - при подготовке к практическому занятию уделите им больше времени.
Задания в тестовой форме
1. Укажите формулу кислоты, являющейся альдегидокислотой
-
С17Н31СООН
-
НСООН
-
СНзСООН
-
C15H31COOH
2.Уксусная кислота не реагирует со следующим металом
-
Мg
-
Сu
-
Са
-
Zn
3.Уксусная кислота не взаимодействует с
-
NaHC03
-
Na2Si03
-
NaOH
-
С02
4. Напишите уравнение реакции оксида магния с уксусной кислотой. Ответ дайте в виде суммы коэффициентов в уравнении реакции
-
5
-
6
-
1
-
2
5. В ходе реакции этерификации карбоновые кислоты реагируют
-
с металлами
-
с основаниями
-
со спиртами
-
с кислотами
6. Олеиновая кислота не взаимодействует с раствором
-
ацетата натрия
-
гидроксида натрия
-
перманганата калия
-
брома
7. Определите вещество X в следующей схеме превращений:
метанол →X→ уксусная кислота
-
этилформиат
-
этаналь
-
метаналь
-
метилацетат
8.Формиат калия не получится при действии на муравьиную кислоту
-
гидроксида калия
-
карбоната калия
-
сульфата калия
-
калия
9.Уксусная кислота не реагирует
-
пропанолом
-
магнием
-
хлоридом натрия
-
карбонатом калия
10. В порядке усиления кислотных свойств расположены кислоты
-
стеариновая - уксусная - трихлоруксусная
-
уксусная - стеариновая - трихлоруксусная
-
трихлоруксусная - уксусная - стеариновая
-
стеариновая - трихлоруксусная - уксусная
11.Продуктом окисления пропаналя является
-
пропанол
-
пропановая кислота
-
пропан
-
пропан
12.Соль уксусной кислоты называется
-
ацетат
-
формиат
-
бутират
-
валерат
13.Применяется в медицине как «муравьиный спирт»:
-
метанол
-
эталовый спирт
-
муравьиная кислота
-
уксусная кислота
14.Применяется для консервирования пищевых продуктов и в качестве приправы:
а) С2Н5СООН
б) С3Н7СООH
в) НСООН
г) СН3СООН
15. Кисотой является:
а) С3Н7ОН
б) СН3СОСН3
в) С2Н5СООН
г) С6Н5СНО.

Преподаватель предлагает студентам кратко сформулировать, что нового они узнали на данном занятии; были ли достигнуты, по их мнению, цели занятия; что больше всего запомнилось и что, наоборот, показалось неинтересным; с какими трудностями они столкнулись в ходе этого занятия; преподаватель стимулирует студентов к анализу причин неудач и затруднений.

Подводя итоги занятия, преподаватель характеризует и оценивает работу группы в целом, выставляет отметки студентам, принимавшим активное участие в беседе по ходу лекции и в выполнении заданий для закрепления.
Список рекомендуемой литературы для преподавателя
1.О.С. Габриелян: «Химия. Методическое пособие 10 класс» Москва
.Дрофа.2010г
2.Н.Н. Гара: «.Уроки химии 10» Москва. Просвещение. 2009г
Список рекомендуемой литературы для студентов
1. Чернобельская Г.М. Химия § 20.1-20.3

ПРИЛОЖЕНИЕ 1
1.Карбоновые кислоты-органические вещества, молекулы которых содержат
одну или несколько карбоксильных групп, соединенных с углеводородным
радикалом.
2.Карбоксильная группа сочетает в себе две функциональные группы -
карбонил и гидроксил, взаимно влияющие друг на друга:
В этой сложной функциональной группе соединены друг с другом две простые
кислородсодержащие группы: карбонильная >С=О и гидроксильная (или окси-
группа) -ОН; отсюда и происходит название - карбоксильная группа.
В группе -С=О атом углерода несет частичный положительный заряд и
притягивает к себе электронную пару атома кислорода в группе-ОН.При этом
электронная плотность на атоме кислорода уменьшается, связь ослабляется.
В свою очередь, группа -ОН «гасит» положительный заряд на группе С=О.
3. Карбоновые кислоты классифицируют по двум структурным признакам.
По числу карбоксильных групп кислоты подразделяются на:
-одноосновные ( муравьиная, уксусная кислоты)
-многоосновные ( щавелевая, лимонная)
По характеру углеводородного радикала различают кислоты:
•предельные (муравьиная, уксусная кислоты)
•непредельные (акриловая, олеиновая)
•ароматические( бензойная,салициловая)
•
4. СnH2n+1COOH или СnH2nO2
5.Низшие карбоновые кислоты - жидкости с острым запахом, хорошо растворимые в воде. С
повышением относительной молекулярной массы растворимость кислот в воде и их плотность
уменьшаются, а температура кипения повышается. Высшие кислоты, начиная с нонановой твердые вещества, без запаха, нерастворимые в воде.
6.Наличие карбоксильной группы предполагает ряд общих свойств карбоновых
кислот. Это прежде всего кислотность. Карбоновые кислоты, как правило,
слабые кислоты. Даже самые сильные из них (винная, щавелевая) сравнимы
лишь со слабой неорганической сернистой кислотой.
Для карбоновых кислот типичны обычные реакции неорганических кислот, например, в реакции со
щелочами, карбонатами, оксидами образуются соли. Карбоновые кислоты обладают также особыми
свойствами.
7.2HCOOH + Mg=(HCOO)2Mg + H2
8.СH3COOH +СaO=(CH3COO)2Ca + H2O
9.СH3-COOH + NaOH=СH3-COONa + H2O
10.СH3CH2COOH + NaHCO3 = CH3CH2COONa + H2O + CO2
11.CH3--СОOH+ CH3ОН=CH3-СО-OCH3+H2O
Критерии оценки знаний.
Оценка «5» ставится, если студент:
-
Обстоятельно, с достаточной полнотой излагает соответствующую тему.
-
Дает правильные формулировки, точные определения и понятия терминов, обнаруживает полное понимание материала и может обосновать свой ответ, привести необходимые примеры «не только из учебников, но и подобранные самостоятельно»,правильно отвечает на дополнительные вопросы преподавателя, имеющие целью выяснить степень понимания учащихся данного материала.
-
Уверенно и правильно проводит разбор ошибок, знает положительные и отрицательные стороны выполненных практических работ.
-
Свободно владеет речью, медицинской терминологией.
Оценка «4» ставится, если студент:
-
Дает ответ, удовлетворяющий тем же требованиям, что и отметки «5».
-
Допускает единичные ошибки, которые исправляет после замечания преподавателя.
Оценка «3» ставится, если студент:
Знает и понимает основные положения данной темы, но допускает неточности в формулировке правил.
Допускает частичные ошибки.
Излагает материал недостаточно связанно и последовательно.
Оценка «2» ставится, если студент:
-
Обнаруживает незнание общей части соответствующего раздела темы, допускает ошибки в формулировке правил, искажающие их смысл.
Беспорядочно и неуверенно излагает материал, сопровождая изложение частыми остановками и перерывами
ЛИТЕРАТУРА
Для студентов
Габриелян О.С. Химия: учеб. для студ. проф. учеб. заведений / О.С. Габриелян, И.Г. Остроумов. - М., 2005.
Габриелян О.С. Химия в тестах, задачах, упражнениях: учеб. пособие для студ. сред. проф. учебных заведений / О.С. Габриелян, Г.Г. Лысова - М., 2006.
Габриелян О.С. Практикум по общей, неорганической и органической химии: учеб. пособие для студ. сред. проф. учеб. заведений / Габриелян О.С., Остроумов И.Г., Дорофеева Н.М. - М., 2007.
Габриелян О.С. Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. учреждений / О.С. Габриелян, Ф.Н. Маскаев, С.Ю. Пономарев, В.И. Теренин. - М., 2005.
Габриелян О.С. Химия. 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений / О.С. Габриелян, Г.Г.Лысова. - М., 2006.
Габриелян О.С. Химия: орган. химия: учеб. для 10 кл. общеобразоват. учреждений с углубл. изучением химии / О.С. Габриелян, И.Г. Остроумов, А.А. Карцова - М., 2007.
Габриелян О.С. Общая химия: учеб. для 11 кл. общеобразоват. учреждений с углубл. изучением химии / О.С. Габриелян, И.Г. Остроумов, С.Н. Соловьев, Ф.Н. Маскаев - М., 2007.
Г. М.Чернобельская ,И. Н. Чертков. Химия: Учебник для студентов средних медицинских учебных заведений - М.: Дрофа 2007.
Репетитор по химии под редакцией А. С. Егорова. - Ростов н/Д. : Феникс, 2008
Для преподавателей
Габриелян О.С. Химия для преподавателя: учебно-методическое пособие / О.С. Габриелян, Г.Г. Лысова - М., 2006.
Габриелян О.С. Настольная книга учителя химии: 10 класс / О.С. Габриелян, И.Г. Остроумов - М., 2006.
Габриелян О.С. Настольная книга учителя химии: 11 класс: в 2 ч. / О.С. Габриелян, Г.Г. Лысова, А.Г. Введенская - М., 2007.
Чернобельская Г.М. Методика обучения химии в средней школе. - М., 2007.
</


