- Учителю
- ЗАДАЧИ С РЕШЕНИЯМИ ПО НЕОРГАНИЧЕСКОЙ ХИМИИ
ЗАДАЧИ С РЕШЕНИЯМИ ПО НЕОРГАНИЧЕСКОЙ ХИМИИ
1.Составить уравнение окислительно-восстановительной реакции методом электронного баланса.
ОТВЕТ (пример. Описан подробно алгоритм действий)
Ag + HNO3 → AgNO3 + NO + H2O
Шаг 1. Подсчитаем степени окисления для каждого элемента, входящего в химическую реакцию.
Ag. Серебро изначально нейтрально, то есть имеет степень окисления ноль.
Для HNO3 определим степень окисления, как сумму степеней
окисления каждого из элементов.
Степень окисления водорода +1, кислорода -2, следовательно, степень окисления азота равна:
0 - (+1) - (-2)*3 = +5
(в сумме, опять же, получим ноль, как и должно быть)
Теперь перейдем ко второй части уравнения.
Для AgNO3 степень окисления серебра +1 кислорода -2,
следовательно степень окисления азота равна:
0 - (+1) - (-2)*3 = +5
Для NO степень окисления кислорода -2, следовательно азота +2
Для H2O степень окисления водорода +1, кислорода -2
Шаг 2. Запишем уравнение в новом виде, с указанием степени
окисления каждого из элементов, участвующих в химической реакции.
Ag0 +
H+1N+5O-23 →
Ag+1N+5O-23 +
N+2O-2 +
H+12O-2
Из полученного уравнения с указанными степенями окисления, мы видим несбалансированность по сумме положительных и отрицательных степеней окисления отдельных элементов.
Шаг 3. Запишем их отдельно в виде электронного баланса - какой
элемент и сколько теряет или приобретает электронов:
(Необходимо принять во внимание, что элементы, степень окисления
которых не изменилась - в данном расчете не участвуют)
Ag0 - 1e = Ag+1
N+5 +3e = N+2
Серебро теряет один электрон, азот приобретает три. Таким образом, мы видим, что для балансировки нужно применить коэффициент 3 для серебра и 1 для азота. Тогда число теряемых и приобретаемых электронов сравняется.
Шаг 4. Теперь на основании полученного коэффициента "3" для серебра, начинаем балансировать все уравнение с учетом количества атомов, участвующих в химической реакции.
-
В первоначальном уравнении перед Ag ставим тройку, что потребует такого же коэффициента перед AgNO3
-
Теперь у нас возник дисбаланс по количеству атомов азота. В правой части их четыре, в левой - один. Поэтому ставим перед HNO3 коэффициент 4
-
Теперь остается уравнять 4 атома водорода слева и два - справа. Решаем это путем применения коэффииента 2 перед H2O
Ответ:
3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O
2.Задача на нахождение массовой доли растворенного вещества.
ОТВЕТ (пример. Подробно описан алгоритм.)
В 100 граммах воды (H2O) растворили 25 грамм хлорида алюминия (AlCl3). Определите массовую долю вещества в полученном растворе.
Задачу решаем, используя формулу нахождения массовой доли вещества в растворе:
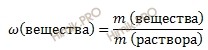
Массовая доля вещества в растворе - это отношение массы растворенного вещества к массе раствора. Выражается в долях единицы или в %. Следует отметить, что массовая доля вещества растворенного в растворе, выраженная в %, называется процентной концентрацией раствора. (ОПРЕДЕЛЕНИЕ НАДО ЗНАТЬ!!!)
Найдем массу раствора, используя формулу:
![]()
Соответственно:
m (раствора AlCl3) = 100 г + 25 г = 125 (г).
Используя основную формулу нахождения массовой доли вещества в растворе, вычислим массовую долю вещества хлорида алюминия (AlCl3) в растворе:
w (AlCl3) = 25 г/ 125 г = 0,2 или 20 %.
3.Осуществить схему превращений.
ОТВЕТ (пример)
Дана схема превращений:
t°
Cu → Cu Cl2→ Cu(OH)2 → Х
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращенное ионное уравнение реакции.
1) Cu + Cl2 = CuCl2
2) CuCl2 + 2NaOH = Cu(OH)2+ 2NaNO3
t°
3) Cu(OH)2 →CuO + H2O
Составим сокращенное ионное уравнение второго превращения:
4) 2OH- + Cu2+ = Cu(OH)2
4.Составить уравнение реакций между электролитами в сокращенной ионной, ионной и молекулярной формах.
ОТВЕТ (пример. Дан подробный алгоритм.)
Большое количество химических реакций проходит в растворах. В таких реакциях обмена зачастую участвуют соли, кислоты, основания. Но немало солей, кислот и оснований в растворах диссоциируют на ионы, следовательно реакции в растворах происходят не между молекулами, а между ионами. Такие реакции называют ионными.
В случае если химические реакции в водных растворах электролитов происходят с участием ионов, то и химические уравнения, отражающие ионные реакции, следует записывать не только в молекулярной, но и в ионной форме. Такие уравнения называют ионными уравнениями.
Важно заметить, что для составления ионных уравнений сначала записывают молекулярное уравнение реакции, к примеру˸
NaOH + HCl = NaCl + H2O.
Во второй строке записываем ионных уравнения. Для этого формулы сильных электролитов нужно записать в ионной форме. Для определения силы электролитов можно пользоваться таблицей растворимости, помня, что в сильных электролитов относятся растворимые соединения. Их формулы записываем в ионной форме. Вода является неэлектролитов, в связи с этим ее записываем в молекулярной форме˸
Na + + OH-+ H + + Cl-= Na + + Cl-+ H2O.
Такое уравнение принято называть полным ионных уравнением.
В левой и правой частях ионного уравнения одинаковы ионы Na + (натрий-плюс) и Cl-(хлор-минус). Эти ионы можно удалить из левой и правой частей ионного уравнения, поскольку они не участвуют в реакции. Сокращаем в левой и правой частях уравнения катионы натрия и анионы хлора - и получаем сокращенное ионные уравнения. В нем записаны только те частицы, которые реально взаимодействуют в растворе˸
OH-+ H + = H2O.
Реакции обмена в растворах электролитов проходить до конца, в случае если один из продуктов реакции является неэлектролитом. В этом случае происходит сочетание ионов, образующих неэлектролитов, и они выходят из сферы реакции. Это возможно, в случае если в результате реакции˸
1) образуется нерастворимая вещество (выпадает осадок),
2) выделяется газ,
3) образуется вода или другой слабый электролит (Н2S, Н2СО3, Н2SО3)
В случае если выполняется хотя бы одно из этих условий, реакция происходит до конца и является необратимой. В случае если же эти условия не выполняются, то при смешивании растворов образуется смесь ионов и реакция является обратимой.
Для прогнозирования возможности протекания реакций ионного обмена в растворах электролитов следует использовать таблицу растворимости.
В итоге получим:
NaOH + HCl = NaCl + H2O
Na + + OH-+ H + + Cl-= Na + + Cl-+ H2O.
OH-+ H + = H2O.
5.Задача на нахождение молярной концентрации раствора.
Вычислите молярную концентрацию 20%-го раствора хлорида калия (плотность раствора= 1,13 г/мл).

6.Задача на нахождение молярной концентрации ионов в водном растворе.
ОТВЕТ (пример). Вычислите концентрацию ионов (ОН-) водного раствора, имеющего значение pH = 8,2.
Решение задачи
Из соотношения: ![]()
Находим: ![]()
pOH - показатель основности раствора, pOH, равная отрицательному
десятичному логарифму концентрации в растворе ионов OH−:
![]()
Используя, формулу, вычислите концентрацию ионов:
pOH = 14 - 8,2 = 5,8
Отсюда:
- lg [OH-] = 5,8
Вычислите концентрацию ионов:
[OH-] = 10-5,8 = 0,0000016 = 1,6 ⋅ 10-6 (моль/л).
Ответ: концентрация ионов (ОН-) водного раствора равна 1,6 ⋅ 10-6 моль/л.
7.Составить уравнение реакций между электролитами в сокращенной ионной, ионной и молекулярной формах.
ОТВЕТ (пример) . Составьте молекулярное и ионно-молекулярное уравнения взаимодействия в растворе между CuSO4 и NaOH.
Реакции в водных растворах электролитов являются реакциями между ионами. Они протекают практически необратимо в тех случаях, когда в результате их взаимодействия образуются малорастворимые, газообразные вещества или слабодиссоциирующие соединения.
Реакции ионного обмена записывают в молекулярной форме, полной ионно-молекулярной и сокращенной ионно-молекулярной формах.
В полной ионно-молекулярной форме в виде ионов записывают только сильные электролиты, все остальные - в виде молекул. В сокращенной ионно-молекулярной форме оставляют только те ионы и молекулы, которые принимают участие в реакции.
Чтобы составить ионно-молекулярное уравнение, нужно:
- составить молекулярное уравнение реакции;
- записать это уравнение с учетом электролитической дисоциации, т.е. сильные электролиты записать в виде ионов, все остальные вещества - в виде молекул. Получится полное ионно-молекулярное уравнение;
- исключить из обеих частей полного ионно-молекулярного уравнения одинаковые ионы;
- записать сокращенное ионно-молекулярное уравнение в окончательном виде.
Пример 1. Составьте молекулярное и ионно-молекулярное уравнения взаимодействия в растворе между CuSO4 и NaOH.
Решение.
Составляем уравнение реакции взаимодействия веществ в молекулярной форме:
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
По таблице растворимости солей в воде устанавливаем, что к сильным электролитам относятся растворимые в воде соли CuSO4 и Na2SO4, Cu(OH)2 - малорастворимое соединение, NaOH - сильный электролит (приложение, табл.2).
Составим полное ионно-молекулярное уравнение, записав растворимые соли и сильное основание в виде ионов, а осадок Cu(OH)2 в виде молекулы:
Cu2+ + SO42- + 2Na+ + 2OH- = Cu(OH)2 + 2Na2+ + SO42-
Исключаем из обеих частей полного ионно-молекулярного уравнения одинаковые ионы
Cu2+ + SO42- + 2Na+ + 2OH- = Cu(OH)2 + 2Na2+ + SO42-
Записываем сокращенное ионно-молекулярное уравнение:
Cu2+ + 2OH- = Cu(OH)2
8.Задача на определение pH раствора по известной его концентрации.
ОТВЕТ (пример). Вычислить рН раствора, в котором концентрация ионов ОН- =10-5 моль/л.
Решение:
Используем формулу рН + рОН = 14.
Следовательно, рН = 14 - рОН; но рОН = - Ig ОН-.
Тогда рН = 14 - (-Ig [ОН-]) = 14 + Ig10-5 = 14 - 5 = 9
9. Составить уравнение реакций гидролиза солей в сокращенной ионной, ионной и молекулярной формах.
ОТВЕТ (пример)
Составьте уравнения реакций гидролиза следующих солей в сокращенной ионной, ионной и молекулярных формах: а) NaNO2; б) K2CO3; в) NH4Cl. Укажите реакцию среды в растворах этих солей.
а) NaNO2 = NaOH и HNO2
NO2- + HOH = HNO2 + OH- гидролиз соли в сокращенной ионной
форме
NO2- + Na+ + H2O = HNO2 +Na+ + OH- гидролиз соли в ионной форме
NaNO2 + H2O = HNO2 + NaOH гидролиз соли в молекулярной форме
pH>7, реакция среды щелочная
б) К2СO3 = KOH и H2CO3
1 ступень.
CO32- + H+ + OH- = HCO3- + OH- гидролиз соли в сокращенной ионной
форме
CO32- + 2K+ + H2O = HCO3- + 2K+ + OH- гидролиз соли в ионной
форме
К2СO3 + H2O = KHCO3+ + KOH гидролиз соли в молекулярной форме
2 ступень.
HCO3- + HOH = H2CO3 + OH- гидролиз соли в сокращенной ионной
форме
HCO3- + 2K+ + H2O = H2CO3 + 2K+ + OH- гидролиз соли в ионной
форме
KHCO3 + H2O = H2CO3 + KOH гидролиз соли в молекулярной форме
pH>7, реакция среды щелочная
в) NH4Cl = NH4OH и HCl
NH4+ + H+ + OH- = NH4OH + H+ гидролиз соли в сокращенной ионной
форме
NH4+ + Cl- + H2O = NH4OH + H+ + Cl- гидролиз соли в ионной
форме
NH4Cl + H2O = NH4OH+ HCl гидролиз соли в молекулярной форме
pH<7, реакция среды кислая
10.Задача на смещение равновесия обратимой химической реакции.
ОТВЕТ (пример)
Укажите, как повлияет:
а) повышение давления;
б) повышение температуры;
в) увеличение концентрации кислорода на равновесие системы:
а)2CO (г) + O2 (г) ↔ 2CO2 (г) + Q
По принципу Ле Шателье, при увеличении давления, равновесие смещается в сторону образования веществ, занимающих меньший объём, следовательно равновесие сместится вправо, т.е. в сторону образования СО2, в сторону прямой реакции (→).
б) По принципу Ле Шателье, при повышении температуры, равновесие смещается в сторону эндотермической реакции (-Q), т.е. в сторону обратной реакции - реакции разложения СО2 (←), т.к. по закону сохранения энергии:
Q - 2CO (г) + O2 (г) ↔ 2CO2 (г) + Q
в) При увеличении концентрации кислорода равновесие системы смещается в сторону получения СО2 (→) т.к. увеличение концентрации реагентов (жидких или газообразных) смещает в сторону продуктов, т.е. в сторону прямой реакции.
11.Задача на расчет скорости химической реакции.
ОТВЕТ (пример)
Задача №1
Реакция протекает по уравнению А+В = 2С. Начальная концентрация вещества А равна 0,22 моль/л, а через 10 с - 0,215 моль/л. Вычислите среднюю скорость реакции.
Решение:
Используем формулу для расчёта
υ = ± ΔС/Δτ = ± (0,215-0,22)/(10-0) = 0,0005 моль/л ∙ с
Задача №2
Вычислите, во сколько раз увеличится скорость реакции при повышении температуры от 30 до 70 ∘ С, если температурный коэффициент скорости равен 2.
Решение:
По правилу Вант-Гоффа
υ=υ0·γ (t2-t1)/10
По условию задачи требуется определить υ/υ0:
υ/υ0=2 (70-30)/10 = 24 = 16
Задача №3
Запишите кинетическое уравнение для следующих уравнений реакций:
А) S(тв) + O2 (г) = SO2 (г)
Б) 2SO2 (г) + O2 (г) = 2SO3 (ж)
Решение:
Согласно закону действующих масс, который действует для газов и жидкостей:
υ = к1 C (O2)
υ = к2 C2(SO2)·C (O2)
Задача №4
Как изменится скорость реакции:
S (тв) + O2 (г) = SO2 (г)
при увеличении давления в системе в 4 раза?
Решение:
Запишем кинетическое уравнение для реакции до повышения давления в системе. Обозначим концентрацию кислорода
С(О2) = а, концентрация серы - твёрдого вещества не учитывается.
υ = к1 а
При повышении давления в 4 раза, объём уменьшается в 4 раза, следовательно концентрация газа кислорода увеличится в 4 раза и кинетическое уравнение примет вид:
υ' = к1 4а
Определяем, во сколько раз возрастёт скорость реакции:
υ' /υ = к1 4а / к1 а = 4
Следовательно, при повышении давления в 4 раза, скорость данной реакции увеличится в 4 раза.
Задача №5
Как изменится скорость реакции:
2SО2 (г) + O2 (г) = 2SO3 (г)
при увеличении давления в системе в 2 раза?
Решение:
Запишем кинетическое уравнение для реакции до повышения давления в системе. Обозначим концентрацию SO2
С(SО2) = а, концентрация кислорода C(O2) = b.
υ = к1 а2·b
При повышении давления в 2 раза, объём уменьшается в 2 раза, следовательно концентрация газа кислорода и SO2 увеличится в 2 раза и кинетическое уравнение примет вид:
υ' = к1 (2а)2·2b = к14а2·2b= к18а2·b
Определяем, во сколько раз возрастёт скорость реакции:
υ' /υ = к1 8а2·b / к1 а2·b =8
Следовательно, при повышении давления в 2 раза, скорость данной реакции увеличится в 8 раз
12.Задача. Вычисление объема полученного газа, если известна масса исходного вещества.
Пример. Рассчитайте объем (н.у) оксида серы (IV),который образуется при сжигании серы массой 6,4 г.
S+O2=SO2
Дано:
m=6.4 г
Найти:
V-?
Решение:
n=m/M=6.4 г/64 г/моль=0.1 моль.
V=Vm*n=22.4л/моль*0.1 моль= 2.24 л
Ответ. При сжигании 6,4 г серы образуется SO2 объемом 2,24 л.
13.Задача на разбавление растворов.
Пример. Сколько граммов раствора с массовой долей серной кислоты 96% необходимо влить в 1 л воды, чтобы получить раствор с массовой долей 10%
Для решения данной задачи используем правило креста.
Чистый растворитель (воду) можно представить как раствор с массовой долей растворенного вещества 0%
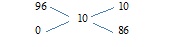
Определим m раствора с ω (H2SO4) = 96%, который надо влить в 1 л воды:
10 г H2SO4 надо влить в 86 г воды
х г - 1000 г
х = 116,28 г
m (р-ра H2SO4) = 116,28 г
14.Задача. Вычисление количества вещества (или объема) газа, необходимого для реакции с определенным количеством вещества (или объемом) другого газа.
Пример:
Сколько литров кислорода необходимо для сгорания 89,6 литров водорода?
Решение:
1.Объем газа пропорционален количеству вещества:
v = 22,4 л/моль • n,
где 22,4 - молярный объем, т.е. объем одного моля любого газа,
n - количество вещества (моль)
2. Записываем над уравнением реакции имеющиеся данные, а под
уравнением - число моль согласно уравнению (равно коэффициенту
перед веществом):
89,6 л x л
2H2 + O2 = 2H2O
2 моль 1 моль
3. Составляем пропорцию:
89,6 л - x л
2 моль - 1 моль
(или с пояснением:
для сгорания 89,6 л водорода требуется x л кислорода,
а для 2 моль - 1 моль)
4. Находим x:
x = 89,6 л • 1 моль / 2 моль = 44,8 л
Ответ: 44,8 л.
15.Задача. Вычисление массовой доли (%) химического элемента в веществе, формула которого приведена.
Пример. Рассчитайте массовые доли фосфора в РН3, Р2О5, Н3РО4
Сначала запишем формулы соединений. Затем рассчитаем вес 1 молекулы данного соединения (найти молекулярную массу). Теперь составим пропорцию: вес молекулы взять за 100%, а вес фосфора в соединении - будет - Х. отсюда находим массовую долю фосфора в соединении.
P2O5 М=31*2+16*5=142
142 - 100%
62 - Х
Отсюда находим Х=62*100/142=44%
16.Задача. Вычисление массы исходного вещества, если известно количество вещества одного из продуктов
реакции.
Пример:
Сколько граммов соляной кислоты необходимо для получения 4 моль
хлорида цинка?
Решение:
-
Записываем уравнение реакции: Zn+ 2HCl = ZnCl2 +H2↑
-
Записываем над уравнением реакции имеющиеся данные, а под уравнением - число моль согласно уравнению (равно коэффициенту перед веществом):
x моль 4 моль
Zn +2HCl = ZnCl2 +H2↑
2 моль 1 моль -
Составляем пропорцию:
x моль - 4 моль
2 моль - 1 моль -
Находим x:
x = 4 моль • 2 моль / 1 моль = 8 моль -
Находим молярную массу соляной кислоты: M (HCl) = 1 35,5 = 36,5 (г/моль)
(молярную массу каждого элемента, численно равную относительной атомной массе, смотрим в периодической таблице под знаком элемента и округляем до целых, кроме хлора, который берется 35,5) -
Находим требуемую массу соляной кислоты: m (HCl) = M • n = 36,5 г/моль • 8 моль = 292 г
Ответ: 292 г.
17.Составить окислительно-восстановительную реакцию методом электронного баланса.
Составление уравнения реакции взаимодействия оксида марганца (IV) с концентрированной соляной кислотой (с помощью этой реакции в лабораторных условиях получают хлор).
Запишем формулы исходных и конечных веществ реакции:
НCl + МnО2 → Сl2 + MnСl2 + Н2О
Покажем изменение степеней окисления атомов до и после реакции:
![]()
Эта реакция окислительно-восстановительная, так как изменяются степени окисления атомов хлора и марганца. НCl - восстановитель, MnО2 - окислитель. Составляем электронные уравнения:
![]()
и находим коэффициенты при восстановителе и окислителе. Они соответственно равны 2 и 1. Коэффициент 2 (а не 1) ставится потому, что 2 атома хлора со степенью окисления -1 отдают 2 электрона. Этот коэффициент уже стоит в электронном уравнении:
2НСl + MnO2 → Сl2 + MnСl2 + Н2О
Находим коэффициенты для других реагирующих веществ. Из электронных уравнений видно, что на 2 моль HCl приходится 1 моль MnО2. Однако, учитывая, что для связывания образующегося двухзарядного иона марганца нужно еще 2 моль кислоты, перед восстановителем следует поставить коэффициент 4. Тогда воды получится 2 моль. Окончательное уравнение имеет вид
4НCl + МnО2 = Сl2 + MnСl2 + 2Н2О
Проверку правильности написания уравнения можно ограничить подсчетом числа атомов одного какого-либо элемента, например хлора: в левой части 4 и в правой 2 + 2 = 4.
Поскольку в методе электронного баланса изображаются уравнения реакций в молекулярной форме, то после составления и проверки их следует написать в ионной форме.
Перепишем составленное уравнение в ионной форме:
4Н+ + 4Сl- + МnО2 = Сl2 + Мn2+ + 2Сl- + 2Н2О
и после сокращения одинаковых ионов в обеих частях уравнения получим
4Н+ + 2Cl- + MnO2 = Сl2 + Mn2+ + 2Н2О
18.Задача. Вычисление массы продукта реакции, если известно количество вещества одного из исходных веществ.
Пример:
Сколько г хлорида цинка можно получить, имея 0,5 моль соляной
кислоты?
Решение:
-
Записываем уравнение реакции.
-
Записываем над уравнением реакции имеющиеся данные, а под уравнением - число моль согласно уравнению (равно коэффициенту перед веществом):
0,5 моль x моль
Zn 2HCl = ZnCl2 H2↑
2 моль 1 моль -
Составляем пропорцию:
0,5 моль - х моль
2 моль - 1 моль -
Находим x:
x = 0,5 моль • 1 моль / 2 моль = 0,25 моль -
Находим молярную массу хлорида цинка:
M(ZnCl2) = 65 35,5 • 2 = 136 (г/моль) -
Находим массу соли:
m (ZnCl2) = M • n = 136 г/моль • 0,25 моль = 34 г
Ответ: 34 г.
19.Задача. Вычисление массы продукта реакции, если для его получения взят раствор с определенной массовой долей (%) исходного вещества.
Пример:
Сколько граммов хлорида цинка получится при растворении избытка цинка в 20 граммах 10%-ного раствора соляной кислоты?
Решение:
1) Находим массу HCl в растворе:
m HCl = 20г • 10% : 100% = 2 г
2) Находим количество вещества HCl:
M (HCl) = 35,5 1 = 36,5 г/моль
n = m/M = 2 г : 36,5 г/моль = 0,055 моль
3) Подписываем данные над уравнением реакции, а число моль согласно
уравнению (равно коэффициентам) под ним:
0,055 моль x моль
Zn 2HCl = ZnCl2 H2↑
2 моль 1 моль
Составляем пропорцию:
0,055 моль - x моль
2 моль - 1 моль
Находим x:
x = 0,055 моль • 1 моль / 2 моль = 0,028 моль
4) Находим массу соли:
M (ZnCl2) = 65 35,5 • 2 = 136 г/моль
m = M • n = 136 г/моль • 0,028 моль = 3,8 г
Ответ: 3,8 г.
(Если подставлять в уравнение не моли, а граммы, то получится
точнее - 3,7 г)
20.Задача на нахождение молярной концентрацию раствора.
Пример. Раствор объемом 500 мл содержит NaOH массой 5 г. Определить молярную концентрацию этого раствора.
V(р-ра)=500мл, или 0,5 л
m(NaOH )=5г;
____________________
Найти: C(NaOH )
Решение:
1. Вычислим число моль в 5 г NaOH :
n(NaOH)=m(NaOH)/M(NaOH); n=5г/40г/моль=0,125 моль
2. Определим молярную концентрацию раствора:
C=n(NaOH)/V(р-ра);
C=0,125 моль/0,5=0,25моль/л;
Ответ:C=0,25моль/л;