- Учителю
- Технологическая карта урока химии 8 класс по теме Химические реакции
Технологическая карта урока химии 8 класс по теме Химические реакции























































Технологическая карта урока
по теме
«Химические реакции»
8 класс
Дегтярь Л.Н.
Учитель химии
МБОУ «Войсковицкая СОШ №1»
Гатчинский район, Ленинградская область
2014 год.
ПЛАН-КОНСПЕКТ УРОКА
Тема урока: Химические реакции.
Цели урока:
-
Деятельностная:
- формирование познавательных универсальных учебные действий при изучении химических реакций.
-
Предметно-дидактическая:
- актуализация знаний о химических явлениях - химических реакциях и их признаках;
- формирование представления об условиях протекания химических реакций.
Планируемые образовательные результаты урока: создание условия для развития УУД:
Предметные:
- Знают и дают определение понятию «химическая реакция», признакам и условиям течения химических реакций, типам реакций по поглощению или выделению энергии.
- Умеют отличать химические реакции от физических явлений.
Метапредметные действия:
- целеполагание - ставят задачи с учетом знаний, полученных на предыдущем уроке;
- планирование - составляют план (устно или письменно) выполнения лабораторного опыта;
- организуют рабочее место.
- формулируют проблему о возможности отличить химическую реакцию от физического явления;
- классифицируют изученные явления;
- ведут наблюдение, проводят анализ и делают выводы по результатам лабораторных опытов, различают химические реакции по характерным признакам.
- умеют работать в паре, сотрудничать с учителем и сверстниками для достижения запланированных результатов;
- умеют выражать свои мысли и доводят их в диалоге до партнера при выполнении лабораторного опыта.
Личностные:
- убеждаются в познаваемости мира;
- осознают необходимость соблюдения правил техники безопасности при выполнении эксперимента;
Тип урока:
-
По ведущей дидактической цели: изучение нового материала.
-
По способу организации: синтетический
-
По ведущему методу обучения: проблемный.
Методы обучения:
-
Основной: построение и решение проблемы.
-
Дополнительные: объяснение, беседа, самостоятельная работа в парах, демонстрационный и лабораторный практикум и т.д.
Основные вопросы урока:
-
Химические реакции - явления, связанные с изменением состава вещества.
-
Признаки и условия протекания химических реакций.
-
Выделение тепла и света - реакции горения.
-
Понятие об экзо- и эндотермических реакциях.
Средства обучения:
- О.С.Габриелян. Учебник «Химия 8 класс». М. ДРОФА. 2010 год.
- Оборудование и реактивы для демонстрационного и лабораторного эксперимента: дихромат аммония, магний, соляная кислота, серная кислота, малахит, мрамор, спиртовка, сульфат меди (II), гидроксид натрия, фенолфталеин, стеклянная трубка, известковая вода, пробирки.
- Приложения.
- Инструктивные карты для выполнения лабораторного эксперимента.
- Электронная презентация «Химические реакции».
- Мультимедийное оборудование.
Ход урока:
Этап урока
Методы обучения
Учебно-познавательные задачи урока
Формируемые УУД
Методы оценки/самооценки
Деятельность учителя
Деятельность ученика
1
2
3
4
5
6
1.Организационный момент
Проверяет готовность учащихся к уроку
Приветствуют учителя, готовят рабочее место
Метапредметные: организуют рабочее место.
2.Актуализация знаний и выявление возникших затруднений.
Фронтальная беседа
Самостоятельная работа (проверочный минитест, оформление результатов в таблицу и работа с рисунком -приложение 1).
Постановка проблемы
1.Вспомните и перечислите известные вам физические явления в химии.
2.Какие изменения происходят с веществами при физических явлениях?
3.Изменяется ли при этом состав веществ, из которых состоят тела?
Контролирует работу учащихся.
Выясняет возникшие затруднения.
После выполнения химического теста учитель организует взаимопроверку выполнения задания.
Предлагает озаглавить правую часть таблицы (заслушав варианты ответов, вводит понятие «химическая реакция»)
По результатам работы предлагает определить главное отличие химических реакций от физических явлений.
Итак, в химической реакции меняется состав вещества. Можем ли мы по внешним признакам определить это изменение? Можно ли отличить химическую реакцию от физического явления?
По каким признакам?
Каковы условия протекания химических реакций?
Объявляет тему урока.
1.Называют физические явления: дистилляция, фильтрование, кристаллизация, возгонка.
2. Изменяется агрегатное состояние вещества, форма или размеры тел.
3.Состав веществ при физических явлениях не меняется.
Выполняют самостоятельную работу, используя приложение 1.
Осуществляют взаимопровер ку, сверяют правильность выполнения задания.
Минитест:
Среди перечисленных явлений укажите физические и занесите их в левую часть таблицы, а явления, которые не относятся к физическим, занесите в правую часть таблицы:
а) ржавление железа,
б) горение свечи,
в) плавление льда,
г) плавление олова,
е) испарение воды,
ж) получение проволоки из бруска алюминия, з)скисание молока,
и) горение спирта.
Работа с рисунком
Объясняют сделанный выбор.
Варианты ответов: химические процессы, явления.
Сравнивают рисунки, делают вывод (при химических реакциях изменяется состав вещества).
Составляют схему:
ФИЗИЧЕСКИЕ -
Явления
идут с: ХИМИЧЕСКИЕ -
новых веществ не образуется
образуются новые вещества
Дают определение химическим реакциям.
Предметные: умеют отличить химичес- кие явления от физических;
понимают, какой процесс называется химической реакцией.
Метапредметные:
целеполагание - ставят задачи с учетом знаний, полученных на предыдущем уроке;
- формулируют проблему: возможность отличить химическую реакцию от физического явления;
-умеют выражать свои мысли и донести их в диалоге с учителем
Взаимопроверка
3.Построение плана ответа на поставлен ные вопросы.
Беседа
Ответы на поставленные вопросы можно найти, изучив теоретический материал по учебнику, а можно попытаться найти в результате наблюдений, которые вам предстоит осуществить по ходу демонстрационного и лабораторного эксперимента.
Предложите ваши варианты решения проблемы.
Под руководством учителя разрабатывают план:
1.Провести наблюдения по ходу демонстрационного эксперимента и назвать признаки проделанных реакций.
2. Выполнить лабораторный эксперимент, сделать вывод о существующих признаках химических реакций.
Метапредметные:
- планируют: составляют план под руководством учителя
4.Реализация плана работы.
Беседа. Демонстрационный и лабораторный эксперименты.
Работа в группах и парах.
Работа с текстом учебника.
Внимательно пронаблюдайте, устно опишите то, что будете наблюдать и определите, можно ли данное явление отнести к химической реакции, по каким признакам.
Опыт №1 Разложение дихромата аммония.

Вопрос: Какое явление в природе напоминает этот опыт?
Вопрос: Можем ли мы визуально определить, произошла ли химическая реакция? По каким признакам?
Вопрос: Существуют ли какие-либо еще, кроме названных, признаки химических реакций?
Для ответа на этот вопрос вам необходимо выполнить лабораторные опыты.
Проводит инструктаж по технике безопасности, контролирует работу групп (задания для лабораторного эксперимента делятся на три группы и выполняются по инструктивным карточкам в парах - приложение 2).
Предлагает обсудить результаты проведенных реакций, отметив их признаки.
По окончании работы и обсуждения ее результатов предлагает каждому оценить степень участия в лабора- торном эксперименте по пятибалльной системе.
После обсуждения результа- тов наблюдений, получен- ных в ходе лабораторного эксперимента и составления схемы, предлагает вспом- нить признаки реакции, отмеченные в ходе наблюде- ния за опытом «Вулкан».
Демонстрирует опыт «Горение магния».
Отметьте признаки данной реакции.
Вопрос: Всегда ли реакции, идущие с выделением энергии, сопровождаются выделением света?
Предлагает ученикам, работавшим в группе №3 потрогать дно пробирки, в которой проводилась реакция цинка с соляной
кислотой.
Вводит определение реакции горения.
Демонстрирует опыт «Разложение малахита».
Задание: Назовите условия, при которых проводились реакции горения магния и разложения малахита,
сравните данные условия, определив черты сходства и различия.
Обобщает высказанное учениками, обращая внимание на то, что для реакции горения магния нагревание необходимо только для того, чтобы реакция началась, а при разложении малахита нагревание необходимо на протяжении всей реакции.
Подводит к классификации химических реакций по признаку выделение или поглощение тепла (энергии). Объясняет значение терминов: экзотермическая,
эндотермическая.
Для осуществления реакции разложения малахита необходимым условием было нагревание.
Вопрос:
Какие ещё условия, кроме нагревания, необходимы для протекания химических реакций?
Задание: работа с текстом учебника.
Отметить и выписать в тетрадь условия протекания химических реакций.
Ответы:
1.Извержение вулкана.
2. Изменение цвета вещества, выделение тепла и света.
В группах выбирают «заве- дующего лабораторией» и
выполняют в парах лабораторные опыты с использованием инструктивных карточек (приложение 2).
1 группа:
- р-р сульфата меди (II) + р-р гидроксида натрия;
- гидроксид меди (II) + р-р серной кислоты;
2 группа:
- мрамор (мел) + р-р соляной кислота;
3 группа:
- к р-ру гидроксида натрия добавить каплю фенолфталеина + р-р соляной кислоты;
- к гранулам цинка добавить раствор соляной кислоты.
Выполняют все:
- гидроксид кальция (известковая вода) + углекислый газ.
Представитель от каждой группы («заведующий лабораторией») озвучивает результаты наблюдений.
Оценивают степень своего участия в проведении лабораторного эксперимента и выставляют оценку на бланке ответов.
По ходу обсуждения на доске (интерактивной или простой) создаётся схема, которую заносят в тетрадь:
выпадение растворение
осадка осадка
Признаки
химических
реакций
выделение изменение
газа окраски
вещества
выделение выделение
тепла тепла и
света
Вариант ответа: выделение тепла и света;
В схеме добавляются признаки: выделение тепловой энергии и света.
(синие стрелки)
Отмечают, что пробирка нагрелась, но свет при этом не выделяется.
Сравнивают условия реакций:
сходство - необходимо нагревание;
различие - при горении магния нагревали только в начале реакции, при разло- жении малахита нагревали на протяжении всего опыта.
Составляют схему:
«Классификация химических реакций по тепловому эффекту», заносят ее в тетрадь (приложение 3).
Записывают в тетрадь определения реакций горения, экзо - и эндотермической.
Варианты ответа: нагревание
сливание растворов и др.
Работают с текстом учебника, делают запись в тетради:
Условия протекания химических реакций:
1)соприкосновение реагирующих веществ (измельчение, растворение);
2)нагревание.
Предметные:
Знают определение «химическая реакция», признаки и условия течения химических реакций, типы реакций по поглощению или выделению энергии.
Характеризуют реакции горения, экзо- и эндотермичес кие.
Метапредметные:
- планируют: сов- местно с учителем составляют план (устно или письмен- но) выполнения лабо раторного опыта;
- организуют рабочее место;
- умеют проводить анализ и делать вывод - по итогам лабораторных опытов различают химические реакции по характерным признакам;
-умеют работать в паре, сотрудничать с учителем и сверстни ками для достиже- ния запланирован- ных результатов.
-Умеют выражать свои мысли и дово- дить их в диалоге до партнера при выполнении л.о.
Личностные:
-Убеждаются в познаваемости мира; - осознают необходимость соблюдения правил техники безопаснос- ти при выполнении эксперимента;
-вырабатывают навыки культуры поведения со сверстниками на уроке.
Самооценка
5.Закрепление и самооценка.
Самостоятельная работа со слайдами презентации.
Выдаёт задания на самостоятельную работу (либо тест, либо работа с презентацией, в которой предлагаются изображения или видео различных физических явлений и химических реакций). Учащимся предлагается выбрать химические реакции и записать признаки, по которым их можно отличить от физических явлений.(Приложение 4)
После выполнения задания предлагает ознакомиться с правильными ответами и оценить свою работу.(приложение 5)
Выполняют самостоятельную работу (приложение 4), сверяют ответы и выставляют оценку.
Приложение 5
Предметные:
-знают определение и признаки химичес- ких реакций;
-умеют отличить химические реакции от физических явлений.
Метапредметные:
-умеют корректиро- вать ответы.
Личностные:
-умеют оценить результаты продви- жения к поставлен- ной цели.
Самооценка.
6.Рефлексия деятельности на уроке.
Беседа.
Назовите самые интересные и успешные, по вашему мнению, ответы участников вашей группы.
Вопросы:
1.Удалось ли вам справиться с заданиями?
2. Какое задание было для вас наиболее интересным?
2.Какое задание было для вас наиболее сложным?
3.Какую бы вы поставили себе оценку за урок?
Задает домашнее задание.
1.В тетради записывают «да» или «нет».
2.Отмечают задание (тест, лабораторная, умение сделать вывод, провести наблюдение и т.д.)
3.В тетради выставляют оценку.
Метапредметные:
- отмечают интересные ответы участников группы, наиболее успешные ответы.
Самооценка.
Приложение №1.
-
Среди перечисленных явлений укажите физические и занесите их в левую часть таблицы, а явления, которые не относятся к физическим, занесите в правую часть таблицы: а) ржавление железа, б) горение свечи, в) плавление льда, г) плавление олова,
е) испарение воды, ж) получение проволоки из бруска алюминия, з)скисание молока, и) горение спирта.
-
Физические явления
?
-
Физические явления
Химические реакции
в, г, е, ж
а, б, з, и
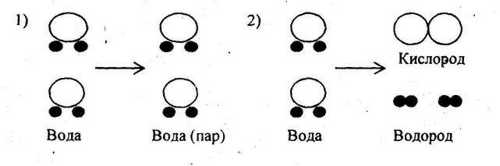
2.Определите по рисункам, где показана сущность физического явления. Подготовьте объяснение своего выбора устно.
Сравните обозначенные на рисунках процессы по плану:
-
Определите исходные вещества в первом и во втором процессах, назовите их.
-
Определите образовавшиеся вещества в обоих процессах, назовите их.
-
Ответьте на вопрос: в чём отличие второго процесса от первого?
-
Проанализируйте ваши ответы и определите, какой из процессов проходит с изменением состава вещества.
Приложение №2
ЗАДАНИЕ группы №1
Проведите предложенные химические реакции. Результаты наблюдений занесите в таблицу.
ОПЫТ №1: В пробирку к 1 мл раствора сульфата меди (II) прилейте небольшое количество раствора гидроксида натрия.
ОПЫТ №2: К полученному в первом опыте осадку гидроксида меди (II) прилейте 1 мл раствора серной кислоты.
ОПЫТ №3: В пробирку с раствором гидроксида кальция (известковой воды) опустить стеклянную палочку. Сделать выдох через палочку, опущенную в раствор.
-
Признаки исходных веществ
Наблюдения (признаки реакции)
Признаки образовавшихся веществ
ОПЫТ №1
+
C
CuSO4 NaOH
Прозрачный Прозрачный
раствор бесцветный
голубого раствор
цвета
ОПЫТ №2
+
Cu(OH)2 H2SO4
осадок прозрачный
голубого цвета бесцветный р-р
ОТВЕТ
-
Признаки исходных веществ
Наблюдения (признаки реакции)
Признаки образовавшихся веществ
ОПЫТ №1
+
C
CuSO4 NaOH
Прозрачный Прозрачный
раствор бесцветный
голубого раствор
цвета
Раствор не прозрачный, образовался осадок голубого цвета
Образование (выпадение) осадка ↓
ОПЫТ №2
+
Cu(OH)2 H2SO4
осадок прозрачный
голубого цвета бесцветный р-р
Прозрачный раствор голубого цвета
Растворение осадка
ЗАДАНИЕ группы №2
Проведите предложенные химические реакции. Результаты наблюдений занесите в таблицу.
ОПЫТ №1: В пробирку к кусочкам мрамора (мела) прилейте 2 мл раствора соляной кислоты.
ОПЫТ №2: В пробирку с раствором гидроксида кальция (известковой воды) опустить стеклянную палочку. Сделать выдох через палочку, опущенную в раствор.
-
Признаки исходных веществ
Наблюдения (признаки реакции)
Признаки образовавшихся веществ
ОПЫТ №1
+
C
CaCO HCl
Кусочки Прозрачный
мела бесцветный
раствор
ОТВЕТ:
-
Признаки исходных веществ
Наблюдения (признаки реакции)
Признаки образовавшихся веществ
ОПЫТ №1
+
C
CaCO HCl
Кусочки Прозрачный
мела бесцветный
раствор
«Вскипание» раствора, выделение пузырьков газа
Выделение газа ↑
ЗАДАНИЕ группы №3
Проведите предложенные химические реакции. Результаты наблюдений занесите в таблицу.
ОПЫТ №1: В пробирку к 1 мл раствора гидроксида натрия добавить каплю фенолфталеина, затем прилить 1 мл раствора соляной кислоты.
ОПЫТ №2: В пробирку поместить гранулу цинка и прилить 2 мл соляной кислоты.
ОПЫТ №3: В пробирку с раствором гидроксида кальция (известковой воды) опустить стеклянную палочку. Сделать выдох через палочку, опущенную в раствор.
-
Признаки исходных веществ
Наблюдения (признаки реакции)
Признаки образовавшихся веществ
ОПЫТ №1
+ капля +
C фенолфталеина
NaOH HCl
Прозрачный Прозрачный
бесцветный бесцветный
раствор раствор
ОПЫТ №2
+
C
Zn HCl
Гранула Прозрачный
цинка бесцветный
раствор
ОТВЕТ:
-
Признаки исходных веществ
Наблюдения (признаки реакции)
Признаки образовавшихся веществ
ОПЫТ №1
+ капля +
C фенолфталеина
NaOH HCl
Прозрачный Прозрачный
бесцветный бесцветный
раствор раствор
-
Раствор окрасился в малиновый цвет
-
Раствор стал бесцветным
Изменение окраски
ОПЫТ №2
+
C
Zn HCl
Гранула Прозрачный
цинка бесцветный
раствор
Выделяются пузырьки газа, цинк расходуется
Выделение газа ↑
-
Приложение № 5
-
№ слайда
Признак химической реакции
1
Выделение газа
3
Образование осадка
4
Выделение света и тепла
7
Изменение цвета
8
Изменение цвета
9
Выделение газа
10
Свет, тепло
11
Изменение цвета
12
Свет, тепло
13
Свет
14
Свет, тепло
15
Изменение цвета
Приложение №3
Классификация химических реакций по тепловому эффекту
ТЕПЛОВОЙ ЭФФЕКТ ХИМИЧЕСКОЙ РЕАКЦИИ
ОБОЗНАЧАЕТСЯ ПОКАЗЫВАЕТ ИЗМЕРЯЕТСЯ
Q Дж/моль
КОЛИЧЕСТВО ТЕПЛОТЫ, КОТОРОЕ
ВЫДЕЛЯЕТСЯ ИЛИ ПОГЛОЩАЕТСЯ
В ХОДЕ ХИМИЧЕСКОЙ РЕАКЦИИ
+Q -Q
ЭКЗОТЕРМИЧЕСКАЯ РЕАКЦИЯ ЭНДОТЕРМИЧЕСКАЯ РЕАКЦИЯ
Приложение 4
Слайд № 1

Слайд №2 образование снежинок

Слайд №3 скисание молока слайд №4


Слайд №5 утренняя роса выпала Слайд №6 ложку «скрутило»


Слайд №7 Слайд №8


Слайд № 9 погашение соды уксусом Слайд № 10


Слайд № 11 Слайд № 12

Слайд №13 Слайд № 14


Слайд № 15 таяние снега, льда Слайд № 16

