- Учителю
- Практические работы 8 класс
Практические работы 8 класс
Практическая работа № 1
«Приёмы обращения с лабораторным оборудованием»
Цель: познакомиться с правилами техники безопасности при работе в кабинете химии, лабораторным оборудованием и приёмами обращения с ним.
Ход работы
Правила техники безопасности при работе в кабинете химии
1) Познакомьтесь с правилами техники безопасности, которые необходимо соблюдать при выполнении лабораторных и практических работ в кабинете химии.
2) Изучите краткую инструкцию по оказанию мер первой медицинской помощи при различного рода отравлениях и поражениях организма.
3) Проверьте полученные знания с помощью тренажёра «Меры предосторожности при работе в лаборатории»
Часть 1. Лабораторный штатив и приёмы обращения с ним
Цель: познакомиться с устройством лабораторного штатива и отработать приёмы обращения с ним
О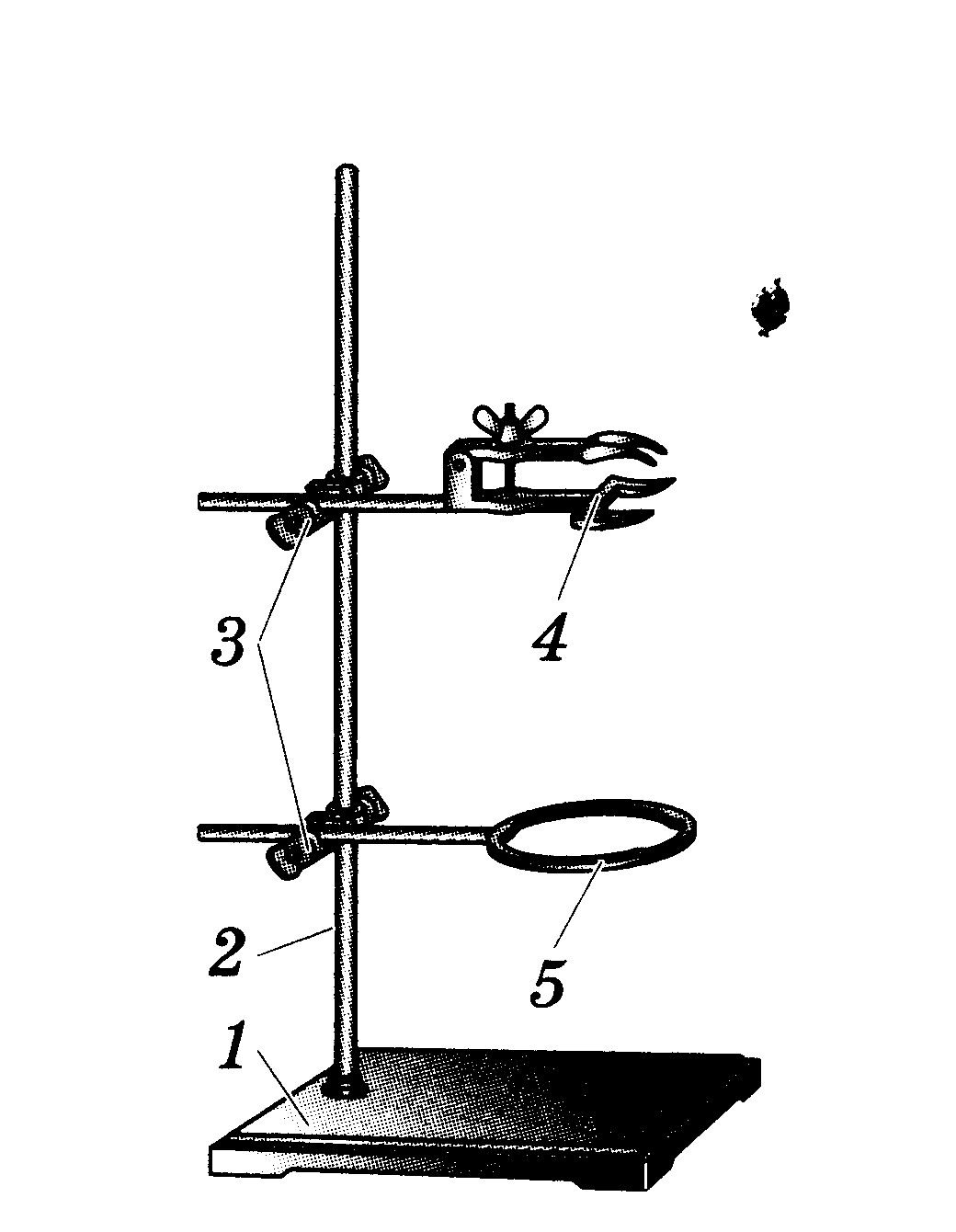 борудование: лабораторный штатив,
муфты (2 шт.), лапка, кольцо, пробирка, металлическая сетка,
химический стакан (100 мл), фарфоровая чашка.
борудование: лабораторный штатив,
муфты (2 шт.), лапка, кольцо, пробирка, металлическая сетка,
химический стакан (100 мл), фарфоровая чашка.
1) Ознакомьтесь с устройством лабораторного штатива.
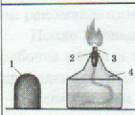
Штатив (см. рисунок) служит для установки и закрепления пробирок, колб, химических стаканов, тиглей, чашек, холодильников и т.д. при выполнении опытов.
Он состоит из массивной чугунной подставки (1), в которую ввинчен стержень (2). Чугунная подставка придаёт штативу устойчивость. На стержне при помощи муфт (3) укрепляют лапку (4) и кольцо (5).
2) Выполните описанные ниже приёмы работы с лабораторным штативом согласно инструкции
а) Рассмотрите детали, из которых собирается металлический штатив;
б) Закрепите муфту-зажим винтом на стрежне штатива;
в) Закрепите в зажиме лапку с помощью другого винта; ослабляя винт, переместите лапку с зажимом вверх и вниз по стрежню, устанавливая их на необходимой высоте.
г) Замените лапку в зажиме на кольцо; установите кольцо вместе с зажимом на различной высоте.
д) Соберите штатив таким образом, чтобы на стержне были укреплены одновременно лапка и кольцо на различной высоте, кольцо закрепите ниже, а лапку - выше.
е) Закрепите в лапке пробирку в вертикальном положении, отверстием вверх
Внимание!
Пробирка закреплена правильно, если её можно повернуть в лапке без больших усилий. Слишком крепко зажатая пробирка может лопнуть при нагревании.
ж) Укрепите пробирку в горизонтальном положении, не вынимая её из лапки. Для этого ослабьте винт зажима, крепящий лапку, и поверните лапку вместе с пробиркой на 900
з) Установите фарфоровую чашку для выпаривания на кольцо штатива, затем снимите её, используя для этого тигельные щипцы.
и) На кольцо штатива положите металлическую сетку, на неё поставьте химический стакан.
к) Установите в кольцо воронку, круглодонную колбу.
л) Разберите металлический лабораторный штатив, отсоединив лапку, кольцо и зажимы. Приведите рабочее место в порядок.
3) Оформите отчёт о проделанной работе.
Часть 2. Спиртовка и приёмы обращения с ней. Строение пламени
Цели:
-
познакомиться с устройством спиртовки, отработать приёмы и правила обращения с ней;
-
изучить строение пламени спиртовки
Оборудование: спиртовка, спички.
1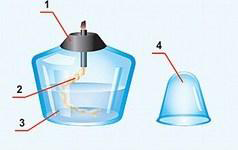 ) Ознакомьтесь с устройством
спиртовки.
) Ознакомьтесь с устройством
спиртовки.
Спиртовка (см. рисунок) состоит из сосуда (резервуара) (3), в который налит спирт, фитиля (2), укреплённого в металлической трубке с диском (1), и колпачка (4).
2) Выполните описанные ниже приёмы работы со спиртовкой согласно инструкции
а) Снимите колпачок со спиртовки, поставьте его на стол. Проверьте, плотно ли диск прилегает к отверстию сосуда, оно должно быть закрыто полностью, иначе может вспыхнуть спирт в сосуде.
б) Зажгите спиртовку горящей спичкой.
Внимание!
Нельзя зажигать спиртовку от другой горящей спиртовки! Это может вызвать пожар.
в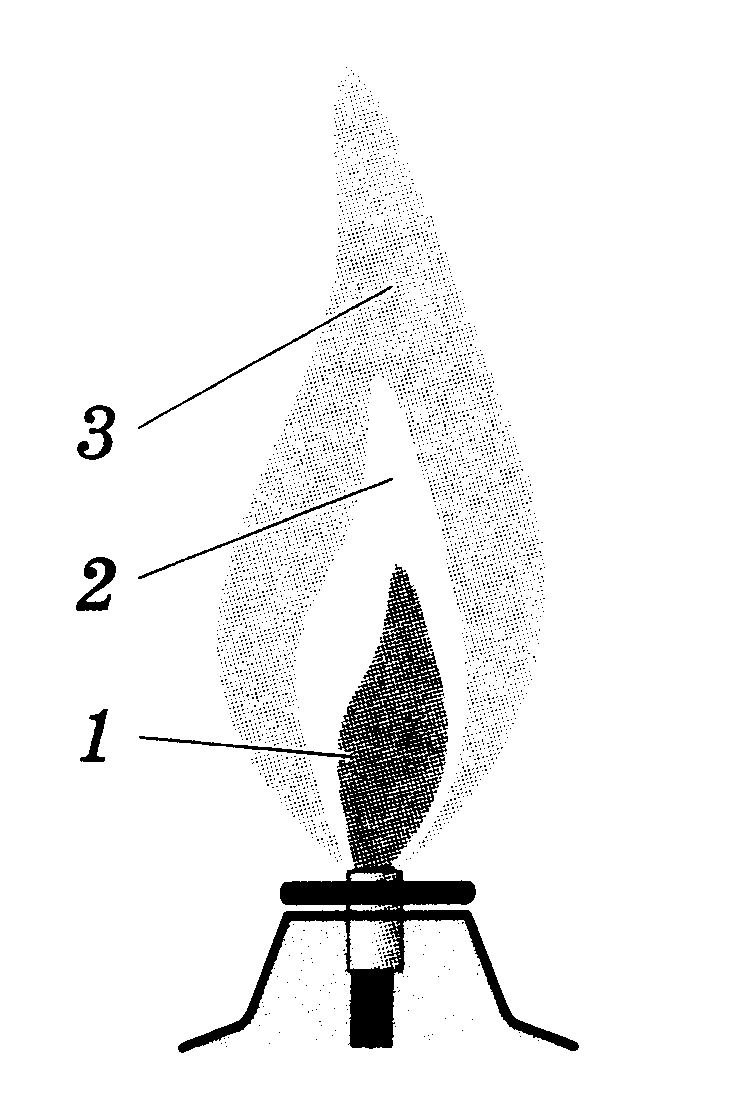 ) Погасите спиртовку, накрыв пламя
колпачком.
) Погасите спиртовку, накрыв пламя
колпачком.
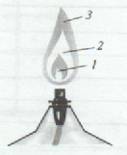
г) Снова зажгите спиртовку и рассмотрите строение пламени: оно неоднородно - в нём можно выделить три зоны (см. рисунок)
Тёмная зона (1) находится в нижней части пламени, она самая холодная. За ней самая яркая часть пламени (2). Температура здесь выше, чем в тёмной зоне, но наиболее высокая температура - в зоне 3. Эта зона находится в верхней трети пламени.
д) Исследуйте каждую зону пламени, внося в них на короткое время спички. Быстрее других загорается спичка в верхней зоне пламени, медленнее - спичка во внутренней зоне.
е) В какую часть пламени необходимо помещать нагреваемый предмет? Почему?
3) Оформите отчёт
Часть 3. Лабораторное оборудование и основные приёмы обращения с ним
Цель: познакомиться с лабораторным оборудованием и отработать приёмы обращения с ним
Оборудование: штатив для пробирок, пробирка, химический стакан (100 мл), колба, воронка, стеклянная палочка, шпатель, пробиркодержатель, тигельные щипцы, фарфоровая чашка.
1) Изучите информацию о группах лабораторного оборудования.
Можно выделить несколько групп лабораторного оборудования:
I группа - стеклянная посуда
II группа - фарфоровая посуда
III группа - нагревательные приборы
IV группа - приборы для фиксации и закрепления посуды
Стеклянная посуда может быть сделана из толстого (нетермостойкого) стекла и, соответственно, из термостойкого стекла (тонкостенного).
Посуда из термостойкого стекла используется для проведения операций, сопровождающихся изменением температуры (нагревание, охлаждение).
Посуда из толстого стекла предназначена для хранения реактивов или проведения простейших операций, не сопровождающихся изменением температуры.
2) Ознакомьтесь с назначением лабораторного оборудованияПробирки
Используются для проведения опытов и монтажа приборов
Химические стаканы
Служит для проведения простейших операций
Колба плоскодонная (нетермостойкое стекло)
Используется для проведения химических реакций при комнатной температуре или для хранения реактивов
Колба круглодонная (из термостойкого стекла)
Используется для проведения разнообразных химических реакций при нагревании
Воронка
Для разнообразных целей, например, переливания жидкости из одного сосуда в другой, фильтрования
Стеклянная палочка
Для разнообразных химических целей, например перемешивание веществ в стакане
Шпатель
Используется для насыпания твердых веществ
Пробиркодержатель
Используется для удержания пробирок
Тигельные щипцы
Используется для переноса тигля и фарфоровой чашки с веществами
Фарфоровая чашка
Применяется для выпаривания жидкостей
Тигель
Предназначен для нагревания и прокаливания твердых веществ
Ложечка для сжигания
Предназначена для сжигания твердых веществ
Фарфоровая ступка с пестиком
Служит для размельчения и растирания твердых веществ
Мерный цилиндр
Используется для измерения объема жидкости
Ареометр
Предназначен для измерения плотности растворов
Термометр
Предназначен для измерения температуры реакционной смеси или температуры кипения и плавления
Делительная воронка
Используется для разделения двух несмешивающихся жидкостей или для прикапывания раствора какого-либо вещества
Химическая пипетка
Служит для отбора пробы жидких веществ (Прибор для взятия определенного объема жидкости)
Штатив для пробирок
Служит для закрепления пробирок при проведение опытов
Мерная колба
Служит для приготовления растворов определенной концентрации
Чашка Петри
Используется для высушивания различных веществ
3) Осуществите нагревание воды в пробирке
Налейте в пробирку 1-2 мл воды. Закрепите пробирку в пробиркодержателе у отверстия. Нагревание проводите в верхней зоне пламени. Нагревайте осторожно сначала всю пробирку, а затем ту часть, где находится вода. Поставьте пробирку в штатив для пробирок.
4) Проверьте себя с помощью тренажёра «Оборудование и посуда для химической лаборатории»
5) Оформите отчёт
п\п
Название прибора, его рисунок
Назначение прибора и его частей
1.
Лабораторный штатив
Лабораторный штатив служит для…
1. Чугунная подставка -
2. Стержень -
3. Кольцо -
4. Муфта -
5. Лапка -
2.
Спиртовка
Спиртовка служит для …
1. Колпачок -
2.Металлическая трубка с диском -
3.Фитиль -
4. Резервуар -
3.
Строение пламени
1 -
2 -
3 -
Сделайте общий вывод по проделанной работе, исходя из цели урока.
Практическая работа №2
«Наблюдения за изменениями, происходящими с горящей свечой, и их описание».
Цель Изучить явления, которые происходят при горении свечи.
Оборудование и реактивы: свеча, спички, стеклянная трубка с оттянутым концом, пробирки, предметное стекло, держатель, известковая вода, резиновая груша, стеклянная трубка, пол-литровая и двухлитровая банки.
Ход работы:
-
Организационный момент.
Учитель проводит инструктаж по технике безопасности.
-
Объявляет цель практической работы и комментирует инструкцию по её выполнению в контексте учебника
-
Проделать работу согласно инструкции в учебнике.
-
Оформление осуществить в следующей таблице:
опыта
Название опыта
Что делаю?
Что наблюдаю?
Вывод
1.
Физические явления при горении свечи
2.
Обнаружение продуктов горения в пламени
3.
Влияние воздуха на горение свечи
Сделайте надписи на рисунке пламени свечи, поясняющие, что находится в каждой части пламени.
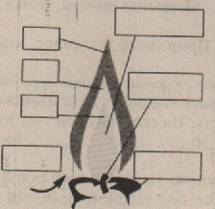
5. Сделайте общий вывод по проделанной работе, исходя из цели урока.
Практическая работа №3
«Анализ почвы и воды».
Цель: исследовать почву и речную воду г. Магнитогорска
Оборудование и реактивы: пробирки, почва, речная вода, дистиллированная вода, пробка, мерная пробирка, лупа, лабораторный штатив, воронка, бумажный фильтр, стеклянная пластинка, держатель, спиртовка, лакмусовая бумажка, мерный цилиндр, коническая колба.
Ход работы:
1.Организационный момент.
Учитель проводит инструктаж по технике безопасности.
2.Объявляет цель практической работы и комментирует инструкцию по её выполнению в контексте учебника
3.Проделать работу согласно инструкции в учебнике
4.Оформление осуществить в следующей таблице:Порядок выполнения работы
Рисунки прибора с поясняющими надписями
Наблюдения
Выводы
1.Механический анализ почвы

Осаждение частичек почвы на дно пробирки происходит следующим образом:
В состав почвы входят:
2.Получение почвенного раствора и опыты с ним

Внешний вид фильтрата и его состав:
Лакмусовая бумажка имеет цвет:
Почва
состоит из:
Среда почвы -
3.Определение прозрачности воды
Высота водного столба дистиллированной воды:
Высота водного столба речной воды:
Уровень прозрачности речной воды -
Речная вода -
4.Определение интенсивности запаха воды
Запах речной воды -
По шкале интенсивности запахов соответствует -
3. Сделайте общий вывод по проделанной работе, исходя из цели урока.
Практическая работа №4
«Признаки химических реакций».
Цель: изучение признаков химических реакций.
Оборудование и реактивы: пробирки, тигельные щипцы, спиртовка, медная проволока, спички, серная кислота, мрамор, соляная кислота, лучинка, хлорид железа (III), роданид калия, сульфат натрия, хлорид бария.
Ход урока:
1.Организационный момент.
Учитель проводит инструктаж по технике безопасности.
2.Объявляет цель практической работы и комментирует инструкцию по её выполнению в контексте учебника
3.Проделать работу согласно инструкции в учебнике
4.Оформление осуществить в следующей таблице:
опыта
Название опыта
Исходные вещества
Признаки и условия реакции
Уравнения химической реакции
(и её тип )
Выводы
1.
Прокаливание медной проволоки и взаимодействие оксида меди (II) с серной кислотой
Cu и O2
CuO и H2SO4
Cu + O2 =
( )
CuO + H2SO4 =
( )
2.
Взаимодействие мрамора с кислотой
CaCO3 и HCI
CaCO3 + HCI =
( )
3.
Взаимодействие хлорида железа(III) с роданидом калия
FeCI3 и KCNS
FeCI3 + KCNS=
( )
4.
Взаимодействие сульфата натрия с хлоридом бария
Na2SO4 и
BaCI2
Na2SO4 +BaCI2 =
( )
-
Вывод. Признаками химических реакций являются:
Практическая работа №5
«Приготовление раствора сахара и расчет его массовой доли в растворе».
Цель: Приготовить раствор сахара и рассчитать его массовую долю в полученном растворе.
Оборудование и реактивы: коническая колба, мерный цилиндр, весы и разновесы, дистиллированная вода, сахар, стеклянная палочка.
Ход работы:
1.Организационный момент.
Учитель проводит инструктаж по технике безопасности.
2.Объявляет цель практической работы и комментирует инструкцию по её выполнению в контексте учебника
3.Проделать работу согласно инструкции в учебнике и правилам взвешивания и пользования мерного цилиндра
(Приложение № 1).
4.Оформление практической работы.
После написания в тетради названия работы и перечисленного оборудования и реактивов прописать каждое проделанное действие по порядку:
а) отмерить мерным цилиндром 50 мл дистиллированной воды;
б) перелить воду в коническую колбу;
в) взвесить на весах (предварительно уравновесить весы с бумажкой, на которой будете взвешивать сахар) одну ложку сахара;
г) пересыпать взвешенный сахар в коническую колбу;
д) перемешать стеклянной палочкой до полного растворения сахара.
Сделать расчеты: (пример)
Дано: Решение:
m(сахара) = W(сахара)= m(сахара): m(раствора);
V(воды) = 50 мл 1) m(воды)= V(воды)* Р( воды);
Р( воды) = 1г/мл 2) m(раствора)= m(сахара)+ m(воды).
________________ N(сахара)= Nа *n;
W(сахара) - ? 1) n= m(сахара):М(сахара);
N(сахара) - ? 2) М(С12Н22О11)= 342 г/моль
23
Nа=6*10 молекул/моль.
Название опыта
Что делаю?
Что наблюдаю?
Расчеты:
Вывод:
Приготовление раствора сахара и расчет его массовой доли в растворе
5. Сделайте общий вывод по проделанной работе, исходя из цели урока.
Приложение № 1
Правила взвешивания на лабораторных весах:
Перед началом работы проверьте, в порядке ли набор разновесов, находятся ли весы в равновесии, и, если нет, уравновесьте их с помощью чистого речного песка или бумаги. Не кладите вещество на чашу весов! Взвешивайте его обязательно на листе бумаги. Располагая на весах взвешиваемый предмет или разновесы, придерживайте чашу весов (но не стрелку), чтобы избежать резких колебаний чаши в ту или иную сторону. Разновесы кладите только пинцетом. Снимая разновесы с весов, помещайте их только на отведенное место в футляре. При взвешивании разновесы всегда размещайте на правой чаше весов, а взвешиваемое вещество (предмет) - на левой. Разновесы ставьте на чашу весов всегда в определенном порядке: начните с более тяжелого разновеса, чем взвешиваемый предмет. Если он слишком тяжел, то снимите его и положите следующий, более легкий. И наоборот. Если масса разновесов мала, то, не снимая положенные разновесы, дополните более тяжелыми. Приведите весы в равновесие. По окончании взвешивания чаши весов необходимо протереть.
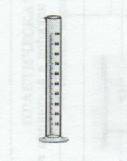
Правила пользования мерным цилиндром:
Чтобы правильно отмерить измерительным цилиндром
необходимый объем неокрашенной прозрачной жидкости - воды, её
наливают так, чтобы нижний край мениска находился на уровне
необходимого деления цилиндра (рис. I). Соблюдайте правильное
положение цилиндра относительно глаз при наполнении его жидкостью!
Последние порции воды приливайте по каплям с помощью пипетки, чтобы
не перелить. Рис. 1 
Практическая работа №6
«Ионные уравнения»
Цель работы: Провести качественные реакции на ионы, научиться определять анионы и катионы, познакомиться с характером проведения реакций ионного обмена.
Оборудование: Штатив с пробирками, стеклянная палочка, синий лакмус, серная кислота, хлорид бария, хлорид натрия, нитрат серебра, карбонат натрия, соляная кислота, сульфат меди (2), гидроксид натрия.
Ход работы:
1.Организационный момент.
Учитель проводит инструктаж по технике безопасности.
2.Объявляет цель практической работы и комментирует инструкцию по её выполнению в контексте учебника
3.Проделать работу согласно инструкции в учебнике.
4.Оформление практической работы.
1. этап работы: Обнаружение в растворе катионов водорода (H+) и сульфат анионов (SO4 2-).
1. Налейте в первую пробирку 1мл раствора серной кислоты и добавьте синий лакмус, во вторую пробирку 1мл серной кислоты и добавьте раствор хлорида бария, что происходит, объясните наблюдаемое.
2. Составьте уравнение диссоциации кислоты и реакции ионного обмена между взятыми растворами веществ, что служит реактивом на катион H+ и анион SO4 2-?
2. этап работы: Обнаружение хлорид ( Cl -) аниона в растворе.
1. Налейте в пробирку 1мл раствора хлорида натрия и добавьте нитрат серебра, что происходит, объясните наблюдаемое.
2. Составьте уравнение реакции ионного обмена между взятыми растворами веществ, что служит реактивом на анион Cl -?
3. этап работы: Обнаружение карбонат (СО3 2-) аниона в растворе.
1. Налейте в пробирку 1мл раствора карбоната натрия и добавьте раствор соляной кислоты, что происходит, объясните наблюдаемое.
2. Составьте уравнение реакции ионного обмена между взятыми растворами веществ, что служит реактивом анион СО3 2-?
4. этап работы: Поделайте реакции, подтверждающие качественный состав CuSO4 .
1. Налейте в первую пробирку раствор сульфата меди (2) и добавьте раствор гидроксида натрия, во вторую пробирку раствор сульфат меди (2) и добавьте раствор хлорид бария, что происходит, объясните наблюдаемое?
2.Составьте уравнения реакции ионного обмена между взятыми растворами веществ, что служит реактивом на катион Cu2+ и анион SO4 2-?
Название опыта
Что делаю?
Что наблюдаю?
УХР (Молекулярное, полное ионное и сокращенно-ионное уравнение)
Вывод:
Опыт 1. Обнаружение в растворе катионов водорода (H+) и сульфат анионов (SO4 2-).
Опыт 2. Обнаружение хлорид ( Cl -) аниона в растворе.
Опыт 3. Обнаружение карбонат (СО3 2-) аниона в растворе.
Опыт 4. Поделайте реакции, подтверждающие качественный состав CuSO4 .
5. Сделайте общий вывод по проделанной работе, исходя из цели урока.
Практическая работа № 7
«Условия протекания химических реакций между растворами электролитов до конца»
Цель работы: изучить условия протекания химических реакций между растворами электролитов до конца. Продолжить отработку навыков составления уравнений химических реакций.
Оборудование и реактивы: штатив с пробирками, азотная кислота, разбавленная серная кислота, растворы сульфата меди (II), хлорида калия, гидроксида натрия, фосфата натрия, сульфита натрия, карбоната натрия, фенолфталеина.
Ход работы:
1.Организационный момент.
Учитель проводит инструктаж по технике безопасности.
2.Объявляет цель практической работы и комментирует инструкцию по её выполнению в контексте учебника
3.Проделать работу согласно инструкции в учебнике.
4.Оформление практической работы.
Что делаю?
Что наблюдаю?
УХР (Молекулярное, полное ионное и сокращенно-ионное уравнение)
Вывод:
Опыт 1.В две пробирки налили по 1-2 мл раствора: 1 - сульфата меди (II), 2 - хлорида калия. Затем в каждую пробирку добавили: 1 - немного раствора гидроксида натрия, 2 - раствора фосфата натрия
Опыт 2.
В две пробирки налили по 1-2 мл растворов сульфита натрия и карбоната натрия соответственно. Затем в каждую из них прилили немного азотной кислоты.
Опыт 3.
В пробирку налили 2-3 мл раствора гидроксида натрия и добавили 2-3 капли фенолфталеина. Затем прилили разбавленную серную кислоту до обесцвечивания.
В другую пробирку прилили 1-2 мл раствора сульфата меди (II) и добавили немного раствора гидроксида натрия. Прилили в пробирку разбавленную серную кислоту до растворения осадка.
5. Сделайте общий вывод по проделанной работе, исходя из цели урока.
Практическая работа № 8
«Свойства кислот, оснований, и солей»
Цель работы: применить знания, полученные при изучении классификации и химических свойств оксидов, оснований, кислот для объяснения проделанных опытов. Продолжить отработку навыков составления уравнений химических реакций.
Оборудование и реактивы: штатив с пробирками, разбавленная соляная кислота, гранула цинка, оксида меди (II); карбоната натрия, хлорида железа (III), гидроксида натрия, гидроксида калия.
Ход работы:
1.Организационный момент.
Учитель проводит инструктаж по технике безопасности.
2.Объявляет цель практической работы и комментирует инструкцию по её выполнению в контексте учебника
3.Проделать работу согласно инструкции в учебнике.
4.Оформление практической работы.
Что делаю?
Что наблюдаю?
УХР (Молекулярное, полное ионное и сокращенно-ионное уравнение)
Вывод:
Опыт 1.
В пробирку с гранулой цинка прилили 1-2 мл соляной кислоты.
В пробирку добавили немного оксида меди (II), прилили 1-2 мл соляной кислоты, пробирку нагрели.
В пробирку добавили немного карбоната натрия, прилили 1-2 мл соляной кислоты.
В пробирку прилили 1-2 мл раствора гидроксида меди (II), прилили 1-2 мл соляной кислоты.
Опыт 2.
В пробирку налили 1-2 мл раствора хлорида железа (III), затем прилили по каплям раствор гидроксида натрия до образования осадка. Осадок перенесли в три пробирки. В первую из них прилили разбавленную соляную кислоту, во вторую пробирку раствор гидроксида калия, третью пробирку нагрели.
5. Сделайте общий вывод по проделанной работе, исходя из цели урока.
</ Практическая работа №9
«Решение экспериментальных задач»
Цель работы: Формировать умение решать экспериментальные задачи по теме: «Классы неорганических соединений», формировать умение грамотно оформлять эксперимент, писать уравнения реакции в свете ТЭД.
Оборудование и реактивы: штатив с пробирками, гранулы цинка, азотная кислота, разбавленные серная и соляная кислоты; растворы: хлорида магния, гидроксида натрия, сульфата калия, карбоната натрия, фосфата калия, хлорида цинка, сульфата меди (II).
Ход работы:
1.Организационный момент.
Учитель проводит инструктаж по технике безопасности.
2.Объявляет цель практической работы и комментирует инструкцию по её выполнению в контексте учебника
3.Проделать работу согласно инструкции в учебнике.
4.Оформление практической работы.
Что делаю?
Что наблюдаю?
УХР (Молекулярное, полное ионное и сокращенное-ионное уравнение)
Вывод:
Опыт 1.
В пробирку налили по 1-2 мл разбавленной серной кислоты и опустили в неё гранулу цинка.
Опыт 2.
В 4 пробирки налили по 1-2 мл раствора хлорида магния. Затем в каждую из них прилили растворы: 1 - гидроксида натрия, 2 - сульфата калия, 3 -карбоната натрия, 4 - фосфата калия
Опыт 3.
Слили попарно растворы: 1 - карбоната натрия и соляной кислоты, 2 - хлорида цинка и азотной кислоты, 3 - сульфата меди (II) и азотной кислоты. Немного нагрели растворы и осторожно изучили запах в пробирках.
5. Сделайте общий вывод по проделанной работе, исходя из цели урока.