- Учителю
- Конспект урока по химии на тему Кристаллические решетки ( 8 класс)
Конспект урока по химии на тему Кристаллические решетки ( 8 класс)
Урок на тему: «Кристаллические решетки».
Пояснительная записка.
Учитель: химии
Предмет: химия
Класс: 8
Тема урока: «Кристаллические решетки»
Тип урок: комбинированный
Автор учебника: О.С.Габриелян. Учебник для общеобразовательных учреждений. «Химия 8». 2011г. М.: Дрофа.
Раздел учебника: соединения химических элементов.
Учебная нагрузка: 68 часов в год, 2 раза в неделю.
Актуальность: данный урок является седьмым в изучении раздела химии. Использования средств ИКТ. Визуализация химических опытов, привить интерес к изучению предмета в соответствии с образовательными стандартами.
Технологии и методики: применяемые на уроке: ИКТ- презентация в формате Power Point служит для визуализации учебного материала и рассчитана на сопровождение всего урока. С ее помощью осуществляется демонстрация и объяснение нового материала, проверка знаний и самопроверка. Демонстрационный опыт позволяет повысить познавательный интерес к предмету. С помощью беседы успешно решается задача формирования теоретических и фактических знаний, а их применение способствует развитию логического мышления, речевых умений и эмоциональной сферы личности. Здоровьесберегающие технологии. В ходе урока спланированы организационно-технические, санитарно-гигиенические условия здоровьясбережения, учитывающие возрастные особенности детей.
Анализ результатов урока:
Урок способствует развитию межпредметных знаний.
Упражнения направлены на активизацию деятельности учащихся;
Демонстрационный опыт дает возможность для развития познавательного интереса к предмету;
Рефлексия позволяет осуществить каждому ребенку самоанализ своей деятельности на уроке.
Перспективы использования данного материала: разработка данного урока будет размещена в методической копилке школьного сайта и в социальной сети работников образования.
Теория Кристаллические решетки
Вещество, может существовать в трех агрегатных состояниях: газообразном, жидком и твердом. Например, кислород, который при обычных условиях представляет собой газ, при температуре -194 °С превращается в жидкость голубого цвета, я при температуре -218,8º С затвердевает в снегообразную массу, состоящую из кристаллов синего цвета. Особенности химических связей оказывают влияние на свойства твердых веществ. Температурный интервал существования вещества в твердом состоянии определяется его температурами кипения и плавления. Твердые вещества делятся на кристаллические и аморфные. Аморфные вещества не имеют четкой температуры плавления - при нагревании они постепенно размягчаются и переходят в текучее состояние. В аморфном состоянии, например, находится пластилин или различные смолы.
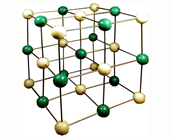 Кристаллические
вещества характеризуются правильным расположением тех частиц, из
которых они состоят: атомов, молекул и ионов. - в строго
определенных точках пространства. При соединении этих точек прямыми
линиями образуется пространственный каркас, который называют
кристаллической решеткой. Точки, в которых размещены частицы
кристалла, называют изложи решетки. В узлах воображаемой решетки
могут находиться ионы, атомы и молекулы. Эти частицы совершают
колебательные движения. С повышением температуры размах этих
колебаний возрастает, что приводит, как правило, к тепловому
расширению тел.
Кристаллические
вещества характеризуются правильным расположением тех частиц, из
которых они состоят: атомов, молекул и ионов. - в строго
определенных точках пространства. При соединении этих точек прямыми
линиями образуется пространственный каркас, который называют
кристаллической решеткой. Точки, в которых размещены частицы
кристалла, называют изложи решетки. В узлах воображаемой решетки
могут находиться ионы, атомы и молекулы. Эти частицы совершают
колебательные движения. С повышением температуры размах этих
колебаний возрастает, что приводит, как правило, к тепловому
расширению тел.
В зависимости от типа частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na+,Сl-, так и сложные SO 2- 4, ОН-. Следовательно, ионные кристаллические решетки имеют соли, некоторые оксиды и гидроксиды металлов, то есть те вещества, в которых существует ионная химическая связь. Например, кристалл хлорида натрия построен из чередующихся положительных ионов Na+ и отрицательных Сl-, образующих решетку в форме куба. Связи между ионами в таком кристалле очень устойчивы. Поэтому вещества с ионной решетной обладают сравнительно высокой твердостью и прочностью, они тугоплавки и нелетучи.
Атомными наливают кристаллические решетки, в узлах которых находятся отдельные атомы. В таких решетках атомы соединены между собой очень прочными ковалентными
связями. Примером веществ с таким типом кристаллических решеток может служить алмаз - одно из аллотропных видоизменений углерода.
Число веществ с атомной кристаллической решеткой не очень велико. К ним относятся кристаллические бор, кремний и германий, а также сложные вещества, например такие, в состав которых входит оксид кремния (IV) - SlО2: кремнезем, кварц, песок, горный хрусталь .Большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (например, у алмаза она свыше 3500 ºС), они прочны и тверды, практически нерастворимы.
Молекулярными называют кристаллические решетки, в узлах которых располагаются молекулы. Химические связи в этих молекулах могут быть и полярными и неполярными. Несмотря на то что атомы внутри молекул связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому вещества с молекулярными кристаллическими решетками имеют малую твердость, низкие температуры плавления, летучи. Примерами веществ с молекулярными кристаллическими решетками являются твердая вода - лед, твердый оксид углерода (IV) - «сухой лед», твердые хлороводород и сероводород, твердые простые вещества, образованные одно- (благородные газы), двух- , трех- (О3), четырех- (Р4). восьмиатомными молекулами. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар).
В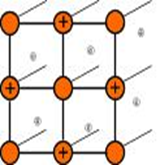 ещества
с металлической связью имеют металлические кристаллические решетки.
В узлах таких решеток находятся атомы и ионы (то атомы, то ионы, в
которые легко превращаются атомы металла, отдавая свои внешние
электроны в общее пользование). Такое внутреннее строение металлов
определяет их характерные физические свойства : ковкость
ещества
с металлической связью имеют металлические кристаллические решетки.
В узлах таких решеток находятся атомы и ионы (то атомы, то ионы, в
которые легко превращаются атомы металла, отдавая свои внешние
электроны в общее пользование). Такое внутреннее строение металлов
определяет их характерные физические свойства : ковкость
-пластичность,
- электро- и теплопроводность,
-металлический блеск.
 Для
веществ, имеющих молекулярное строение, справедлив открытый
французским химиком Ж. Л. Прустом (1799-1803) закон постоянства
состава. В настоящее время этот закон формулируется так:
«Молекулярные химические соединения независимо от способа их
получения имеют постоянный состав и свойства. Закон Пруста является
одним из основных законов химии. Однако для веществ с
немолекулярным строением например , ионным, этот закон не всегда
справедлив.
Для
веществ, имеющих молекулярное строение, справедлив открытый
французским химиком Ж. Л. Прустом (1799-1803) закон постоянства
состава. В настоящее время этот закон формулируется так:
«Молекулярные химические соединения независимо от способа их
получения имеют постоянный состав и свойства. Закон Пруста является
одним из основных законов химии. Однако для веществ с
немолекулярным строением например , ионным, этот закон не всегда
справедлив.
Урок Кристаллические решетки.
Цели урока: сформировать понятие о кристаллических решетках.
Задачи урока:
Образовательные:
-сформировать понятия о кристаллическом и аморфном строении твёрдых тел;
- ознакомить с типами кристаллических решёток.
Развивающие:
-развивать понятие о химическом веществе и его свойствах;
- развивать познавательный интереса учащихся к изучаемому предмету активизируя деятельность на уроке, обеспечивая прочность знаний;
-формировать умение проводить поиск, обработку, анализ и систематизацию информации.
Воспитательные:
-способствовать формированию научного мировоззрения;
-создать условия для повышения познавательной активности учащихся в приобретении новых знаний;
-способствовать самостоятельности и креативности мышления.
Оборудование:
Компьютер, проектор, экран.
Авторский медиапродукт : презентация Power Point, упражнение с проверкой;
лабораторное оборудование: химические подносы с пластилином, графитовыми стержнями от простого карандаша, химические стаканы с горячей водой, металлические и пластмассовые ложки;
таблицы: «ПСХЭ Д. И. Менделеева», «Виды химической связи», «Электроотрицательность химических элементов»; модели кристаллических решёток разных типов: поваренной соли, алмаза и графита , углекислого газа , меди.
Понятийный аппарат усвоения: кристаллическая решетка, типы кристаллических решеток: молекулярная, ионная, металлическая, атомная.
Способы действия учащихся: проследить взаимосвязи между типом кристаллической решётки и свойствами вещества, между характером химической связи и типом кристаллической решетки.
Тип урока: комбинированный.
Методы обучения:
-работа с природным материалом и материалами (образцы минералов, кристаллов) и моделями кристаллических решеток;
-иллюстративно- словесный;
-практико-ориентированный (химический эксперимент), самостоятельная работа.
Структура урока:
1.Организационный момент.
2.Актуализация знаний.
3.Изучение нового материала.
4.Закрепление изученного материала.
5.Домашнее задание.
6.Подведение итогов;
7.Рефлексия
Технологическая карта урока:
1.Организационный момент.
Задача: проверка готовности к уроку.
Форма контроля: педагогическое наблюдение.
1.Приветствие обучающихся.
2.Проверка наличия принадлежностей для урока.
Приветствие учителя.
Показывают готовность к уроку.
- Применение презентации поможет более наглядно и ярко рассмотреть изучаемый материал
3.Оглашение темы урока, целей.
Записывают в тетрадь тему урока.
Слайд №1
2.Актуализация знаний.
Задача: показать необходимость приобретения знаний по предмету.
Форма контролям : педагогическое наблюдение.
3.Изучение нового материала.
Задача: 1дать понятие о кристаллической решетке;
2. познакомить с типами кристаллических решеток: атомная, молекулярная, ионная, металлическая
Форма контроля : беседа.
Далее следует рассказ обучающегося с элементами беседы.
Любое вещество может находиться в газообразном, жидком или твёрдом агрегатном состоянии. Например, вода. При обычных условиях - это жидкость, но она может быть паром и льдом. Или кислород при обычных условиях представляет собой газ, при температуре -194 ºC он превращается в жидкость голубого цвета, а при температуре -218,8 ºC затвердевает в снегообразную массу, состоящую из кристаллов синего цвета.
Температурный интервал существования вещества в твёрдом состоянии определяется его температурами плавления и кипения.
Проблемный вопрос: от чего зависит агрегатное состояние веществ? (заслушиваются ответы учащихся)
Демонстрация химического эксперимента : взять пластилин и грифель карандаша поочередно их сломать.
Вопрос обучающимся: что вы наблюдаете в данном случае?
Далее учитель продолжает рассказ.
Различают 2 вида твёрдых веществ - аморфные и кристаллические , которые обладают различными свойствами.
Проблемные вопрос: Как объяснить существование твёрдых веществ со столь различными свойствами?
Почему кристаллические вещества при ударе раскалываются в определённых плоскостях, а аморфные вещества этим свойством не обладают?
Свойства веществ в твёрдом состоянии зависят от типа кристаллической решётки (прежде всего от того , какие частицы находятся в её узлах) , что , в свою очередь , обусловлено типом химической связи в данном веществе.
Для аморфного состояния характерно наличие только ближнего порядка. Структуры аморфных веществ напоминают жидкости, однако обладают гораздо меньшей текучестью. Аморфное состояние обычно неустойчиво. Под действием механических нагрузок или при изменении температуры аморфные тела могут закристаллизоваться. Реакционная способность веществ в аморфном состоянии значительно выше, чем в кристаллическом.
Твердые вещества имеют кристаллическое строение. Геометрически правильная форма вещества в твёрдом состоянии получила название кристалла, а подобное состояние - кристаллического. Оно характеризуется правильным расположением частиц в строго определенных точках пространства. При мысленном соединении этих точек пересекающимися прямыми линиями образуется пространственный каркас, который называют кристаллической решеткой. Точки, в которых размещены частицы, называются узлами кристаллической решетки (демонстрация таблицы).
Учитель демонстрирует учащимся рисунки моделей разных типов кристаллических решёток.
Далее учитель продолжает:
«Изучать особенности каждого типа кристаллической решётки вы будете самостоятельно, в учебниках страницы 115 - 119. Успехов вам в работе. После проверить правильность заполнения таблицы с помощью опроса.
Задание. Заполните таблицу:
Таблица 1. Кристаллические решётки, вид связи и свойства веществУчитель ещё раз повторяет классу учащихся, что тип кристаллической решётки зависит от вида химической связи в веществе:
1) вещества, с ионной связью имеют ионную кристаллическую решётку;
2) вещества, с ковалентной связью имеют атомную или молекулярную кристаллическую решётку;
3) вещества, с металлической связью имеют металлическую кристаллическую решётку.
Обратите внимание на зависимость типа кристаллических решёток для простых веществ от положения химических элементов в ПСХЭ Д. И. Менделеева .
Вопрос классу : «Скажите, какой тип кристаллической решётки из изученных сегодня на уроке не встречается в простых веществах?»
Остался ещё один момент урока - закон постоянства состава веществ , которому подчиняются вещества с молекулярным строением. Этот закон был открыт французским химиком Ж. Л. Прустом в 1808 году.
Постоянство состава веществ независимо от способа их получения можно объяснить, например, на получении углекислого газа: сгоранием угля в кислороде, разложением карбоната кальция, действием соляной кислоты на мрамор или воды.
Для веществ с ионным строением закон Ж. Л. Пруста не всегда выполняется.
Слушают одноклассника
Предполагаемый ответ : от физических условий.
Обучающиеся следят за экспериментом.
Предполагаемый ответ: у кусочков пластилина края различные, у грифеля - чёткие, ровные края
Предполагаемый ответ:
1). От строения.
2). Строение должно быть строго определённым
Учащиеся внимательно слушают рассказ учителя.
учащиеся со слайда, конспектируют в свои тетради определения кристаллической решётке, кристаллу, узлам решётки, перечисляют типы самих кристаллических решёток. Учащиеся внимательно слушают учителя, смотрят на различные модели кристаллических решёток, сравнивают их между собой
самостоятельная работа с учебником.
Самостоятельная работа с учебником.
Обучающиеся слушают учителя
Предполагаемый ответ : ионные.
.
Слайд №2
Слайд№3
Слайд №4
Слайд№5
Слайд№6
Слайд№7
Слайд№8
Физкультминутка поставили руки на локотки, ладошки смотрят друг на друга. Каждый палец руки должен по очереди совершить mах нажатие на большой палец со словами:
Здравствуй мальчик,
Здравствуй пальчик,
С добрым утром,
С ясным днем.
Упражнение повторить 2-3 раза. .
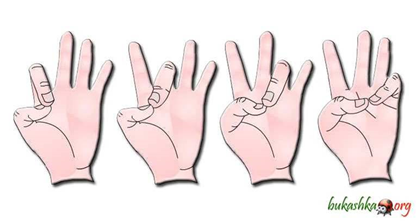
Данное упражнение помогает активизировать все процессы головного мозга , так как на кончиках пальцев располагаются многочисленные нервные окончания
4.Закрепление изученного материала.
Задача: выполнив упражнение, обучающиеся должны уметь отвечать на конкретно поставленный вопрос.
Форма контроля : индивидуальный, взаимопроверка..
4.Закрепление изученного материала.
Задача: обучающиеся должны уметь отвечать на конкретно поставленный вопрос и выполнять упражнение.
Форма контроля: индивидуальный, взаимопроверка..
Вопросы обучающимся:
1). Сделайте вывод, от чего зависят свойства веществ?
2). От чего зависит тип кристаллической решётки?
3). От чего зависит вид связи?
4). Какую классификацию веществ вы узнали сегодня на уроке?
5). В каком агрегатном состоянии вещества имеют кристаллические решётки?
6). Какие типы кристаллических решёток вы теперь знаете?
7). С каким основным законом химии вы познакомились сегодня на уроке?
Задание классу: обучающиеся письменно в своих тетрадях выполняют тест по теме «Кристаллические решётки» (тест распечатанный выдается для каждого ученика) и по завершении меняются тетрадями с соседом по парте и осуществляют взаимопроверку.
ТЕСТ ПО ТЕМЕ: «КРИСТАЛЛИЧЕСКИЕ РЕШЁТКИ»
1. Среди перечисленных веществ выберите вещества, которые имеют кристаллическое строение: а)воск; б). алмаз; в). сосновая смола; г). поваренная соль; д). «сухой лёд» (твёрдый CO2).
2. В узлах разных кристаллических решёток могут находиться: а) атомы; б). электроны; в). протоны; г). ионы; д). молекулы.
3. Выберите вещества, имеющие атомную кристаллическую решётку: а )графит; б). сульфат меди (II); в). алмаз; г). оксид кремния (IV); д). лёд (вода).
4. Выберите вещества, имеющие ионную кристаллическую решётку: а). «сухой лёд» (твёрдый CO2); б). оксид кремния (IV); в). хлорид натрия;
г) гидроксид калия; д). сульфат алюминия.
5. Выберите вещества, имеющие металлическую кристаллическую решётку: а).цинк; б). алмаз; в). графит; г). медь; д). алюминий.
6. Выберите вещества, имеющие молекулярные кристаллические решётки: а).оксид кремния (IV); б). лёд (вода); в). хлорид калия; г). «сухой лёд» (твёрдый CO2); д). глюкоза.
7. В узлах металлической решётки находятся:
а).атомы; б). катионы (положительно заряженные ионы); в). молекулы;
г).анионы (отрицательно заряженные ионы); д). электроны.
8. С каким типом кристаллической решётки вещество хорошо проводит электрический ток:
а).с молекулярной; б). с атомной; в). с ионной; г). с металлической?
9. У какого из веществ выше температура плавления:
а).у иодида калия; б). у йода; в). у йодоводорода; г). у хлороводорода?
ОТВЕТЫ НА ТЕСТ( на доске в презентации)
1 - б, г , д; 6 - б , г , д;
2 - а, г, д; 7 - а , б;
3 - а, в, г; 8 - г;
4 - в, г, д; 9 - а.
5 - а, г, д;
Предполагаемые ответы:
1). От типа кристаллических решёток.
2). От вида химической связи.
3). От строения атома.
4). Вещества в твёрдом агрегатном состоянии делятся на аморфные и кристаллические.
5). В твёрдом.
6). Ионные , атомные , молекулярные , кристаллические.
7). С законом постоянства состава веществ
Обучающие выполняют тест.
Обучающиеся осуществляют взаимопроверку.
Слайд №9
1.Комментирует задание к упражнению. Корректирует правильность его выполнения
2.Подводит итог урока. Делает выводы по уроку. Анализирует деятельность обучающихся.
.Вместе с учителем обсуждают результаты работы.
5.Домашнее задание.
Формулирует домашнее задание по учебнику и тетради. Даёт творческое задание.
Записывают домашнее задание.
Слайд№10
Литература для учителя:
-
О.С.Габриелян. Учебник для общеобразовательных учреждений. «Химия 8». 2011г. М.: Дрофа.
-
О.С.Габриелян, Н.П.Воскобойникова, А.В.Яшукова. «Химия. Настольная книга учителя. 8 класс: методическое пособие». 2007г. М.: Дрофа.
-
О.С.Габриелян, П.Н.Берёзкин. Контрольные и проверочные работы к учебнику «Химия. 8 класс». 2008г. М.: Дрофа.
</