- Учителю
- Разработка урока по химии на тему Водород, его строение, физические свойства и способы получения.
Разработка урока по химии на тему Водород, его строение, физические свойства и способы получения.
Тема урока: Водород, его строение , физические свойства и
способы получения.
Цели урока:
Образовательная - изучить состав, строение и физические свойства водорода как простого вещества. Ознакомить учащихся со способами получения водорода в лаборатории и основными промышленными способами получения. Совершенствовать навыки учащихся в решении задач с применением закона Авогадро и составлении окислительно-восстановительных реакций.
Воспитательная - формирование умений выполнять эксперимент строго по инструкции, соблюдая правила техники безопасности.
Развивающая - развитие познавательных интересов, умение обобщать изученные факты и делать выводы на основе полученных знаний.
Тип урока: Урок усвоения новых знаний и закрепления изученного материала.
Методы обучения: словесно - наглядный и проблемно-поисковый методы.
Оборудование и реактивы: пробирки, гранулы цинка, гранулы алюминия, железо восстановленное, магний, раствор соляной кислоты .
Виртуальные опыты :сайт school- colltction.edu.ru/catalog/eb
План урока:
1. Организационный момент , запись домашнего задания.
2. История открытия водорода.
3. Много ли в природе водорода?
4 .Состав , строение атома и молекулы водорода. Изотопы водорода.
Самый простой… и самый загадочный.
5 .Физические свойства водорода.
6. Изучение способов получения водорода в лаборатории и промышленности.
7. Закрепление
8. Итоги урока.
</ Ход урока.
Организационный момент.(1 мин)
Учитель (вступительное слово). Мы с вами закончили изучение тем «Закон Авогадро. Молярный объём газов» и теперь мы начинаем знакомство с отдельными представителями Периодической системы Д.И.Менделеева . И сегодня мы изучим элемент под номером 1- это Водород.
Прежде чем перейти к изучению данного элемента , предлагаю записать домашнее задание: §7 стр.35 упр.1 (слайд №1)
Предлагаю послушать историю открытия этого элемента.( сообщения учеников).
История открытия водорода.(3мин)
ученик: (слайд №2)
Первооткрывателем водорода по праву можно считать Генри Кавендиша, английского естествоиспытателя, физика и химика, получившего водород во второй половине XVIII века. Однако водород до него исследовали и другие учёные, но принимали его за разновидность воздуха -флогистон.
Немалую роль в открытии водорода сыграл и Михаил Васильевич Ломоносов. (слайд №3) В своей диссертации «О металлическом блеске№(1745 г.) он писал: «При растворении какого-либо неблагородного металла , особенно железа, в кислотных спиртах из отверстия склянки вырывается горючий пар , который представляет собой флогистон».
(слайд №4). Наконец , спустя 21 год в 1766 г., Генри Кавендиш установил что при взаимодействии металлов с разбавленными кислотами выделяется газ, который он назвал «горючий воздух».
ученик:
К сожалению, и Кавендиш находился под влиянием распространенной тогда теории и принял «горючий воздух» за флогистон.
(слайд №5) В 1777г. Антуан Лоран Лавуазье предложил новую теорию горения, отрицающую теорию флогистона. В 1783 году он провёл довольно странный эксперимент, который состоял в следующем: Лавуазье продувал струю водяного пара через нагретый до красного каления …оружейный ствол! Для горючего воздуха было предложено название «гидрогениум», что означает «рождающий воду». Это название предложил французский химик Л.Б. Гитон де Морво. (слайд №6) Русское название «водород» дал присвоил ему Михаил Фёдорович .Соловьёв в 1824 году
Много ли в природе водорода?
ученик: (слайд №7)
Водород-это самый распространённый элемент во Вселенной . В космосе это главный элемент. (слайд №8)Например, ближайшая к нам звезда Галактики, именуемая Солнцем, на 70 % своей массы состоит из водорода. Содержание водорода на Земле (слайд №9) составляет по массовой доле всего 0,15 %. Водород входит в состав воды, каменного и бурого углей, нефти, а также растительных и животных организмов. Помимо этого , водород содержится во всех органических веществах, а их известно уже более 27 миллионов!
Состав , строение атома водорода. Изотопы водорода.
Физические свойства.
(Обобщение опорных знаний о составе, строении и свойствах водорода).
Итак, ребята , давайте рассмотрим строение атома водорода.
ученик(пишет на доске) (слайд №10) (2мин.)
Атом Н: Z=1, p+=1, n0=0, e=1, Ar=1.008
Электронная формула: 1s1
Графическая схема ↑
s- Элемент, неметалл.
В ядре атома водорода один протон, масса которого равна 1 a.e.m.
Учитель Почему же масса химического элемента водорода равна 1.008а.е.м.?
ученик:
Масса не равна единице, так как кроме обычного водорода, называемого протий, существуют изотопы водорода с большей массой: дейтерий и тритий.
(слайды№11)
ученик: Водород - простое вещество.( слайд№12)
(пишет на доске) (2мин.)
Молекула Н2: электронная формула
Молекула водорода состоит из двух атомов и образована ковалентной неполярной химической связью.
Валентность водорода равна 1, степень окисления равна 0.в соединениях -1,+1;
Самый простой… и самый загадочный.
(Обсуждение проблемных вопросов (5мин.)
Учитель:
-
Почему водород в периодической системе химических элементов записан дважды: в Ia и VIIa группах? (слайд№13)
-
В каком случае водород напоминает элементы VIIА группы-галогены, а в каком - элементы 1 А группы -щелочные металлы?
(слайд №й14)
Н0 + ē → Н- (галогены)
Н0 - ē → Н+ (щелочные металлы)
(объяснение и сравнение на доске)
Учитель: А как вы думаете, ребята, какие физические свойства может проявлять водород? (слайд №15)
Водород-это бесцветный газ, без запаха, нерастворим в воде.
Учитель:
А теперь посмотрим виртуальные опыты, подтверждающие эти физические свойства.(3 мин)
*Показ виртуальных опытов слайд №16 и №17
Изучение способов получения водорода.
Показ виртуального опыта ( слайд №19)( 2 мин.)
Учитель: Водород в лаборатории можно получить взаимодействием соляной или разбавленной серной кислот с металлами, стоящими в ряду напряжений до водорода, в первую очередь цинка:
(виртуальный опыт)
Zn + H2SO4→Zn SO4 +
H2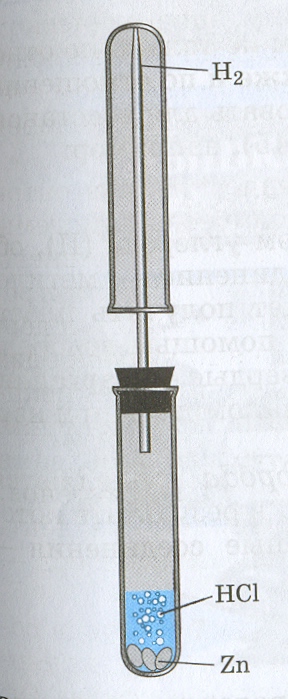
*Какой тип реакции использован?
ученик:
реакция замещения: металл замещает водород в кислоте.
Учитель: Объясните этот процесс с точки зрения ОВР
ученик (3мин.)
Zn0+ H2+1S+6O4-2→Zn+2 S+6O4-2+ H20
Zn0 -2ē → Zn+2 восстановитель
2H+1 +2ē → H20 окислитель
Учитель:
Предлагаю вам стать на место исследователей и получить в лаборатории водород при взаимодействии металлов: цинка и магния с раствором соляной кислоты.Но прежде напоминаю вам о правилах техники безопасности:
*выполняем опыты строго по инструкции.
*используем объёмы кислот , указанные в инструкции.
*т.к. водород с воздухом может образовать взрывоопасную смесь , предлагаю посмотреть виртуальный опыт «Взрыв горючего газа».(слайд20)
Приступаем к работе.
( выполнение опытов с параллельным анализом -разбор уравнений реакций на доске 5-7минут)
Учитель:
*В какой из пробирок металл более активно реагировал с кислотой?
*Почему пробирка, в которой был магний, нагрелась?
Выводы: (делают ученики)
*Чем активнее металл, тем быстрее протекает реакция.
*Реакция идёт с выделением тепла ,это-экзотермическая реакция.
Учитель: Также водород можно получить при взаимодействии активных металлов с водой . (слайд №21) (разбор уравнения взаимодействия натрия с водой проводит ученик -3 мин.)
Учитель: (5мин.)
В промышленности водород получают при смешивании водяного пара с углем или метаном: (слайд №22)
C + H2O → CO + H2↑ (температура 800-900 С, в присутствии катализатора.)
CH4 + H2O → CO + 3H2↑
(при наличии времени- разбор уравнений с точки зрения ОВР на доске -2 ученика)
Учитель: (слайд №23)
Один из самых старых способов - взаимодействие водяного пара с раскаленным железом - способ Лавуазье.
3Fe + 4H2O → Fe 3О4 + 4H2↑
Таким способом водород получали в России, в царской армии для наполнения воздушных шаров, пропуская пар через раскаленные дула пушек.
7.Закрепление.
Учитель: предлагаю решить задачу (слайд №24)
№1Определите объём водорода, который выделится при взаимодействии магния с раствором соляной кислоты, массой 150г с массовой долей вещества 5 %.
(при наличии времени или для дом.задания.) (слайд №25)
№2 В каком случае выделится больший объём водорода: если подействовать раствором соляной кислоты на 10г цинка или на 10 г железа?
8.Подведение итогов. (2мин)
Учитель:
Наш урок подходит к концу. Я надеюсь на то, что вы пополнили свой багаж знаний. Прошу вас дома ещё раз внимательно просмотреть записи в тетради, прочитать соответствующие параграфы из учебника.
Подведём итоги урока.(объявить оценки)
Литература.
1.Журнал «1 Сентября» №3 , 2010 г. Разработка урока «Элемент номер 1» .
2.Книга для чтения по неорганической химии, В.А.Крицман, Москва «Просвещение», 2001 г.