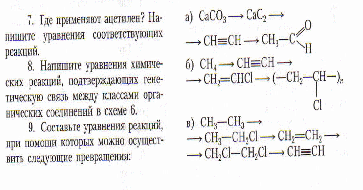- Учителю
- Разработка урока по химии (10 класс) - Алкины. Ацетилен, его получение пиролизом метана и карбидным способом. Химические свойства ацетилена: горение, обесцвечивание бромной воды, присоединение хлороводорода и гидратация. Применение ацетилена на основе сво
Разработка урока по химии (10 класс) - Алкины. Ацетилен, его получение пиролизом метана и карбидным способом. Химические свойства ацетилена: горение, обесцвечивание бромной воды, присоединение хлороводорода и гидратация. Применение ацетилена на основе сво
Разработка урока по химии
10 класс
Урок 8
Тема урока: Алкины. Ацетилен, его получение пиролизом метана и карбидным способом. Химические свойства ацетилена: горение, обесцвечивание бромной воды, присоединение хлороводорода и гидратация. Применение ацетилена на основе свойств. Реакция полимеризации винилхлорида. Поливинилхлорид и его применение.
Цели урока:
- Изучить общую формулу, номенклатуру, физические свойства представителей гомологического ряда алкинов, их строение, химические свойства первого представителя гомологического ряда алкинов - ацетилена, применение.
- Развить общеучебные компетенции, логическое мышление.
- Повысить познавательный интерес учащихся, показать важность знания органической химии.
Тип урока: УПНЗ
Информационно-методическое обеспечение: слайды, схемы, материалы коллекций, таблицы по теме урока.
Учебник: Химия. Органическая химия. 10 класс (базовый уровень). Рудзитис Г.Е., Фельдман Ф.Г., 15-е изд. - М.: 2012. - 192 с.
Характеристика деятельности учащихся: фронтальная, индивидуальная, работа у доски.
Виды контроля: Опрос.
Ход урока
I. Организационный момент урока
II. Актуализация знаний
Опрос по основным понятиям:
Углеводороды
Насыщенные и ненасыщенные соединения
Алкины: формула ряда, первый представитель ряда, основные свойства, способы получения, применение.
III. Проверка домашнего задания
IV. Изложение нового материала
Алкины - непредельные углеводороды, молекулы которых помимо одинарных С-С- связей содержат одну тройную С≡С-связь.
Общая формула ряда - СnH2n-2
Особенности номенклатуры алкинов
Принадлежность углеводорода к классу алкенов отражают суффиксом -ин:
С2Н2 CH≡CH этин (ацетилен)
С3Н4 CH≡C-СН3 пропин
С4Н6 CH≡C-СН2-СН3 бутин-1
и т.д.
Правила названия соединений остаются такими же, как и для алкенов, лишь суффикс заменяется на -ин.
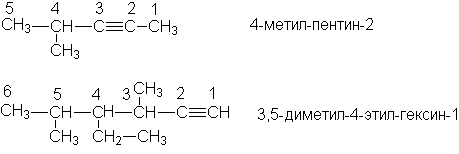
Изомерия алкенов
-
Структурная изомерия.
-
Изомерия строения углеродной цепи.
-
Изомерия положения тройной связи.
-
Межклассовая изомерия.
-
Приведите примеры изомеров каждого типа, назовите их!
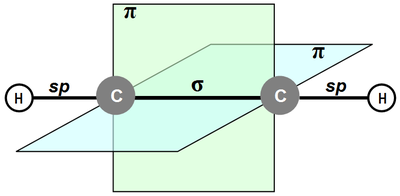
Особенности строения молекул (на примере ацетилена)
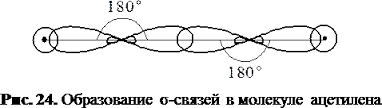
В ацетилене углерод находится в состоянии sp-гибридизации (в гибридизации участвуют одна s и 1 p-орбиталь). У каждого атома углерода в молекуле этилена - 2 гибридные sp-орбитали и по две негибридные р-орбитали. Оси гибридных орбиталей располагаются в одной плоскости, а угол между ними равен 180°.Такие орбитали каждого атома углерода пересекаются с аналогичными другого атома углерода и s-орбиталями двух атомов водовода, образуя σ-связи С-С и С-Н.
Схема образования σ-связей в молекуле ацетилена
Четыре негибридные р-орбитали атомов углерода перекрываются во взаимноперпендикулярных плоскостях, которые расположены перпендикулярно к плоскости σ-связей. Так образуются две π-связи.
С≡С = σ + 2 π
Схема образования π-связей в молекуле этилена
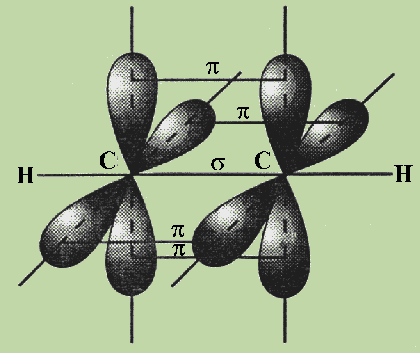
Строение молекулы ацетилена
Физические свойства
Ацетилен - газ, легче воздуха, малорастворим в воде, без запаха. С воздухом образует взрывоопасные смеси.
В ряду алкинов с увеличением молекулярной массы возрастает температура кипения.
Опишите физические свойства ацетилена в виде таблицы в тетради!
Получение
Способы получения ацетилена:
-
Из карбида кальция. (Лабораторный способ)
СаС2 + 2Н2О → С2Н2 ↑ + Са(ОН)2
Получение карбида кальция (в промышленности):
СаО + 3С СаС2 + СО↑
оксид кальция кокс карбид кальция
СаСО3 CaO + CO2
карбонат кальция оксид кальция
-
Термическое разложение метана.
2СН4 С2Н2 + 3Н2↑
Способы получения гомологов ацетилена - углеводородов ряда алкинов:
-
Дегидрогалогенирование - отщепление двух молекул галогеноводорода от дигалогеналканов, которые содержат два атома галогена либо у соседних, либо у одного атома углерода:
Реакция идет под действием спиртового раствора щелочей на галогенпроизводные.
СН3 - СВr2 - СН3 + 2КОН
→
СН3-С ≡ СН + 2КВr + 2Н2О,
2,2 - дибромпропан пропин
Химические свойства
-
Реакции присоединения
-
Взаимодействие с галогенами
-
Качественная реакция на наличие кратных связей - обесцвечивание бромной воды!
Реакции присоединения идут в две стадии.
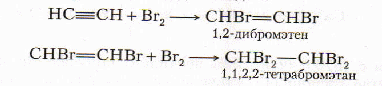
-
С водородом - гидрирование
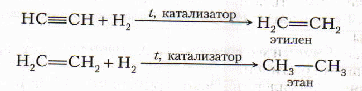
kt - Ni, Pt, Pd.
-
С галоенводородами
![]()
(1-хлорэтен) - винилхлорид
-
С водой - гидратация (реакция Кучерова).
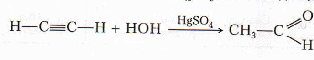
ацетальдегид
-
С металлами.
Продукт реакций - ацетилениды - малорастворимые, неустойчивые, взрывоопасные вещества!
Образование серовато-белого осадка ацетиленида серебра или красно-коричневого осадка ацетиленида меди - качественная реакция на концевую тройную связь!
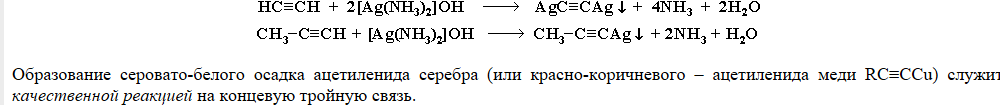
-
Реакции окисления.
-
Горение.
-
![]()
-
Реакция с раствором перманганата калия.
Обесцвечивание раствора перманганата калия (ярко-розовая окраска) - качественная реакция на кратные связи!
Продуктами реакции окисления могут быть разные вещества, если окисление полное - то, основные продукты реакции - углекислый газ и вода.
![]()
-
Реакции полимеризации.
Ацетилен может полимеризоваться в бензол и винилацетилен.
Полимеризация винилхлорида
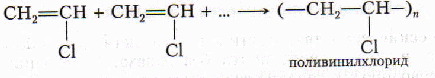
Из поливинилхлорида (ПВХ) получают прочную пластмассу, искусственную кожу, клеенку, диэлектрики и др.
Применение ацетилена
-
Сырье в органическом синтезе (производство волокон, красителей, лаков, лекарств, ПВХ, хлорорпренового каучука, уксусной кислоты, растворителей и др.)
-
При резке и сварке металлов.
V. Закрепление знаний.
Решение задач и упражнений
с.54 - упр.1,3,5,6.
с.55 - упр.8
с.55 - задачи 1.
VI. Рефлексия. Подведение итогов урока
VII. Домашнее задание
Параграф 13,
с. 55 - задачи 2, 3
-
Объясните отличия между строением молекул этилена и ацетилена.
-
Какой углеводород является ближайшим гомологом этина?
-
Составьте уравнения реакций, при помощи которых можно осуществить следующие превращения, укажите условия протекания реакций, назовите продукты реакции: