- Учителю
- Урок по химии для 8 класса «Кислоты»
Урок по химии для 8 класса «Кислоты»

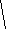




Состав и названия кислот.
Классификация кислот.
Физические и химические свойства.
Способы получения.
Химия.
8 класс.
Подготовили:
Кураева Г.Н. - учитель химии
Сангалиева Г.К. - учитель информатики
Тема урока: Состав и названия кислот. Классификация кислот.
Физические и химические свойства. Способы получения.
Цель: повторить определение кислот, их состав, классификацию, общие свойства; привести в систему знания о кислотах.
Развивать умения учащихся логически мыслить, находить решение нестандартных заданий, продолжить формирование умений наблюдать, анализировать, делать выводы, переходить к обобщению от общего к частному и, наоборот, на новых примерах обогатить знания о кислотах.
Прививать интерес к химии, активизировать познавательную деятельность.
Тип урока: урок-обобщение с использованием информационных технологий.
Оборудование: компьютеры, программное обеспечение 1С: Репетитор - химия. Реактивы: кислоты, индикаторы.
Методы: словесные, наглядные, практические.
План урока.
-
Организационный момент.
-
Введение учеников в урок, разъяснение целей и задач.
-
Правила ТБ.
-
Основная часть.
-
Информационный этап.
-
Определительный этап.
-
Экспериментальный этап.
-
Закрепительный этап.
-
Вывод.
-
Задание на дом.
Ход урока:
Правила ТБ по химии:
При работе с кислотами и щелочами соблюдайте особую осторожность!
Правила ТБ по информатике:
-
Запрещается трогать провода, вилки, розетки, штекеры, передвигать без разрешения учителя оборудование.
-
Запрещается класть на стол рядом с ПК портфели, сумки, книги. На столе должны лежать только ручки и тетради.
-
Нельзя ничего класть на клавиатуру.
-
Во время работы установить расстояние глаз от экрана - на расстоянии вытянутой руки.
-
Учащимся не следует вставать с места при входе посетителей.
-
В случае возникновения зрительного напряжения или усталости можно, не вставая с места, выполнить несколько упражнений для снятия этого напряжения или усталости.
Основная часть.
Информационный этап.
Наша задача - как можно больше узнать о кислотах. Чем же интересны кислоты? Нужны ли они человеку, природе? Встречались ли вы где-нибудь с кислотами, кроме уроков химии?
Пример ответа учащихся:
Кислоты содержатся в нашей пище (фрукты, овощи, молочные продукты, соусы, приправы). Например: лимон, крыжовник, малина, сок свеклы содержат лимонную кислоту.
Очень важна и разнообразна роль кислот в человеческом организме: соляная кислота в желудке( пищеварительная функция и бактерицидная). Кислоты в природе - муравьи, крапива, гусеницы, жуки содержат кислоты. Самая значительная функция кислот в природе - разрушение горных пород и создание почвы. Дождевая вода - слабый раствор угольной и азотной кислот.
Общее число существующих кислот велико. Наибольшее значение имеют 30-50 кислот.
Определительный этап.
Кислоты - это сложные вещества, молекулы которых содержат один или несколько атомов водорода, способных замещаться на атомы металла и кислотный остаток.
Вспомним названия кислот и валентность кислотных остатков (на экране компьютера формулы кислот).
HNO3, HCl, H2S, H2SO3, H2SO4, H2SiO3, HBr, H3PO4,HBO3.
В - чем различаются кислоты?
О - по числу атомов водорода кислоты делятся на односоставные, двухсоставные и многосоставные.
По составу они делятся на кислородсодержащие и бескислородные.
Дополните схему, приведенную на экране.
…………………………..H3AsO4, ………………
Одноосновные HCl, ………………
………………………….
H2S, …………………..
кислоты
……………………….....HF, …………………….
Кислородные HNO3, ………………
Экспериментальный этап.
Физические свойства кислот.
При обычных условиях большинство кислот находится в жидком состоянии - H2SO4, HNO3. Известны твердые кислоты - H3PO4, H3BO3. В основном все кислоты растворимы в воде. Их растворы имеют кислый вкус и вызывают ожоги.
Эксперимент.
Стоят три пробирки с прозрачными растворами. Как узнать, есть ли здесь кислота?
Ученик, используя индикатор, определяет кислоту.
Для того, чтобы вспомнить химические свойства кислот предлагаем вам просмотр опытов на компьютере. Уравнения реакций записать в тетрадь. По завершении работы проверяем уравнения реакций.
Одно уравнение реакции набрать на компьютере в текстовом редакторе Word.
Карточка для учащихся.
№
Фамилия, имя
Рисунки опытов
Тема опытов
1.
Взаимодействие алюминия с соляной кислотой.
Тема - элементы III группы.
2.
Взаимодействие мела с соляной кислотой.
Тема - элементы IV группы.
3.
Взаимодействие оксида меди (II) с соляной кислотой.
Тема - элементы VII группы.
4.
Получение и свойства гидроксида меди (II).
Тема - элементы I группы.
Каким способом получают кислоты?
Просмотр на экране опыта
Взаимодействие оксида фосфора (V) с водой.
Тема - элементы V группы.
Закрепительный этап.
-
На экране компьютеров - формулы разных веществ. Подчеркнуть формулы кислот. H2SO4, MgCl2, Ca (OH) 2, H2O, HCl, Fe2O3, NaOH, HNO3.
-
Игра «Третий лишний» (логическая цепочка). На экране компьютера формулы веществ, зачеркнуть лишнее.
HF, HCl, H3PO4
Na2CO3, H2SO3, H2S
H2SO4, HI, H2O
BaO, HNO3, HCl
-
Укажите вещества, с которыми взаимодействует раствор соляной кислоты. Формулы на экране компьютера, ответ устный.
- Cu, CuO, Cu (OH) 2
- Mg, MgO, Mg (OH) 2, BaCl2
- Mg, MgO, Mg (OH) 2, AgNO3
- Hg, AgNO3, CuCl2
-
Решение задачи.
Условие на экране компьютера.
К 600 г раствора с массовой долей серной кислоты 12% добавили 200 г воды. Определите массовую долю (в %) кислоты в полученном растворе.
Дано: Решение:
m (р-ра) = 600г
w1 (H2SO4) = 12% 1) ω = 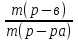 . 100% 2) ω =
. 100% 2) ω = 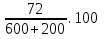 =9%
=9%
m (H2O) = 200г
w2 (H2SO4) - ? 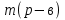 =
= 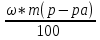
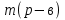 =
= 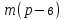 = 72г
= 72г
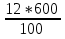
Ответ: ω =9%.
-
Выполнение тестов разных уровней в электронном варианте (оценки за тесты на экране компьютера).
Тесты среднего уровня:
:0 Цвет индикатора изменяется под действием соляной кислоты
00 лакмус синий
10 лакмус красный
00 метилоранж желтеет
00фенолфталеин становится малиновым
:0 Относительная молекулярная масса серной кислоты равна
0025
1098
0082
0064
:0 Какое из веществ при растворении в воде образует кислоту?
00 хлорид калия
00 оксид кремния (IV)
10 оксид фосфора(V)
-
оксид натрия
:0 С каким металлом реагирует разбавленная серная кислота?
00 медь
10 алюминий
00 платина
00 золото
:0 Взаимодействие соляной кислоты с железом относится к реакции:
00 разложения
10 замещения
00 соединения
00 обмена
Тесты высокого уровня:
:0 Какое из перечисленных утверждений неверно?
00 кислоты - сложные вещества, состоящие из атомов водорода и кислотных остатков
00 кислоты изменяют окраску индикатора
00 кислоты взаимодействуют с основаниями
10 кислоты взаимодействуют с кислотными оксидами
:0 Какие пары веществ могут взаимодействовать друг с другом?
00 соляная кислота и азотная кислота
00 серная кислота и оксид серы (IV )
10 серная кислота и гидроксид калия
00 соляная кислота и серная кислота
:0 Взаимодействие соляной кислоты с оксидом меди (II) относится к реакции
00 разложения
00 замещения
00 соединения
10 обмена
:0 Определить массовую долю водорода в серной кислоте
00 1%
10 2%
00 3%
00 4%
:0 Чему равна массовая доля (в %) кислоты, если в 200 г раствора содержится 10 г кислоты
00 10%
10 5%
00 1%
00 0.5%
Вывод: Закончился наш визит к кислотам. Кислота - это активные химические вещества. Им свойственны общие химические свойства. В жизни человека, в природе кислоты имеют огромное значение. Вы узнали о кислотах много интересного, но при дальнейшем изучении химии вы узнаете о них еще больше.
Домашнее задание.