- Учителю
- Модульный подход по теме Подгруппа кислорода (9 класс)
Модульный подход по теме Подгруппа кислорода (9 класс)
Н.В.Гринёва
МОДУЛЬНЫЙ ПОДХОД К
ОРГАНИЗАЦИИ
САМООБРАЗОВА ТЕЛЬНОЙ
РАБОТЫ УЧАЩИХСЯ
МОУ«СОШ №45» Г. САРА ТОВА
ПО ХИМИИ
ТЕМА «ПОДГРУППА КИСЛОРОДА»
Содержание: Введение
-
Методика построения структуры модуля.
-
Название модуля. Подгруппа кислорода:
а) инвариантные элементы модуля.
б) вариативные элементы модуля.
-
Информационное обеспечение (рекомендации учащимся).
-
Образцы решения типовых задач по теме: «Подгруппа кислорода».
-
Методика использования модульной технологии по теме : «Подгруппа кислорода».
6. Список рекомендуемой литературы.
Целью данной работы является определение структуры модуля (на примере темы «Подгруппа кислорода») и установление различного вида связи в нём. В качестве рабочей гипотезы выдвигается тезис о том, что разработанная структура модуля и его реализация в практике содействует совершенствованию учебно-воспитательного процесса и повышает результативность работы учащихся. В работе использовались методы теоретического анализа и синтеза, опытная работа в школе.
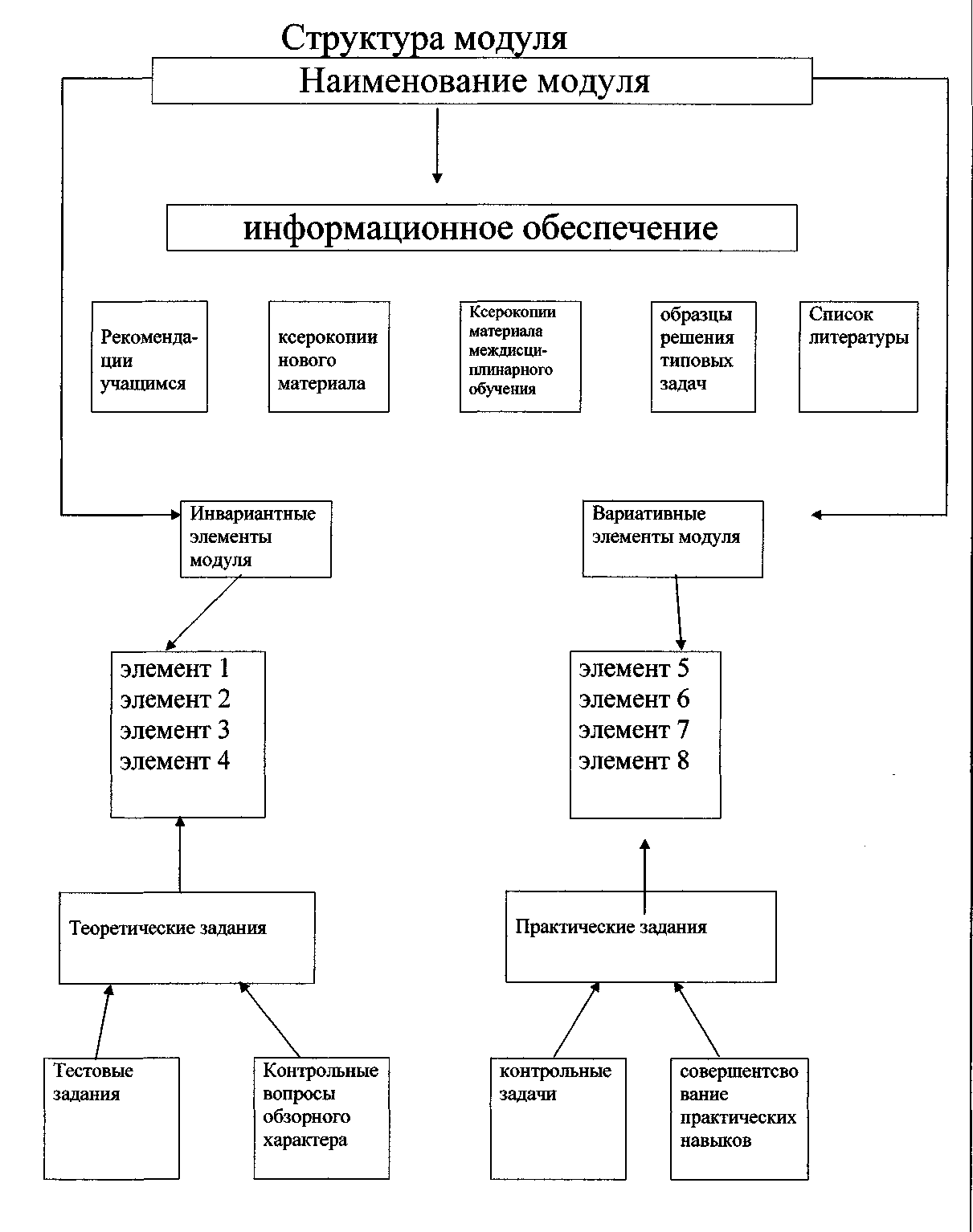
Название модуля. Подгруппа кислорода. Инвариантные элементы модуля.
Элемент 1. Положение элементов подгруппы кислорода в периодической системе
элементов, строение их атомов. Элемент 2. Строение простых веществ. Аллотропия.
Элемент 3. Химические свойства элементов подгруппы кислорода
(на примере кислорода и серы) Элемент 4. Химические свойства водного раствора серной кислоты.
Вариативные элементы модуля.
Элемент 5. Радиус атомов элементов подгруппы кислорода.
Элемент 6. Аллотропия серы и кислорода. Элемент 7. Окислительно-восстановительные свойства элементов подгруппы кислорода. Элемент 8. Физические и химические свойства концентрированной серной кислоты.
Информационное обеспечение
Рекомендации учащимся.
Элементы главной подгруппы VI группы -кислород, сера, селен, теллур и полоний. Наружный энергетический уровень имеет конфигурацию nS2np4. Если кислород в соединениях проявляет только степень окисления -2 [кроме (ОF2 пероксидов (Na202)], то остальные элементы не только -2, но +4, +6. Это объясняется наличием у них вакансий d-орбиталей.
Радиус атомов элементов главной подгруппы VI группы увеличиваются от кислорода к теллуру, соответственно окислительные свойства ослабевают и усиливаются восстановительные . Элементы этой подгруппы образуют водородные соединения Н2Э, полярность которых ослабевает от Н2Ок Н2Те.
H.S является типичным восстановителем. В кислородных соединениях элементы имеют степень окисления +4 (S02) и +6 (S03)
+4 соответствует
S02 ►H2SO3
кислотный оксид сернистая кислота,
слабая кислота
+6 соответствует
SO3, ►H2SO4
кислотный оксид серная кислота,
сильная кислота
Серная кислота двухосновная, образует соли: сульфаты (средние) и гидросульфаты (кислые) 2NaOH + H2S04 = Na2S04 + 2Н20
сульфат натрия
NaOH +Н2SO4 =NaHS04 + H2O
гидросульфат натрия
Разбавленная серная кислота взаимодействует с металлами, стоящими в электрохимическом ряду напряжений до водорода
Zn° + H2S04Pa36= Zn2S04 + Н°2|
сульфат цинка
Восстановителем в этой реакции является цинк, окислителем ионы
водорода Н+ концентрированная серная кислота при нагревании
взаимодействует со многими  металлами,
расположенными в электрохимическом ряду напряжений как до водорода,
так и после водорода.
металлами,
расположенными в электрохимическом ряду напряжений как до водорода,
так и после водорода.
C u° + 2
H2+6SO4
►Cu+2SO4 + SO2 + 2Н20
u° + 2
H2+6SO4
►Cu+2SO4 + SO2 + 2Н20
-2е +2
1 Cu° z- ►Сu - восстановителЬ
+6 +2 е +4
1 S ► S - окислитель
Окислителем в этой реакции является атом серы S.
Кислород (O2)
В природе: самый распространенный элемент
земной коры.
Получение: в промышленности
1. Перегонка жидкого воздуха, т.к. Т.кип 02= - 183° С, а Т kип N2 - -195,8° С 2. Электролиз воды 2Н2О = 2H2 + О2 В лаборатории - разложением (при нагревании)
-
П
 ерманганата
калия 2КМп04 = К2МnО4 +
Мп02 + 02
ерманганата
калия 2КМп04 = К2МnО4 +
Мп02 + 02
-
Бертолевой соли без катализатора 4КС10з = КС1 + 3КС104 - при температуре
п лавления
КС104 = КС1 + 202 - при более высокой
лавления
КС104 = КС1 + 202 - при более высокой
температуре Свойства:
Физические: в реакциях с элементами всегда окислитель
Химические: бесцветный газ, без запаха,
Ткип= -183° С, тяжелее воздуха, в 1 л Н20
растворяется 0,04г 02
С неметаллами С металлами
S + 02= SO2. 2Mg + 02 = 2MgO
С + 02=С02 3Fe + 202 = Fe304
(сгорают) А1, Сг - тонкая
2Н2 +02 =2Н20 защитная пленка
(взрыв) оксида
Со сложными веществами
при сгорании в избытке кислорода образуются
оксиды соответствующих элементов
2H2S + 302 = 2S02+ 2Н20
СН4 + 202 = СО2+2Н20
При недостатке 02 - сажа (С), СО... 4FeS2 + 11 О2 = 2Fe203 + 8S02
пирит
Применение 02 основано на его использовании как окислителя: для обжига руд (например FeS2), в металлургии при производстве стали, горения Н2 + 02 - при резке металлов. В природе с участием 02 совершается дыхание - один из важнейших жизненных процессов. Окисление кислородом углеводов, жиров и белков служит источником энергии живых организмов.
Сера (S)
Твердое кристаллическое вещество желтого цвета. В природе : самородная сера, сульфиды -FeS2 пирит, FeS; сульфаты CaSO4 *2H2O
-
2H2S + 02= 2S + 2H2O
-
S02+C = S+C02
Химические свойства: 1. окислитель Fe + S= FeS
2. восстановитель S + 02= S02
S (+6)
SQ3 Получение:
(+6)
SQ3 Получение:
-
4 FeS2 + 11O2 = 2 Fe2 Оз + 8 SO2.
-
2S02 + 02= 2S03 + 02
H2S+6O4- водоотнимающие свойства
конц.
C12H22011 + nH2SO4= 12C+H2S04 • nН2О
обугливание
окислительные свойства
S +
2H2S04=3S02+2H20
+
2H2S04=3S02+2H20
С и +
2H2S04 = CuS04 + S02 +
2Н2О
и +
2H2S04 = CuS04 + S02 +
2Н2О
Zn + H2S04-► соль + Н2О + S02 (или S или H2S)
Водный раствор H2SQ4 - как обычная кислота
окислитель Н+
с
 оли
оли
сульфаты гидросульфаты
Качественная реакция
2+ 2-
Ва + S04 = Ba S04белый осадок, Нерастворимый в кислотах.
+4
S (SO2) газ с резким запахом, кислотный оксид. Получение:
1. S + 02 = S02
(SO2) газ с резким запахом, кислотный оксид. Получение:
1. S + 02 = S02
Na2SO3 + H2S04 = Na2S04 +S02 + Н2О
-
4
 FeS2
+ 1102 = 2Fe203 +
8S02 Химические свойства как кислотного оксида
SO2+Са(ОН) 2 = CaSO3 +
Н20
FeS2
+ 1102 = 2Fe203 +
8S02 Химические свойства как кислотного оксида
SO2+Са(ОН) 2 = CaSO3 +
Н20
SO2+ H2О = H2SO3 сернистая кислота
Соли сернистой кислоты: сульфиты,
гидросульфиты
S02 - восстановитель
S02+ Bn + 2Н 2О = H2S04 + 2НВг
S02 - окислитель
S02 + 2H2S=3S+2H20
S-2(H2S)
Получение: 1. Н2 + S-► H2S
2. FeS + 2НС1 =FeCL2 + H2S  Химические
свойства: Водный раствор H2S -слабая кислота
Химические
свойства: Водный раствор H2S -слабая кислота
с оли
оли
С ульфиты
гидросульфиты
ульфиты
гидросульфиты
Качественная реакция:
2+ 2-
Рb+ S = РbS |черного цвета H2S - восстановитель 2H2S + 02 = 2S +2H2O
2 H2S + H2SO3 = 3 H2O + 3S
Образцы решения типовых задач
по теме «Подгруппа кислорода»
Задача Вычислите объем оксида сера (IV)
который можно получить при сжигании серы в
5л воздуха (Н.у.) Примите объёмную долю
кислорода в воздухе равную 20%
Решение
l)S+02 -SO2
1л 1л (закон объемных отношений)
-
5л в . 22% - 1л (02) или 5л • 0.2 = 1л (02) 100%
-
V (SO.) = V(02) = 1 л
З адача
Сколько оксида сера (IV) можно получить из 40г серного колчедана,
содержащего 40% примесей Решение
адача
Сколько оксида сера (IV) можно получить из 40г серного колчедана,
содержащего 40% примесей Решение
1) 4FeS2 + 1 lO2-2Fe203 + 8S02
4 моль 8 моль
М= 120 г/моль Vm = 22,4 л/моль
М= 64 г/моль
-
m • FeS2 = 40г • 0,6 = 24г
-
v FeS2 = m = 24r = 0,2 моль
М 120г/моль
-
v FeS2 = 4 vS02 8
-
V SO2 = vFeS, • 8 = О,?. -Я = 0,4 моль
4 4
-
v (SO2) = vm • v = 22,4 л/моль • 0,4 моль = 8,96 л
-
m(S02) = М • v = 64 г/моль • 0,4 моль = 25, 8 г
Задача. К раствору, содержащему 10 г. NaOH, прилили 30 г. 30%-ного раствора серной кислоты. Какая соль и сколько ее образовалось?
Решение
1) 2NaOH + H2S04=Na2S04 + 2Н2О
2 моль 1 моль средняя соль
1 моль М=40г/моль М=98г/моль М=142г/моль
2) NaOH + H2S04-+NaHS04 +2 Н2О
1 моль 1моль кислая соль
1 моль
-
V NaOH = m/M = 10г/40г/моль = 0,25 моль
-
m H.S04 - m р-ра-W - 30г-0,3 = 9г
-
V H2S04 = m/M = 9г/ 98г/моль = 0,09 моль
-
По условию задачи:
-
NaOH 0,25 1 .е гидроксид натрия взят в
-
H2S04 0,09 избытке следовательно образуется
средняя соль.
-
V Na2S04 = V H2S04 = 0,09 моль
-
V Na2SО4 = M-V - 142г/моль-0,09моль = 12,78г.
Задача Какова массовая доля FeSО4 в растворе, полученном растворением 27,8г FeS04*7H20 в 50 мл воды?
Решение
1) w FeSO4 - m FeSO4
mp-pa (m FeS047H20+m H2O)
2) FeSO4-7H2O FeSO4
1 моль 1 моль
М=278г/моль M= 152г/моль
-
V FeSО4-7Н2О=т/М=27,8г/278г/моль=0,1 моль
-
V FeS04=V FeSO4-7H2O=0,l моль
-
V FeS04=М*V=2г/моль-0,1 моль=15,2г
-
wFeS04 =15,2г/27,8г+50г=15,2/77,8=0,1953 или 19,53%
Задача Какая масса SO3потребуется для перевода 50г 95,5%-ного раствора серной кислоты в безводную.
Решение
1) SO3 + H20-H2S04
1 моль 1 моль М=80г/моль М= 18г/моль
-
m H2S04=m р-ра*w=50г*0,955=47,5г
-
m Н2О= m р-ра - m H2SO4=50 г - 47,75г=2,25г
-
V Н2О= m /М=2,25г/18г/моль=0,125 моль
-
V SO3 = V Н2О = 0,125 моль
-
m SO3 = M*V = 80г/моль*0,125моль = 10Г
Инвариантные элементы модуля Элемент 1. Положение элементов подгруппы кислорода в периодической системе элементов; строение их атомов.
-
Положение элементов главной подгруппы VI группы в периодической системе Д.И. Менделеева.
-
Строение атомов кислорода и серы.
-
Состав (общая формула) водородных соединений, образованных кислородом и серой:
а) тип химической связи в молекулах воды и
сероводорода;
б) почему вода - жидкость, а сероводород -
газ?
4. Состав (формула) оксидов серы,
характеристика их кислотно-основных свойств.
Элемент 2 Строение простых веществ. Аллотропия.
-
Что называется аллотропией?
-
Причина аллотропии кислорода?
-
Причина аллотропии серы?
-
Какие еще аллотропные соединения вы знаете?
-
Запишите термохимическое уравнение превращение кислорода в озон.
-
Дайте сравнительную характеристику некоторых физических свойств кислорода и озона.
-
Назовите аллотропные видоизменения серы.
-
Охарактеризуйте строение устойчивой модификации серы.
Элемент 3. Химические свойства элементов подгруппы кислорода (на примере кислорода и серы).
-
От чего зависят свойства вещества?
-
Докажите, что кислород - окислитель (напишите уравнение химических реакций).
-
Докажите, что сера проявляет свойства восстановителя и окислителя (приведите уравнения реакций).
-
Напишите уравнения реакций, подтверждающих общие химические свойства простых веществ - кислорода и серы.
-
Напишите уравнения реакций, подтверждающих различия в свойствах простых веществ - кислорода и серы.
-
Составьте электронный баланс к уравнениям реакций, в 4, 5 вопросах.
-
Какие уравнения называются термохимическими?
-
Каков тип химической связи в соединениях серы с кислородом и кислорода с водородом?
Элемент 4. Химические свойства водного раствора серной кислоты.
-
Физические свойства серной кислоты.
-
Ступенчатая диссоциация водного раствора серной кислоты. Отношение водного раствора серной кислоты к индикаторам.
-
Отношение водного раствора серной кислоты к металлам: цинку, меди.
-
Отношение водного раствора серной кислоты к основным оксидам: оксиду меди (II).
-
Реакция нейтрализации раствора серной кислоты раствором щелочи. Образование кислых и нормальных солей. Взаимодействие раствора серной кислоты с трудно растворимыми основаниями - гидроксидом меди (II), гидроксидом цинка.
-
Отношение водного раствора серной кислоты к солям: карбонату натрия, нитрату бария.
-
Приведенные в п. 3-6 уравнения реакций представить в ионной форме.
-
Назовите окислитель в реакции Zn+H2S04(p-P) -►? + ?.
Вариативные элементы модуля.
Элемент 5. Радиус атомов элементов подгруппы
кислорода.
-
Как с увеличением радиуса атома изменяются неметаллические свойства элементов подгруппы кислорода?
-
Как изменяется электроотрицательность элементов подгруппы кислорода?
-
Каков характер высших оксидов элементов подгруппы кислорода?
-
Как доказать, что водный раствор оксида серы (VI) имеет кислотный характер?
-
Зная строение атомов кислорода, серы и селена, оцените какое соединение (Н2О,H2S,H2Se)является более полярным почему?
-
Какие степени окисления могут проявлять элементы подгруппы кислорода? Какими особенностями обладает кислород?
-
В подгруппе кислорода с увеличением заряда ядра усиливаются восстановительные свойства. Почему?
Элемент 6. Аллотропия серы и кислорода. 1.К каким явлениям - физическим или химическим - следует отнести:
а) образование элементом нескольких простых
веществ;
б) переход одного аллотропного
видоизменения в другое?
-
Одна из модификаций серы представлена ромбическими кристаллами лимонно-желтого цвета. Если кристаллы расплавить, массу довести почти до кипения, после чего вылить в холодную, то образуется пластическая, похожая на резину, масса. При нагревании серы с порошком железа образуется однородная масса, при охлаждении превращающаяся в сульфид железа. Какой из этих процессов является физическим, а какой химическим и почему? Имеет ли место явление аллотропии?
-
Причины многообразия простых веществ?
Элемент 7. Окислительно-восстановительные свойства элементов подгруппы кислорода.
-
Причина инертности серы при обычной температуре.
-
От чего зависит скорость реакций взаимодействия кислорода с простыми и сложными веществами.
-
Напишите формулы соединений кислорода, в которых он имеет степени окисления -2,+2,-1.
-
Напишите формулы соединений серы, в которых она имеет степени окисления -2,+4,+6
-
Объясните причину окислительно-восстановительной двойственности серы.
-
Сероводородная вода при хранении мутнеет. Почему? Является ли это помутнение сероводородной воды окислительно-восстановительной реакцией?
-
Составьте уравнения реакций взаимодействия серы с кислородом, водородом, металлами. Составьте электронный баланс к уравнениям реакций.
Элемент 8. Физические и химические свойства концентрированной серной кислоты.
-
Физические свойства концентрированной серной кислоты.
-
Охарактеризуйте, приведя соответствующие уравнения, химические свойства концентрированной серной кислоты.
-
Приведите уравнения реакций, в которых водный раствор и концентрированная серная кислота - окислители.
-
Назовите окислитель в разбавленной и в концентрированной серной кислотах. Составьте электронный баланс и подберите стехиометрические коэффициенты в приводимых уравнениях реакций.
-
В трёх пробирках без этикеток находятся растворы хлорида натрия, хлорида бария и сульфата натрия. Докажите, в какой пробирке какое вещество находится и напишите уравнения реакций.
-
Предложите способы качественного обнаружения раствора серной кислоты. Напишите соответствующие уравнения химических реакций.
-
Напишите уравнения следующих превращений (с участием конкретных веществ):
О -2 +4 +6 -2
S^S^S^S^SO4
Назовите полученные вещества.
Список рекомендуемой литературы. Г.П. Хомченко «Пособие по химии для поступающих в ВУЗы» М. : «Просвещение», 1986г.
Г.А. Немчанинова «Путешествие по VI группе» Пособие для учащихся. М. : «Просвещение», 1986г.
В.В. Сорокин, Э.Г. Злотников «Как ты знаешь
химию?»
Л. : Химия 1987г.
(Научно-популярная библиотека школьника)
Ф.Г. Фельдман, Г.Е. Рудзитис Химия 9 класс учебник для 9 класса средних общеобразовательных учебных заведений Москва: «Просвещение» 1994г.
Зуева М.В., Гара Н.Н., Контрольные и проверочные работы по химии 8-9 кл.: Методическое пособие.-М.:Дрофа,1997
Владимирова А.П., Сиванова О.В., Алексеенко О.В., Ринёва Н.Б. Методическое пособие для учителей образовательных учреждений всех типов.
Сорокин В.В., Э.Г.Зоолотников Как ты знаешь химию?- Л.:Химия,1987 г.
Гаврусейко Н.П. Проверочные работы по неорганической химии: Дидактический материал.; Пособие для учителя.-М.:Просвещение,1990