- Учителю
- Урок по химии с использованием презентации по теме Понятие о валентности и химической связи. Ковалентная химическая связь.
Урок по химии с использованием презентации по теме Понятие о валентности и химической связи. Ковалентная химическая связь.
Урок по химии с использованием презентации
по теме "Понятие о валентности и химической связи. Ковалентная химическая связь".
Тип урока: урок-лекция, беседа.
Цель урока: научить учащихся составлять электронные и структурные формулы молекул с ковалентной связью.
Задачи урока: сформировать у учащихся представление о валентности и валентных электронах, о химической связи. Рассмотреть разновидность химической связи - ковалентную связь, механизм ее образования.
Оборудование: компьютер, интерактивная доска, мультимедийный проектор, периодическая система химических элементов Д. И. Менделеева.
План урока
-
Организационный момент.
-
Изучение нового материала (с использованием презентации).
-
Изучение состава и строения веществ - одна из задач химии.
-
Примеры молекул различных веществ.
-
Что такое химическая связь и почему атомы соединяются в молекулы?
-
Что такое валентность и какова роль валентных электронов в образовании химической связи?
-
Ковалентная связь, механизм ее образования.
-
Электронные (формулы Льюиса) и структурные формулы молекул хлора, азота, хлороводорода.
-
Основные выводы урока.
-
-
Домашнее задание: ……….
Конспект урока
Слайд 1
Вспомним, что одной из задач химии как науки является изучение состава и строения веществ. Мы уже с вами знаем, что вещества состоят из молекул, которые могут состоять из 2, 3, 4 и большего числа атомов.
Слайд 2 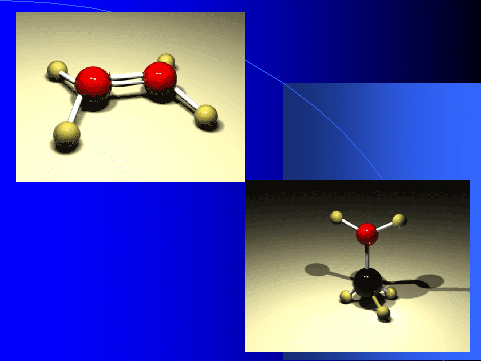
Слайд 3 
Лишь благородные газы существуют в одноатомном состоянии, их атомы не соединяются друг с другом. Но почему? Они имеют завершенный, восьмиэлектронный внешний энергетический уровень. Такое состояние называется устойчивым.
Слайд 4 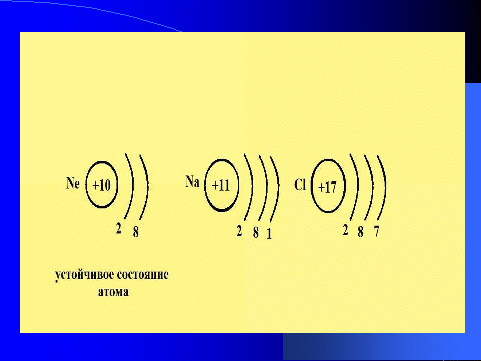
Атомы других элементов стремятся перейти в устойчивое состояние, взаимодействуя между собой. При взаимодействии атомов между ними возникает химическая связь.
Слайд 5 
В образовании химической связи принимают участие только валентные электроны. Они расположены на внешнем энергетическом уровне у элементов главной подгруппы. Рассмотрим валентности некоторых элементов.
Слайд 6 
Химическая связь образуется за счет электронов внешнего энергетического уровня, но осуществляется она по-разному. Различают три основных типа химической связи:
-
Ковалентную;
-
Ионную;
-
металлическую.
Сегодня познакомимся с ковалентной связью. В слове "ковалентная" приставка "ко" означает "совместное участие", "валента" в переводе на русский - сила, способность. В данном случае имеется в виду способность атомов связываться с другими атомами.
Слайд 7
Ковалентная связь - это химическая связь между атомами, осуществляемая с помощью общих электронных пар. Ковалентная связь существует в молекулах, образованных атомами неметаллов.
В 1916г. американский ученый Джильбер Льюис разработал теорию ковалентной связи, согласно которой атомы приобретают устойчивое состояние путем образования одной или нескольких общих электронных пар между взаимодействующими атомами.
Слайд 8 
Рассмотрим образование ковалентной связи в молекуле Cl2.
Сначала составим электронную схему, затем электронную и электронно-графическую формулы для атома хлора (используя возможности интерактивной доски).
Слайд 9 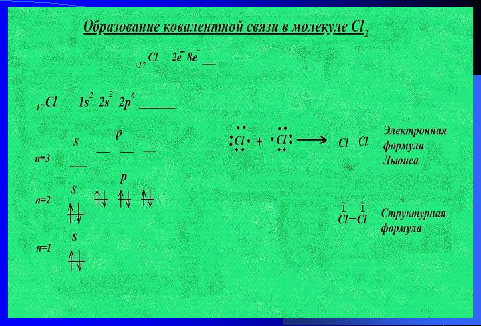
Обратим внимание на число валентных электронов. Льюис предложил обозначать валентные электроны точками рядом с символом элемента. Одна точка обозначает один электрон. У каждого атома хлора, составляющего молекулу хлора, по семь валентных электронов, из которых один является неспаренным. Именно за счет этих неспаренных электронов образуется общая электронная пара. И как предложил Льюис, именно пара электронов позволяет образовать ковалентную связь.
Рассмотрим образование ковалентной связи в молекуле
N2 (используя возможности интерактивной доски).

Слайд 10
Рассмотрим образование ковалентной связи в молекуле HCl (используя возможности интерактивной доски).
Слайд 11 
Рассмотрев образование ковалентной связи в различных молекулах, можем сделать следующие выводы.
Слайд 12 