- Учителю
- Опорный конспект Классификация веществ
Опорный конспект Классификация веществ
Таблица по классификации неорганических веществ
Простые вещества
Это вещества, молекула которых состоит из 1 (одного) химического элемента
Сложные вещества
Это вещества, молекула которых состоит из нескольких химических элементов
Металлы
Ме
Это элементы, у которых на
последнем энергетическом
уровне от 1 до 3 электронов
и они стремятся их отдать.
Металлы твердые, блестя-
щие, тепло- и электропро-водны.
Мео - е = Ме+
Амфотерные
А
это элементы,
которые проявляют двойственные свайства металлов (Ме) и неметаллов (неМет)
Неметаллы
неМе
Это элементы, у которыхна последнем энергетическом уровне от 4 до 8 элнктронов
и они стремятся еше принять
электроны до 8.
НеМе могут быть ГАЗАМИ -
N2,'O2', F2, H2, Cl2, Br2, I2
ТВЕРДЫМИ - C, Si, P, Fs, S, Se, Te
неМе0 + е = неМе-
неМе0 - е = неМе+
Оксиды
это сложные вещества, молекула которых состоит из двух элементов, один из которых кислород.
ЭО-2
Основания
это сложные вещества, молекула которых состоит из атомов металла и гидроксильной группы ОН.
МеОН-1
Кислоты
это сложные вещества, молекула которых состоит из атома водорода и кислотного остатка
НХ
Соли
это сложные веще
ства , молекула ко-
торых состоит из
атомов металла и кислотного остатка
МеХ
Щелочные Ме
Li, Na, K, Pb, Cs (+1)
Исключения
l А - Н - 1е
1. Основные оксиды - это оксиды металлов, которые при взаимодействии с водой дают основания
МеО-2
/ ׀ \
Щ ЩЗ d-Ме
1.Щелочь
Это растворимые в воде основания, молекулы которых состоят из атомов щелочного или щёлочно-земельного металла и гидроксильной группы ОН
HNO3 азотная
HF плавиковая
HCl соляная
HBr
бромоводородная
HJ иодоводородная
H2Sсероводородная
H2SO3 сернистая
H2SO4 серная
H2CO3 угольная
H2SiO3
кремниевая
H3PO4 фосфорная
MeNO3 нитрат
MeF фторид
MeCl хлорид
MeBr бромид
MeJ иодид
MeS сульфид
MeSO3 сульфит
MeSO4 сульфат
MeCO3 карбонат
MeSiO3 силикат
МеPO4 фосфат
Щелочноземельные
Ca, Sr, Ba(*2)
lll A - B - 3е
Be
Zn
Al
lV A- Подгруппа
углерода
C, Si
{ -4, +2, +4 }
d-Me
(синие), Ме побочных подгрупп
Cr, Mn, Fe, Co, Ni, Cu, Au, Ag)
2. Амфотерные оксиды (АО) - это оксиды амфотеных эле-иентов (Al, Be, Zn)
которым соответствуют
как основание, так и кислота
2. Амфотерные основания - это основания с двойными свойствами - со свойствами нерастворимого основания и кислоты
АОН
V A - Пниктогены
N, P, As
{ -3, +3, +5 }
Me - исключения
(желтые) ниже границы
Sn, Pb,
Вi,
Po
Vl A- Халькогены
O, S, Se, Te
{ -2, +4, +6 }
3. Кислотные оксиды - это оксиды неметаллов, которые при взаимодействии с водой дают кислоту
(неМе lV V Vl О-2)
3. Нерастворимые основания - это основания, которые в воде не растворяются, а их молекула
состоит из атома де металла и гидроксильной группыОН
dMeOH-1,
Vll A - Галогены
F, Cl, Br, I
{ -1, +5, +7 }
VlllA - Инертные газы
Не, Ne, Ar, Kr, Xe, Rn
Классификация органических веществУглеводороды - С и Н
предельные
непредельные
ароматические
Алканы
CnH2n+2
![]()
все связи простые

- АН
Циклоалканы
СnH2n
![]()
все связи простые, скелет замкнут в цикл


ЦИКЛО….АН
Алкены
СnH2n
С=С
одна двойная связь

- ЕН
Алкадиены
СnH2n-2
С=С=С
две двойные связи

- ДИЕН
Алкины
СnH2n-2
![]()
одна тройная связь

- ИН
Арены
СnH2n-6
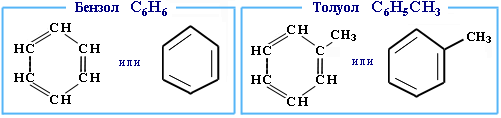
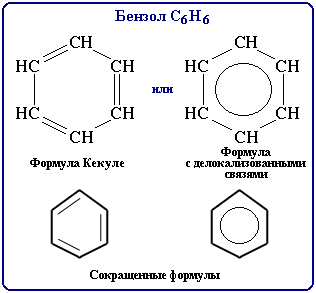
бензольное кольцо
БЕНЗОЛ
Кислородсодержащие - С,Н и О
Спирты
R-OH
гидроксильная группа

- ОЛ
Альдегиды
![]()
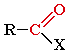
карбонильная группа

- АЛЬ
Кетоны
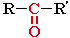
карбонильная группа

- ОН
Карбоновые кислоты
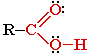
карбоксильная группа

- ОВАЯ КИСЛОТА
Эфиры
1 Простые
R - O - R
кислородный мостик
-ОВЫЙ ЭФИР
2 Сложные
 R
R
Углеводы
1. Моносахариды
2. Дисахариды
3. Полисахариды
Азотсодержащие - С, Н и N
Амины
R - NH2
Аминогруппа


- ИЛАМИН
Аминокислоты

NH2 ---
Аминогруппа Карбоксильная

 группа
группа
АМИНО………ОВАЯ КИСЛОТА
Гетероциклы