- Учителю
- Конспект урока Алюминий и его соединения
Конспект урока Алюминий и его соединения
Тема урока: «Алюминий и его соединения» 9 кл
Разделы: Химия
Пояснительная записка: данный урок может быть проведён в 9-ом классе, а также и с учащимися 11-го класса при условии корректировки содержания в сторону усложнения по любой авторской программе по химии. Это не первый урок по теме: «Металлы». Ранее по аналогичному плану изучались: щелочные, щелочно-земельные металлы.
Проведение занятия построено на применении методических приёмов технологии проблемного обучения. Учащимся предлагается система разнохарактерных заданий личностно-значимого содержания. Это способствует развитию интеллектуальных и личностных качеств, саморегуляции процесса обучения, способствует повышению мотивации к изучению предмета. Важными аспектами данного занятия являются самоконтроль и самооценка учащихся. Такой подход к обучению позволит каждому ученику выстроить индивидуальную образовательную траекторию, к одному и тому же конечному результату разные ученики могут прийти разными путями.
Урок сопровождается презентацией, содержащей иллюстративный материал и задания для работы учащихся. Предложенная последовательность заданий экономического, исторического содержания с практической направленностью позволяет выявить детей неординарно мыслящих. Работа с информационной моделью химических свойств алюминия, выполнение лабораторного опыта по изучению амфотерности алюминия, вариативность и дифференциация заданий на отработку умений и навыков составления уравнений химических реакций, этимологии понятия амфотерности с привлечением межпредметных связей.
При систематическом использовании технологии проблемного обучения в старших классах у учащихся формируются и вырабатываются следующие умения:
- общеучебные (структурирование информации, умение выделять главное, тренировка внимания и памяти, решение логических и нестандартных задач)
- самоанализ и самооценка
-применение знаний на практике
Представленная форма проведения учебного занятия по изучению нового материала и применению знаний может быть использована как универсальная при построении работы с одарёнными детьми.
Логическая цепочка урока:
-
Мотивация учащихся к изучению темы - включает задания по нахождению сходства в предметах посредством создания проблемной ситуации.
-
Актуализация прежних знаний - индивидуальная работа учащихся в тетрадях с синхронным комментированием записи, осмысление физических параметров алюминия.
-
Усвоение новых понятий и способов действий - работа с информационной моделью химических свойств алюминия; выполнение проблемного опыта по получению гидроксида алюминия и лабораторно опыта по изучению амфотерности алюминия, заданий на нахождение соответствия реагентов и продуктов реакции, этимологии понятия амфотерности с привлечением межпредметных связей; знакомство с природными соединениями алюминия
-
Формирование умений и навыков
-
Рефлексия
-
Подведение итогов урока
Цели и задачи урока:
- образовательная - выявление и оценка степени овладения системой знаний и комплексом навыков и умений об амфотерных элементах и их соединениях на примере алюминия, готовности учащихся успешно применять полученные знания на практике, позволяющие обеспечить обратную связь и оперативную корректировку учебного процесса;
-развивающая - развивать критическое мышление, самостоятельность и способность к рефлексии, обеспечение системности учения;
- воспитательная - воспитание положительной мотивации учения, правильной самооценки и чувства ответственности.
Тип урока: изучение нового материала и применение знаний по теме.
Вид урока: эвристическая беседа в сочетании с экспериментом (элементы технологии проблемного обучения)
Доминирующие методы: эвристический, исследовательский, диалогический.
Оборудование урока: план характеристики элемента, реактивы (алюминиевая проволока, алюминиевая фольга, алюминиевая банка, гранулы алюминия, р-р гидроксида натрия, р-р соляной кислоты,); доска, коллекция «Металлы», CD «Химия» 9 класс, таблица «Периодическая система химических элементов Д.И.Менделеева», компьютер, проектор, экран, презентация, учебник
Раздаточный материал: приложение 1, листки с заданиями по вариантам, лабораторный опыт 1, 2 , физические карты Франции и республика Коми, с отмеченными на них полезными ископаемыми бокситами.
План-конспект урока
I. Мотивация учащихся к изучению темы
Учитель приветствует учащихся
Учитель создаёт проблемную ситуацию, используя приёмы неоконченного предложения и демонстрации объектов с «отсроченной отгадкой».
Этот элемент сразу после его открытия привлек химиков своей красотой и легкостью. Внешне походит на серебро, примерно в три раза легче железа и меди. Он очень пластичен: его можно прокатать в тонкую фольгу, сделать тончайшие украшения, придать нужную форму. Вот только прочность чистого металла невелика, но в виде сплавов с другими металлами он заметно «крепчает». Уже созданы сплавы данного элемента с прочностью в 10 раз выше, чем у стали.
Первоначально из-за несовершенного способа получения был необычайно дорог - почти в 10 раз дороже золота.
Учитель выдаёт пакет документов с различными историческими фактами группе учащихся и предлагает дать субъективную оценку (приложение 1). Группа из 5-6 человек работает самостоятельно.
Остальные учащиеся класса, выполняют задание 1 и 2.
Слайд 1
У:Задание 1. Что объединяет все эти предметы? (алюминиевая фольга на столах у учеников, глиняная ваза на столе у учителя, картинка с алюминиевой посудой на доске)
Учащиеся высказывают свои суждения, учитель не даёт готовый ответ, предлагает выполнить задание 2.
Слайд 2
Задание 2.Решите анаграммы и исключите лишнее
-
Ответ: металл - алюминий, остальные - неметаллы.
Учащиеся, работавшие в группе знакомят класс с представленными материалами и дают свою оценку историческим событиям.
Какова же тема урока? Учащиеся назовут «Алюминий и его соединения»
Слайд 3
А я предлагаю записать тему урокав виде проблемного вопроса«Номер 13: счастливый или нет?»
(Учитель записывает на доске тему урока: «Номер 13: счастливый или нет?»)
Почему же я дала такое название? ( О: порядковый номер алюминия в ПСХЭ - 13, с таким числом связаны суеверия)
Слайд 4
Откуда произошло название элемента?
(Алюмен - в переводе с лат. - квасцы, которые использовали для крашения тканей)
Слайд 5
Что же мы будем изучать сегодня на уроке (особенность строения алюминия, выведем значение ст. ок-я, рассмотриминдивид свойства алюминия, его амфотерность, применение, получение), а что повторим
(положение элемента в периодической системе, строение атома, тип кристаллической решетки, общие физические и химические свойства ме, получение - алюмотермия)? (цели и задачиформулируют учащиеся)

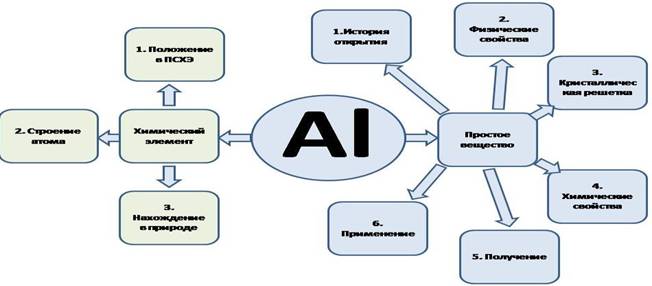
II. Актуализация прежних знаний
Алюминий - химический элемент.
1. Индивидуальная работа учащихся в тетрадях с синхронным комментированием записи.
Задание 3 «ЭЛЕМЕНТАРНОЕ»
Используя план, дайте характеристику элемента с порядковым номером 13 по положению в «Периодической системе химических элементов Д.И. Менделеева».
(Учащиеся выполняют задание).
Вывод запишите в тетрадь.
Устанавливается положение элемента Al в периодической системе;
а) выясняется физический смысл порядкового номера химического элемента (положительный заряд ядра атома), номера периода (число энергетических уровней в атоме) и номера группы (высшая положительная степень окисления атома в соединениях);
Слайд 6, 7
б) с презентации сверяют распределение электронов по энергетическим уровням; далее делается вывод о том, что степень окисления Al в соединениях равна +3 (очень трудно, в жёстких условиях, можно получить неустойчивые соединения Al в степени окисления +1);
в) по степени окисления, т. е. на основании положения в периодической системе, выводится формула оксида - Al2O3 и гидроксида алюминия - Al(OH)3- нерастворимое основание;
г) на основании положения в периодической системе сравнивается радиус атома -радиус атома меньше чем у элементов 1 и 2 группы гл подгруппы, соседство с неметаллами (В, Si), высказывается предположение об амфотерности элемента и его соединений
(встаёт проблема: отразится ли это на свойствах веществ или нет?. Если да- то как? Требуется ее разрешения. Чуть позже мы к ней вернемся);
слайд 8
д) на основании положения в электрохимическом ряду напряжений металлов, учащиеся легко делают вывод о том, что Al должен быть активнее многих широко распространённых металлов (цинка, хрома, железа, никеля, свинца, олова…), но уступает по химической активности металлам IIA группы. Поэтому он должен проявлять высокую химическую активность.
Алюминий применяется в быту, из него изготавливают бытовые изделия. Известно, что ни кислород, ни вода на него не действуют (учитель опускает алюминиевую пластину в стакан с водой). В результате противоречий между знаниями и жизненными наблюдениями создается такая ситуация: почему алюминий, стоящий в начале ряда напряжений проявляет пассивность? Почему в алюминиевой кастрюле можно варить суп?
Жизненный опыт убеждает, что Al во внешней среде устойчив. Почему?
Выясняется причина (кроется в наличии на его поверхности прочной и устойчивой защитной оксидной пленки, которая защищает металл от воздействия воздуха и воды).
Что будет, если эту пленку разрушить? (О: ме станет активным, для разрушения оксидной пленки можно использовать крепкий раствор КОН, но в этом случае образец алюминия переносят из щелочного раствора в воду без промывания или раньше солями ртути-амальгамы)
Учитель: Около 100 лет назад Н. Г. Чернышевский сказал об алюминии, что этому металлу суждено великое будущее, что алюминий - металл социализма. Он оказался провидцем: в XX веке этот элемент стал основой многих конструкционных материалов. Поразительны перемены в стоимости алюминия.
2. Создание проблемной ситуации, через решение экономического вопроса.
Обсуждение происходит в микрогруппах.
Чем объяснить широкий диапазон использования алюминия?
Задание 4 «ЭКОНОМИЧЕСКОЕ»
В 1825 г. алюминий стоил в 1500 раз дороже железа, в наши дни лишь втрое. Сегодня алюминий дороже простой углеродистой стали, но дешевле нержавеющей. Во многих случаях значительно выгоднее применять алюминий, чем сталь. Почему?
Почему же алюминий можно назвать рекордсменом по многим параметрам? ( из-за наличия особых свойств -плотность, пластичность, электропроводность, распространённость в земной коре)
III. Усвоение новых понятий и способов действий
Алюминий - простое вещество.
- История открытия. (Рассказывается на мотивационном этапе, см приложение 1 документ)
Задание:Установите зависимость между строением Al и его физическими свойствами.Все физические характеристики алюминия запишите в тетрадь.
- Физические свойства:
Изучение образцов алюминия (фольга, полоски металла, отрезки проволоки).
Общие физические свойства:
1. агрегатное состояние - тв
2. цвет- с-б
3. металлический блеск- способность кристаллической решетки отражать лучи
4. запах-не имеет
5. пластичность -смещение пластов кристаллической решетки; электроны выполняют цементирующие свойства
6. электропроводность - направленное движение свободных электронов
7. теплопроводность;
8. растворимость в воде - после снятия оксидной пленки реагирует с водой при обычных условиях (алюминий - активный металл)
Слайд 9
9. Кристаллическая решётка Al.
Металлическая. НО! (Она подобна кубу с плотноупакованными шарами.Это металлическая кубическая гранецентрированная решётка). В узлах решётки находятся ионы, а в промежутках между ними легкоподвижные электроны. Веществам с металлической кристаллической решёткой присуща металлическая связь.
Индивидуальные физические свойства:
10. плотность 2,698 г/см3 - легкий, т.к. плотность не более 5 г/см3
11. температура плавления 660,4 °С -различие в температуре плавления объясняется различием прочности химической связи
12. температура кипения 2466,9 °С
</ 13 по тепло и электропроводности занимает 4 место после золота, серебра, меди
- Химические свойства:
1. Индивидуальная работа учащихся с информационной схемой.
Слайд 10
Al → [+ простые вещества (неМе)]: + O2, + Г2, S
Al → [+ сложные вещества]: + H2O, + кислота, +щёлочь, + соль, + МеО.
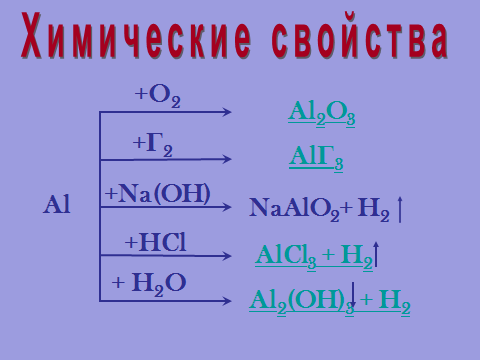
Вопрос: Какое свойство в этой схеме характерно для алюминия в отличие от металлов? (Взаимодействие со щёлочью).
2. Лабораторный опыт 1: (работа в парах)
В подтверждение химических свойств алюминия выполнение лабораторного опыта: взаимодействие алюминия с кислотой и щёлочью, обнаружение выделяющегося водорода.
Инструктаж по технике безопасности (приложение 2)
Проблемный вопрос к лабораторному опыту: математики утверждают, что от перестановки мест слагаемых сумма не меняется. А вот химики считают, что это не всегда справедливо. Убедитесь в этом, меняя порядок приливания растворов: сульфата алюминия и гидроксида натрия.
Получите Al(OH)3, запишите уравнение реакции. Инструктаж по технике безопасности.
Вопросы к опытам:
-
Какие общие свойства у алюминия с другими металлами?
-
Назовите специфические свойства алюминия.
-
В какой последовательности необходимо приливать растворы, чтобы выпал осадок? (К раствору сульфата алюминия прилейте по каплям раствор гидроксида натрия).
-
Что такое амфотерность? (определение, «амфос» - в переводе с греческого означает « и с тем и с другими»)
-
В каких науках вы встречались со схожими терминами? (амфибия - земноводное, ведущее двойной образ жизни - на суше и в воде, это же и вид транспорта; амфора - сосуд совмещающий кувшин и вазу; амфитеатр - арена и зрительный зал).
IV. Формирование умений и навыков
1. Выполнение задания на листках (1 вариант)
Установите соответствие между реагентами и продуктами химической реакции.
1. Al + O2 А AlСl3 + H2
2. Al + H2O Б AlСl3
3. Al + Сl2 В AlСl3 + H2O
4. Al + HСl Г AlСl3 + Hg
5. Al + NaOH Д AlСl3+ HgСl2
6. Al + HgСl2 Е NaAlO2 + H2
7. Al + Fе3О4 Ж Al(OH)3 + H2
З Al(OH)3 + Na
И Al2O3 + Fе
К Al2O3
2. Выполнение задания на листках (2 вариант)
Расставьте пропущенные коэффициенты.
4Al + O2 = Al2O3
Al + 3Сl2 = AlСl3
2Al + S = Al2S3
2Al + 6H2O = Al(OH)3 + H2
2Al + HСl = 2AlСl3 + H2
Al + 2NaOH = 2NaAlO2 + H2
Al + HgСl2 = 2AlСl3 + 3Hg
Слайд 11 (поменяться вариантами)
Ответы для самопроверки:
Вариант 1
1 2 3 4 5 6 7
к ж б а е д и
Вариант 2
4Al + 3O2 = 2Al2O3
2Al + 3Сl2 = 2AlСl3
2Al + 3S = Al2S3
2Al + 6H2O = 2Al(OH)3 + 3H2
2Al + 6HСl = 2AlСl3 + 3H2
2Al + 2NaOH = 2NaAlO2 + H2
2Al + 3HgСl2 = 2AlСl3 + 3Hg
3. Выполнение дифференцированных заданий повышенной сложности (по желанию)
ЧАСТЬ А. Закончите следующие уравнения химических реакций, назовите продукты:
Al + Br2 =
Al + H2SO4(р-р) =
Al + NaOH =
ЧАСТЬ В. Осуществите превращения, назовите продукты:
А) Al → Al2O3 → AlCl3
Б) Al → AlCl3→ Al2(SO4)3
Слайд 12
Проверка результатов проводится сразу же после выполнения заданий по готовым ответам на доске.
ЧАСТЬА
2Al + 3Br2 = 2AlBr3
2Al + 3H2SO4(р-р) = Al2(SO4)3 + 3H2
2Al + 2NaOH = 2NaAlO2 + H2
ЧАСТЬВ
А) 4Al + 3O2 = 2Al2O3
Al2O3+ 6HСl = 2AlCl3 + 3H2O
Б) 2Al + 6HСl = 2AlCl3+ 3H2
2AlCl3 + 3H2SO4 = Al2(SO4)3 + 6HCl
Слайд 13
Критерии оценивания:
6-7 верных уравнений «зачёт на 5»;
4-5 верных уравнений «зачёт на 4»;
3 верных уравнения «зачёт на 3»;
менее 3 верных уравнений «незачёт».
Учащиеся делают общий вывод: перевести алюминий в состав катиона можно, подействовав раствором кислоты, а в состав аниона - раствором щёлочи.
Слайд 14, 15
В земной коре алюминия очень много; 7-8,8 % по массе. Он занимает первое место среди всех металлов и третье среди других элементов. Алюминия в двое больше, чем железа, и в 350 раз больше, чем меди, цинка, хрома, олова и свинца вместе взятых.
Как писал в своём классическом учебнике Основы химии Д. И. Менделеев, из всех металлов " алюминий есть самый распространённый в природе: достаточно указать на то, что он входит в состав глины, чтоб ясно было всеобщее распространение алюминия в земной коре..."
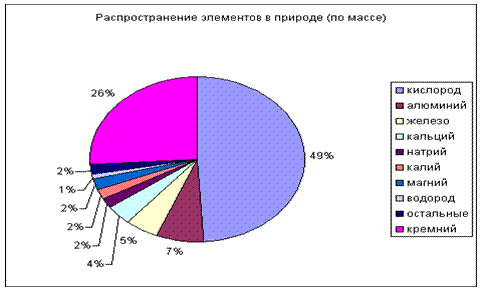
Слайд 16- 21
4. Давайте познакомимся с природными соединения алюминия - корунд,
Слайд 22-24
рубин, сапфир, а также их производные - лазурит, лунный камень, аквамарин, бирюза
слайд 25
Важнейший минерал алюминия - боксит, смесь основного оксида алюминия Al2O3 и гидроксида Al(OH)3. Крупнейшие месторождения боксита находятся в Австралии, Бразилии, Гвинее. Богат алюминием и нефелин. Известно 250 минералов, в состав которых входит алюминий, большинство из них алюмосиликаты. Это глина, полевые шпаты, многие полудрагоценные камни: гранат, александрит.
Корону Российской империи украшает драгоценная шпинель, в состав которой входит алюминий.
5. Получение (см учебник)
Современный метод получения был разработан независимо американцем Чарльзом Холлом и французом Полем Эру. Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF6 с последующим электролизом с использованием графитовых электродов. Такой метод получения требует больших затрат электроэнергии, и поэтому оказался востребован только в XX веке.
Для производства 1 т алюминия требуется 1,9 т глинозёма и 18 тыс. кВт·ч электроэнергии
Слайд 26-32
Применение.
Заполнение таблицы «Применение алюминия» (работа с учебником или с презентацией)
V. Рефлексия
Слайд 33
Задание: Убери лишнее о металлах
Учащиеся записывают ответы на вопросы:
Что узнали нового?
Пригодится ли вам это в жизни?
Какую оценку вы себе поставили?
Проблемный вопрос:
№ 13 Счастливый или несчастливый?!Слайд 34 стих
VI. Подведение итогов урока
Комментированное выставление оценок.
Домашнее задание:
-составьте текст рекламы изделий из алюминия;
-составьте самостоятельно цепочку из 4-х превращений с участием алюминия и его соединений.
-ответить на вопросы, записанные в тетради.
Вопросы (дать химическое объяснение данному явлению):
-Можно ли алюминиевые изделия ремонтировать медными заклёпками?
-Что произойдёт, если раствор медного купороса (CuSO4) оставить в алюминиевой посуде?
-Почему влажная кальцинированная сода (Na2CO3), нанесённая на алюминиевый предмет, хорошо его очищает?
Приложение 1
Пакет документов.
Документ №1
Книга «Занимательная химия»
Существует легенда о том, как к римскому императору Тиберию пришёл незнакомец. В дар императору он принёс изготовленную им чашу из блестящего как серебро, но чрезвычайно лёгкого металла. Мастер поведал, что получил этот металл из «глинистой земли». Но император, боясь, что обесценятся его золото и серебро, велел отрубить мастеру голову, а его мастерскую разрушить. Вы уже догадались, о каком металле идёт речь?
Вопрос: перечислите найденные в тексте металлы
Документ №2
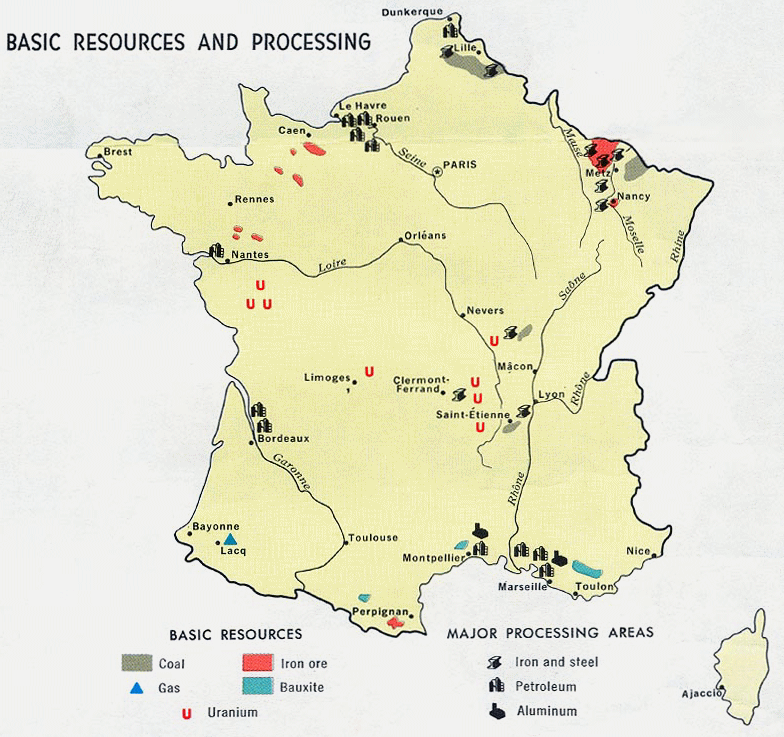
Физические карты Франции и республики Коми, с отмеченными на них полезными ископаемыми бокситами.
Вопрос: что объединяет и отличает эти территории?
ФранцияКарта Полезных Ископаемых Карта промышленности и сырья
ЕвропыФранции
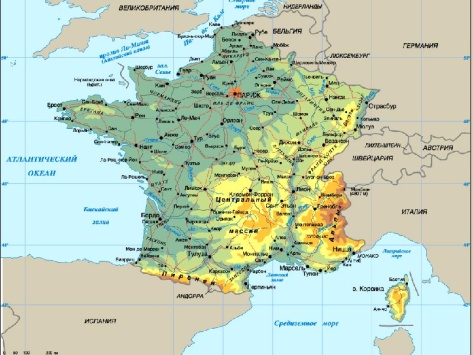
Карта республики Коми
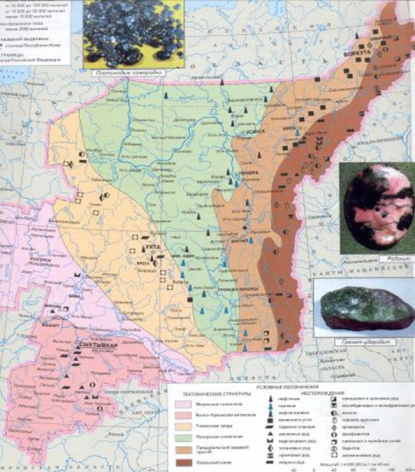
Документ №3
Газетная вырезка «Посуда для бедняков и императоров»
«…Алюминиевую посуду называют посудой для бедных, так как этот металл способствует развитию старческого атеросклероза. При приготовлении пищи в такой посуде алюминий частично переходит в организм, где и накапливается.
А в XIX веке на императорских приёмах алюминиевая посуда была самой престижной. Наполеон III устроил однажды банкет, на котором особо почётным гостям выдали алюминиевые ложки и вилки. Гости попроще удостоились обычными для императорского двора золотыми и серебряными приборами. К тому же, только у сына Наполеона III была дорогая по тем временам алюминиевая погремушка».
Прокомментируйте прочитанное.
Документ №4
Достоверный факт из жизни Д.И. Менделеева:
Великому русскому химику Д.И. Менделееву среди других подарков из золота и платины преподнесли ещё более дорогой подарок, чем все предыдущие, - чашу из алюминия.
Вопрос: Что бы вы сказали, если бы после окончания школы за отличную учёбу и примерное поведение Вас бы премировали алюминиевой кружкой?
Ответ к документу 1
Золото, серебро, алюминий
Ответк документу 2
одинаковая протяжённость, запасы бурых бокситов. Франция не смогла стать главной бокситовой державой, а республика Коми - сокровищница алюминиевой промышленности.
Приложение 2
Лабораторный опыт 1: (работа в парах)
В подтверждение химических свойств алюминия выполнение лабораторного опыта: взаимодействие алюминия с кислотой и щёлочью, обнаружение выделяющегося водорода.
Инструктаж по технике безопасности.Выполнение опыта, заполнение таблицы
Лабораторный опыт 2:
Проблемный вопрос к лабораторному опыту: математики утверждают, что от перестановки мест слагаемых сумма не меняется. А вот химики считают, что это не всегда справедливо. Убедитесь в этом, меняя порядок приливания растворов: сульфата алюминия и гидроксида натрия.
Получите Al(OH)3, запишите уравнение реакции
Инструктаж по технике безопасности.
-