- Учителю
- Разработка урока-путешествия по химии на тему Кислород (8-9 класс)
Разработка урока-путешествия по химии на тему Кислород (8-9 класс)


Урок химии
8 класс.
Урок - путешествие по теме:
«Химические свойства кислорода».
Автор - учитель химии,
МБОУ «Средняя школа № 1
г. Горно - Алтайска»
Лапина Виктория Ивановна.
2016 г.
г. Горно - Алтайск
Тема: «Химические свойства кислорода».
Цель: Сформировать знания о основных химических свойствах кислорода,
о реакциях - окисления и горения, показать их значение в жизни человека.
Развивать умение составлять формулы веществ по валентности и называть
их, умение составлять уравнения реакций, осуществлять их на практике.
Оборудование: технические средства - компьютер, видеомагнитофон. спиртовка, колба, ложка для сжигания веществ, спички. Вещества: сера, фосфор, железо, медная проволока, этиловый спирт.
Тип урока: сообщение новых знаний.
Методы: мотивационно - стимулирующий, частично - поисковый.
Ход урока.
1. Организационный момент.
2. Актуализация опорных знаний.
Темой нашего урока - «Химические свойства кислорода», откройте тетради и запишите её.
Изучать свойства кислорода будем в необычном месте, сегодня мы совершим путешествие в страну Оксигению. Почему именно в оксигению? (Потому, что латинское название кислорода - oxygenium). Самым удивительным местом в этой стране является замок её Величиства Реакции Горения, цель нашего путешествия попасть в замок и познакомиться с этой реакцией. Но это будет не простая прогулка. В дороге вас ждут испытания, преодолеть которые можно только с помощью знаний. В помощь вам - учебники химии и буклеты рассказывающие о стране Оксигении.
Задание № 1. И так путь к замку лежит через заколдованный химический лабиринт. Если суждение, вписанное в клетку, правильно, то продолжайте путь по стрелке с обозначением «да», если ошибочно, то по стрелке «нет», при этом выписывайте буквы из клеток в которые попадаете. (Приложение 1)
Проверка: «Желаю удачи». Кто правильно прошёл по лабиринту получает 5 кто ошибся в одной букве 4.
Задание № 2. Перед нами следующее препятствие - стена формул. Чтобы пройти сквозь стену вам предстоит выписать формулы оксидов и назвать их. Проверка - уберите лишние формулы, чтобы образовался лаз. Взаимопроверка. Оценки.
Молодцы, справились с заданиями, мы наконец попали в замок Реакции Горения.
Задание № 3. Пора узнать родословную данного процесса. Откройте учебники на стр……, прочитайте ……. абзацы и составьте кластер.
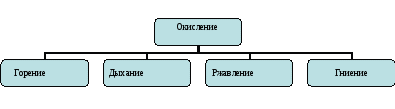
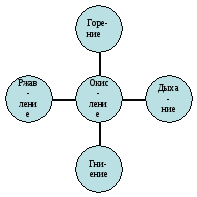
Дайте определение реакции окисления. В каких окислительных процессах принимает участие кислород? (Горение, дыхание, гниение, ржавление).
Задание № 4. Выясним на опыте чем отличается реакция горения от других реакций окисления?
Iа) Горение фосфора.
Красный фосфор на пламени спиртовки нагреваем
В колбу с кислородом помещаем.
Фосфор ослепительным пламенем горит.
Белый дым кругом валит.
Что наблюдаете? Запишем уравнение реакции. Р + О2 = ?
(Iб Горение серы. S + О2 = ?)
IIа) В кислороде могут гореть вещества которые мы обычно считаем не горючими например, железо. (Опыт на компьютере) Что наблюдаете?
Железо может гореть и в кислороде воздуха но, для этого необходимо взять порошок железа и постоянно его нагревать. И так. (Опыт).
Взяли железа - порошка немного,
Подержали над огнём.
Как увидели вы сами
Стал он огненным дождём.
Вы знаете, что кислорода в воздухе 21% и для горения этого достаточно, а если бы воздух содержал кислорода меньше 18%, то горение в нём многих веществ было бы не возможным. Ещё хуже, если содержание кислорода в атмосфере было бы больше 30%. В такой среде первый же удар молнии вызвал бы катастрофу - гигантский пожар.
Вещества в кислороде горят медленнее, выделяется меньше теплоты, но продукты реакции остаются прежними.
Запишем реакцию горения железа Fе + О2 = ?
И так, чем сопровождается реакция горения - выделением тепла и света.
Сформулируйте определение реакции горения.
Реакция горения это реакция окисления, сопровождающаяся выделением тепла и света.
Не все металлы горят в кислороде, некоторые медленно окисляются в нём. Убедимся проделав лабораторный опыт - «Окисление медной проволоки».
Техника безопасности!
Если вдруг ты на спиртовке
Нагревать чего-то хочешь,
Должное отдай сноровке.
Смело зажигай её бумагой.
Если вдруг пожар случится,
Спиртовку задувай скорей
И за дверь беги быстрей.
Пусть сосед идёт лечиться.
Главное, что ты здоров!
Что наблюдаете? Составьте уравнение реакции, назовите полученное вещество.
Сu + О2 = ?
Взаимопроверка, оценка.
III Горение сложных веществ. Демонстрация опытов на компьютере - горение метана, ацетилена.
Что наблюдаете? Запишем уравнения реакций и назовём полученные вещества.
С2Н2 + О2 = ? СН4 + О2 = ?
Вывод. С какими веществами реагирует кислород и какие вещества при этом образуются?
Кислород реагирует с простыми (металлами и неметаллами) и сложными веществами, при этом образуются оксиды.
При каких условиях возникает реакция горения?
(1-е - доступ кислорода; 2-е - нагревание вещества до температуры воспламенения)
Реакция горения является причиной возникновения пожаров. Как потушить огонь, прекратить реакцию горения? Какие средства для этого используются?
Помните: причина пожара - реакция горения, а повод неправильное обращение человека с огнём.
Покидаем страну Оксигению тем же путём т. е. через лабиринт.
Я думаю, что, путешествуя по химической стране, вы приобрели знания, которые пригодятся вам не только на уроках химии, но и в жизни.
Д/з § 4.4 упр. №1,3; § 4.3 повт.


Приложение 1
Х и м и ч е с к и й л а б и р и н т.
(Вариант №1)
Если суждение, вписанное в клетку, правильно, то продолжайте путь по стрелке с обозначением «да», если ошибочно, то по стрелке «нет», при этом выписывайте буквы из клеток в которые попадаете, в результате должно получиться слово.
«Ж» Старт
Аr (О) = 16
«Е»
Кислород
тяжелее воздуха.
«Л»
Кислород имеет
запах и цвет.
Да Да
→ →
↓ Нет ↓ Нет Нет ↓ Да
«Ю»
Кислород -
металл.
«А» Оксиды -
это сложные
вещества.
«А» Al2О3 - фо-
рмула составлена
правильно.
Да Нет
← →
↓ Нет Да Нет ↓ Да
«У»
Мr (О2) = 32
«У» Кислород, в молекуле воды - простое вещество.
«Ч» Кислород
поддерживает
дыхание.
Нет Да
→ →
←
Нет
↓ Да ↓ Нет Да ↓ Да
«Д» Кислорода
в воздухе 21%
по объёму.
«А» Кислород,
при t = - 1830 С
- жидкость
голубого цвета.
«И»
Кислород плохо растворим в воде.
Да Нет
→ ←
Нет
↓ Нет Да
ФИНИШ:
Кислород - это вещество вокруг
которого вращается земная химия.
Я. Берцелиус
Х и м и ч е с к и й л а б и р и н т.
(Вариант №2)
Если суждение, вписанное в клетку, правильно, то продолжайте путь по стрелке с обозначением «да», если ошибочно, то по стрелке «нет», при этом выписывайте буквы из клеток в которые попадаете, в результате должно получиться слово.
«У» Старт
Мr (О2) = 32
«Д»
Кислород
тяжелее воздуха.
«А»
Кислород -
металл.
Да Да
→ →
↓ Нет ↓ Нет Нет ↓ Да
«И»
Кислород имеет
запах и цвет.
«Ч» Оксиды -
это сложные
вещества.
«Ч» Кислород плохо растворим в воде.
Да Нет
← →
↓ Да Нет Нет ↓ Да
«М»
Аr (О) = 16
«Ж» Кислород, в молекуле воды - простое вещество.
«А» Кислород
поддерживает
дыхание.
Нет Да
→ →
←
Нет
↓ Да Нет Да ↓ Да
«Е» Кислорода
в воздухе 21%
по объёму.
«Л» Кислород,
при t = - 1830 С
- жидкость
голубого цвета.
«Ю»
Al2О3 - формула составлена
правильно.
Да Нет
→ ←
Нет
↓ Нет Да
ФИНИШ:
Кислород - это вещество вокруг
которого вращается земная химия.
Я. Берцелиус
Х и м и ч е с к и й л а б и р и н т.
(Вариант №1)
Если суждение, вписанное в клетку, правильно, то продолжайте путь по стрелке с обозначением «да», если ошибочно, то по стрелке «нет», при этом выписывайте буквы из клеток в которые попадаете, в результате должно получиться слово.
«Х» Старт
Аr (О) = 16
«И»
Кислород
тяжелее воздуха.
«М»
Кислород имеет
запах и цвет.
Да Да
→ →
↓ Нет ↓ Нет Нет ↓ Да
«Ч»
Кислород -
металл.
«И» Оксиды -
это сложные
вещества.
«И» Al2О3 - фо-
рмула составлена
правильно.
Да Нет
← →
↓ Нет Да Нет ↓ Да
«Е»
Мr (О2) = 32
«Е» Кислород, в молекуле воды - простое вещество.
«И» Кислород
поддерживает
дыхание.
Нет Да
→ →
←
Нет
↓ Да ↓ Нет Да ↓ Да
«С» Кислорода
в воздухе 21%
по объёму.
«К» Кислород,
при t = - 1830 С
- жидкость
голубого цвета.
«Е»
Кислород плохо растворим в воде.
Да Нет
→ ←
Нет
↓ Нет Да
ФИНИШ:
Кислород - это вещество вокруг
которого вращается земная химия.
Я. Берцелиус
Х и м и ч е с к и й л а б и р и н т.
(Вариант №3)
Если суждение, вписанное в клетку, правильно, то продолжайте путь по стрелке с обозначением «да», если ошибочно, то по стрелке «нет», при этом выписывайте буквы из клеток в которые попадаете, в результате должно получиться слово.
«К» Старт
Мr (О2) = 32
«И»
Кислород
тяжелее воздуха.
«С»
Кислород -
металл.
Да Да
→ →
↓ Нет ↓ Нет Нет ↓ Да
«О»
Кислород имеет
запах и цвет.
«Л» Оксиды -
это сложные
вещества.
«Л» Кислород плохо растворим в воде.
Да Нет
← →
↓ Да Нет Нет ↓ Да
«Р»
Аr (О) = 16
«Р» Кислород, в молекуле воды - простое вещество.
«Д» Кислород
поддерживает
дыхание.
Нет Да
→ →
←
Нет
↓ Да ↓ Нет Да ↓ Да
«С» Кислорода
в воздухе 21%
по объёму.
«О» Кислород,
при t = - 1830 С
- жидкость
голубого цвета.
«А»
Al2О3 - формула составлена
правильно.
Да Нет
→ ←
Нет
↓ Нет Да
ФИНИШ:
Кислород - это вещество вокруг
которого вращается земная химия.
Я. Берцелиус
Х и м и ч е с к и й л а б и р и н т.
(Вариант №3)
Если суждение, вписанное в клетку, правильно, то продолжайте путь по стрелке с обозначением «да», если ошибочно, то по стрелке «нет», при этом выписывайте буквы из клеток в которые попадаете, в результате должно получиться слово.
«к» Старт
Кислород
тяжелее воздуха.
«и»
Аr (О) = 16
«с»
Кислород -
металл.
Да Нет
→ →
↓ Нет ↓ Да Нет ↓ Да
«д» Кислород, в молекуле воды - простое вещество.
«с» Оксиды -
это сложные
вещества.
«л» Кислород плохо растворим в воде.
Нет Да
← →
↓ Да Нет Нет ↓ Да
«р»
Мr (О2) = 32
«р»
Кислорода
в воздухе 21%
по объёму.
«о» Кислород
поддерживает
дыхание.
Нет Нет
→ →
←
Да
↓ Да ↓ Да ↓ Нет
«д»
Кислород имеет
запах и цвет.
«о» Кислород,
при t = - 1830 С
- жидкость
голубого цвета.
«о»
Al2О3 - формула составлена
правильно.
Да
→ Нет
← ←
Да
Нет
↓ Нет Да
ФИНИШ:
Кислород - это вещество вокруг
которого вращается земная химия.
Я. Берцелиус
(В конце урока)
Х и м и ч е с к и й л а б и р и н т.
(Вариант №3)
Если суждение, вписанное в клетку, правильно, то продолжайте путь по стрелке с обозначением «да», если ошибочно, то по стрелке «нет», при этом выписывайте буквы из клеток в которые попадаете, в результате должно получиться слово.
«М» Старт
Окисление - взаимодействие веществ с кислородом.
«О»
4 Al + 3О2 = 2 Al 2О3
- реакция замещения
«Л»
Формула кислорода - О3.
Нет Нет
→ →
←
Нет
↓ Да ↓ Да ↓ Да
«О»
2 Zn + О2 = 2 ZnО
уравнение составлено верно.
«Л»
NО3 - формула оксида азота (IV) составлена
правильно.
«О»
Коэффициент перед кислородом - « 3 » в уравнении
4В + ?О2 = 2 В2О3
Да Нет
→ →
←
Нет
↓ Нет ↓ Да ↓ Да
«Ц»
Горение сопровождается выделением тепла и света.
«Ы»
Кислород поддерживает
дыхание.
«Д»
2 Zn + О2 = 2 ZnО
- реакция соединения
Нет
→ Да
←
←
Да
↓ Да ↓ Нет ↓ Нет
ФИНИШ:
«Повторение - мать учения!»
|
Я жилец квартиры восемь. Я могу зажечь на спор Спичку, печку и костёр. Кто вам всем дышать даёт - Атмосферный кислород!
Кислород - это вещество вокруг которого вращается земная химия. Я. Берцелиус
Физические свойства.
Кислород это газ, без цвета и запаха, немного тяжелее воздуха, плохо растворим в воде (с понижением температуры воды растворимость увеличивается). Кислород, при t = - 1830 С - жидкость голубого цвета.
|
Химические свойства.
Кислород энергично реагирует со многими веществами - простыми (металлами и неметаллами) и сложными.
Взаимодействие веществ с кислородом называют реакцией окисления этих веществ.
Реакция горения это реакция окисления сопровождающаяся выделением тепла и света.
|
В результате реакций окисления образуются оксиды.
Оксиды это сложные вещества состоящие из двух элементов один из которых кислород.
Применение некоторых оксидов.
Н2О - одно из самых распространённых и важных соединений на Земле. Почти 3/4поверхности Земли покрыто водой. Все живые существа (растения, животные, человек) не могут жить без воды. Вода нужна всем отраслям народного хозяйства. Больше всего потребляет воды сельское хозяйство, на втором месте - промышленность и энергетика, на третьем - коммунальное хозяйство городов.
СО2 (углекислый газ) - продукт дыхания и горения органических веществ. Основа производства шипучих напитков, хранения мороженного («сухой лёд»), тушения пожаров. Способствует процессу фотосинтеза растений. Избыток СО2 в атмосфере усиливает «парниковый эффект».
СО (угарный газ) - сильный яд. |
|
Кислотные оксиды - Р2О5, SО3 и др. применяются для производства соответствующих кислот.
SО2 - окуривают помещения с целью уничтожения микроорганизмов.
Реакцию взаимодействия О2 с ацетиленом (С2Н2) используют для резки и сварки металлов (т.к. выделяется большое количество теплоты).
О3 (озон) - обладает бактерицидными свойствами, его используют для обеззараживания питьевой воды. Озон - сильный окислитель. Используют для отбеливания тканей, муки.
О2 (кислород) и О3 (озон) - аллотропные модификации кислорода.
Аллотропные модификации это простые вещества образованные одним элементом.
Аллотропия это явление существования нескольких простых веществ образованных одним элементом.
|
Применение кислорода (О2) и воздуха.
для окисления топлива в том числе и ракетного, для резки и сварки металлов, для производства взрывчатых веществ, в химической промышленности, в чёрной и цветной металлургии.
Получение кислорода.
Основным сырьём для промышленного получения кислорода служит воздух.
В лаборатории получают разложением кислород содержащих веществ - Н2О, KMnO4 (перманганат калия), Н2О2 (пероксид водорода).
|
|