- Учителю
- Информативная карта Свойства кислот
Информативная карта Свойства кислот
Информационная карта.H2SO4 = Н+ + HSO4- ;HSO4- ↔ 2H+ + SO42 (+ индикатор)
2
Вз. с металлами, стоящими до Н2 в ряду напряжений металлов, и если образуется растворимая соль): металл + кислота → соль + Н2↑ - р. замещения
Zn + 2НCl = ZnCl2 + H2↑, или Zn0 + 2H+ = Zn2+ + H2↑
(С металлами не взаим. нерастворимые к-ты, (Zn + H2SiO3↓ ≠ ), а конц. Н2SO4, HNO3 с Mе взаимод. иначе).
3
Вз. с оксидами металлов: оксид металла + кислота → соль + Н2О - р. обмена
СuО + 2НCl = CuCl2 + H2О, или CuО + 2Н+ = Cu2+ + H2О
4
Вз. с основаниями: основание + кислота → соль + Н2О - р. обмена
2 NaOH + Н2SO4 = Na2SO4 + 2H2O, или Н++ OH- = H2O
5
Вз. с солями, если обр. осадок↓ или газ↑: соль + кислота → соль + новая кислота - р.обмена AgNO3 + НCl = AgCl↓ + HNO3, или Ag++ Cl- = AgCl↓
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ (Н2СО3), или 2H+ + CO32- = H2O + CO2↑
Химические свойства оснований
Растворимые в воде (щелочи)
Нерастворимые в воде
1. Диссоциируют:
Ва(ОН)2=ВаОН++ОН-↔Ва2++2ОН- (+ индик)
-
2. Вз. с кислотами:
кислота + основание → соль + Н2О - р. обмена
2 NaOH + Н2SO4 = Na2SO4 + 2 H2O, или Н++ OH- = H2O
Fe(OH)3+3HCl=FeCl3+3H2O, или Fe(OH)3+3H+=Fe3++3H2O
3. Вз. с оксидами неметаллов, которым соответствуют кислоты:
оксид неметалла + основание → соль + Н2О - р. обмена 6NaOH + P2O5 = 2Na3PO4 + 3H2O, или 6ОН- + P2O5 = 2PO43- + 3H2O
-
4.Вз.с солями, если обр. осадок↓ или газ↑:
соль + щелочь → новая соль + новое основание - р. обмена FeCl3 + 3KOH = Fe(OH)3↓ + 3KCl, или Fe3+ + 3OH- = Fe(OH)3↓
-
5. Разлагаются при нагревании
-
нерастворимое основание → оксид металла + вода - р. разложения 2Al(OH)3 = Al2O3 + 3H2O
Химические свойства оксидов
|
|
Основный оксид + кислота → соль + вода СuО + 2НCl = CuCl2 + H2О, или СuО + 2Н+ = Cu2+ + H2О |
Кислотный оксид + щелочь→соль + вода 2NaOH + SO2 = Na2SO3 + H2O, или 2OH- + SO2 = SO32- + H2O |
|
2 |
Вз. с водой, (если образуется растворимое основание- щелочь или растворимая кислота) | |
|
|
Основный оксид + вода → щелочь Na2O + H2O = 2NaOH |
Кислотный оксид + вода → кислота N2O3 + H2O = 2HNO2 (SiO2 + H2O≠ ) |
|
3 |
Взаимодействуют между собой: | |
|
|
основный оксид + кислотный оксид → соль СaO + СO2 = СaСO3 | |
кислота+соль→новая соль+новая кис-та
НCl + AgNO3 = HNO3 + AgCl↓, или Ag++ Cl- = AgCl↓
3
Со щелочами, если обр. осадок↓ или газ↑: щелочь + соль → новая соль + новое основание
FeCl3+3KOH = 3KCl + Fe(OH)3↓, или Fe3+ + 3OH- = Fe(OH)3↓
4
С солями, если обр. осадок↓: соль + соль → новая соль + новая соль
Са(NO3)2 + K2CO3 = CaCO3↓ + 2KNO3 , или Са2+ + СО32-= CaCO3↓
5
С металлами, если образуется растворимая соль, по правилу: более активный металл вытесняет из соли
менее активный (см. ряд напряжений металлов). Щелочные Ме в растворах не используют):
металл + соль → новый металл + новая соль
FeCl2+ Zn= Fe+ZnCl2, или Fe2+ +Zn0 = Fe0 + Zn2+
Химические свойства кислых и основных солей:
|
t0 2NaHCO3 =Na2CO3 + CO2 + H2O |
t0 (CuOH)2СО3 = 2CuO + CO2 + H2O | |
|
3. Реагируют со щелочами: |
3. Реагируют с кислотами: | |
|
NaHCO3 + NaOH = Na2CO3 + H2O |
Ca(OH)Cl + HCl = CaCl2 + H2O | |
|
|
| |
|
| ||
 Ме неМе
Ме неМе

 ↓ ↓
↓ ↓


 (основный) Оксид Ме Оксид
неМе (кислотный)
(основный) Оксид Ме Оксид
неМе (кислотный)
↓ ↓

 Основание Кислота
Основание Кислота
 ↓ ↓
↓ ↓
 Соль Соль
Соль Соль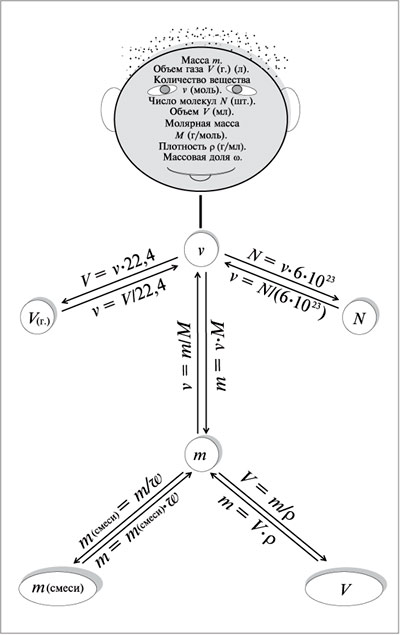
Информационная карта. Окислительно-восстановительные реакции.Справка.
СТЕПЕНЬ ОКИСЛЕНИЯ
(С.О.)


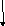
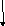
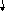
ПРОМЕЖУТОЧНАЯ
НИЗШАЯ
_| с.о.| =N группы
ВЫСШАЯ_
| с.о.| =N группы-8
Окислитель и восстановитель
Только окислитель
H2S+6O4,к. HN+5O3, KMn+7O4
Только восстановитель
Ме0, НСl-,
N-3H3, H2S-2
Н2, С, О2,
Сl2, HN+3O2
Алгоритм расстановки коэффициентов в уравнениях
окислительно-восстановительных реакций методом электронного баланса
1. Запишите схему реакции (формулы исходных веществ и продуктов
реакции)
H2S + О2 → SO2 + Н2О
2. Определите и сравните степени окисления элементов до и после реакции
До После
Н +1 +1
S -2 +4
О 0 -2
З. Подчеркните знаки элементов, степень окисления которых изменилась
H

 2+1S-2
+ О20 →
S+4O2-2 +
Н2+1О-2
2+1S-2
+ О20 →
S+4O2-2 +
Н2+1О-2
4. Определите окислитель и восстановитель
H2S - восстановитель (окисляется)
О2 - окислитель (восстанавливается)
5. Составьте электронные уравнения
S

 -2 -6
е-→ S+4 12 2 ок-е
-2 -6
е-→ S+4 12 2 ок-е
О20+4 е- → 2O-2 3 в-е
6. Расставьте коэффициенты перед формулами восстановителя и окислителя методом электронного баланса
(Правило: число электронов, отданных восстановителем, равно числу электронов, принятых окислителем)
Число отданных электронов 6е-•2=12е-.
Число принятых электронов 4е- • 3 =12е-.
7. Подберите коэффициенты в правую часть схемы реакции
2H2S + ЗО2 = 2SO2 + 2Н2О
8. Устно проверьте правильность составленного уравнения
Число молей атомов каждого химического элемента в его правой и левой частях одинаково
Памятка. Требования к решению и оформлению расчетных задач:
1. Сформулировать условие задачи.
2. Сделать краткую запись условия задачи из двух частей: «Дано», «Найти», обозначив физические величины по правилам ИЮПАК.
3. Сделать анализ имеющейся информации на избыток или недостаток данных.
4. Записывать все необходимые для решения физические величины в «Дано».
5. Решать задачу рациональным способом в общем виде с однократной подстановкой численных значений.
6. Каждое действие пояснять записью.
7. Проводить математические действия не только с числами, но и с единицами измерения.
8. Давать численное значение ответа не больше точности наименее точного числа.
9. Записывать полный ответ на вопрос задачи без использования формул соединений.
10. Проводить проверку полученного результата через составление условия обратной задачи.
11. Рекомендуется использовать понятие «количество вещества» и определять массу только тогда, когда это действительно необходимо.
Алгоритм решения задач «На избыток».ЗАДАЧА. На 47 г оксида калия подействовали раствором, содержащим 40 г азотной кислоты. Найдите массу образовавшегося нитрата калия.
Д

 ано:
m(K2O) = 47 г, Решение:
ано:
m(K2O) = 47 г, Решение:
m(HNO3) = 40 г. 1. Составляем уравнение
химической реакции. Найти:
m(КNO3)-? К2О + 2НNO3 =
2KNO3 +H2O
-
Подчеркиваем, что дано в условии задачи одной чертой, что найти двумя.
-
Рассчитаем молярные массы интересующих нас веществ и их количества: M(K2O) = 2Ar(K) + 1Ar(O) = 2•39 + 1•16 = 94 г/моль, n=47/94 = 0,5 моль M(HNO3) = 1Ar(H) + 1Ar(N) + 3Ar(O) = 1•1 + 1•14 + 3•16 = 63 г/моль, n=40/63 ≈0,6 моль M(KNO3) = 1Ar(K) + 1Ar(N) + 3Ar(O) = 1•39 + 1•14 + 3•16 = 101г/моль.
-
Сопоставляем количества вступивших в реакцию веществ необходимых по уравнению и количества взятых веществ по условию задачи: по условию: 0,5 моль 0,6 моль(х)
-
К2О + 2НNO3 = 2KNO3 +H2O
-
по уравнению 1 моль 2 моль
-
Найдем, какое из исходных веществ дано в избытке, а какое в недостатке, то есть полностью прореагировало. Для удобства расчета за х1 примем количество НNО3 и составим пропорцию: 0,5 моль К2О - х моль НNO3 1 моль К2О - 2 моль НNO3 х =2 моль » НNO3 в недостатке, т.к. по условию ее 0,6 моль, а по расчету необходимо 2 моль, а К2О в избытке. Поэтому расчет ведем по HNO3:
-
Найдем массу КNO3.
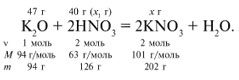
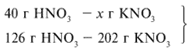 40/126 =
х/202, х = 64 г.
40/126 =
х/202, х = 64 г.
Ответ. m(КNO3) = 64 г
катионы, анионы
Ионная
Твердые, по прочности уступают атомным, но превышают молекулярные, достаточно тугоплавкие и нелетучие, растворы и расплавы проводят электрический ток, хрупки, многие растворимы в воде
Соли и некоторые оксиды: СаО, MgO, FeO, щелочи
Металлическая
Атом-
ионы
Металлическая связь между ионами металлов и свободными электронами
Электро- и теплопроводны, ковкие, пластичные, имеют металлический блеск.
Металлы и сплавы