- Учителю
- Конспект урока по химии Типы химических реакций на примере воды (8 класс)
Конспект урока по химии Типы химических реакций на примере воды (8 класс)
Кулакова Ирина Владимировна, учитель химии МБОУ СОШ № 33 г. Озерска, Челябинской области

«ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ НА ПРИМЕРЕ СВОЙСТВ ВОДЫ»
МБОУ СОШ № 33
Муниципальный марафон учителей химии в 2015-2016 уч. году
Учитель химии:
Ирина Владимировна Кулакова
03.03.2016
Г. Озерск
Цель урока: систематизировать знания о типах химических реакций на примере химических свойств воды и формировать умение составлять уравнения химических реакций.
Задачи, направленные на развитие учащихся:
- в личностном направлении: способствовать формированию мотивации учебной деятельности учащихся через создание проблемной ситуации и демонстрацию опытов, совершенствовать умение слушать, участвовать в коллективном обсуждении проблем, работать в парах и строить продуктивное взаимодействие;
- в метапредметном направлении: развивать умение формулировать проблему, осуществлять поиск информации (из материалов учебника, по воспроизведению в памяти примеров из личного практического опыта); выражать свои мысли с достаточной полнотой и точностью; организовать применение полученных знаний в процессе самостоятельной работы через использование интерактивного задания и теста; развивать рефлексивные умения - самоконтроль, самооценку; способствовать экологическому воспитанию;
- в предметном направлении: расширить знания учащихся о типах химических реакций на примере свойств воды; рассмотреть понятия «электролиз», «фотолиз», «гидролиз»; совершенствовать умение составления уравнений химических реакций; научить использовать таблицы растворимости для определения возможности протекания реакций обмена; развивать умение описывать признаки и условия течения химических реакций с помощью родного языка и языка химии.
Тип урока: обобщение и систематизация знаний с элементами нового материала.
Формы организации работы детей: групповая (просмотр презентации), индивидуальная (беседа, работа с рабочей тетрадью), проблемное обучение (решение проблемных вопросов).
Техническое оборудование: компьютеры, мультимедийный проектор, экран, оборудование и реактивы, необходимые для демонстрационного эксперимента, карточки с заданиями
Лабораторное оборудование и реактивы для эксперимента:
Опыт 1 «Взаимодействие натрия с водой»: Na, H2O, фенолфталеин, кристаллизатор с водой, скальпель, фильтровальная бумага
Опыт 2 «Взаимодействие воды с оксидам неметаллов»: P2O5, SiO2, H2O, лакмус, 2 пробирки штатив, стеклянная палочка, пипетки.
-
Организационный момент
(Играет музыка, на экране картины природы)
-
Активизация
Учитель: Действительно, это вода. А название монооксид дигидроген - шуточное - ведь монооксид дигидрогена есть не что иное, как вода. В 2007 году на неё купился новозеландский депутат. Ему пришло подобное письмо от избирателя, и он перенаправил его в правительство, потребовав запретить опасный химикат.
Постановка цели: Итак, поговорим о воде Так чем же нам о не известно? Что в ней привычное и таинственное? Что бы вы хотели узнать о ней на уроке о воде?
Предполагаемые ответы:
-
С чем реагирует
-
Где применяется
-
Какую роль играет для природы и человека
Темы урока: Типы химических реакций на примере свойств воды
-
Изучение нового материала
Прежде чем мы приступим к работе я объясню, как мы будем оценивать свою деятельность на уроке. У каждого из вас есть оценочный лист. В нем прописаны виды деятельности, характеристика вашей работы и оценка за этот вид деятельности. В течении всего урока мы будем сами себя оценивать. За урок можно набрать максимум 20 баллов, который затем переведем в пяти бальную систему.
-
Химические свойства воды
Учитель : давайте рассмотрим воду как химическое вещество. Каждое вещество характеризуется совокупностью физических и химических свойств. Какие свойства называют физическими, а какие химическими?
Ответ:
Физические - это совокупность внешних признаков, которые меняются в зависимости от воздействия на вещество
Химические - это отношение вещества к другим веществам, способность взаимодействовать и образовывать новые вещества.
Объяснить механизм взаимодействия веществ мы можем с помощью химических реакций. Какие существуют типы химических реакций и укажите их отличия?
Ответ детей:
-
Соединение
-
Разложение
-
Замещение
-
Обмена.
Учитель: В каких реакциях мы встречали воду как реагент?
-
Разложение воды:
Водород хорошо горит, и это свойство используют в качестве топлива для движения автомобилей. Получить его можно из обычной воды. Если через воду пропустить электрический ток ток, то она разлагается на водород и кислород.
Видео фрагмент «Электролиз воды»
Запишите уравнение данной реакции, укажите тип реакции
2H2 O = 2H2 + O2 Реакция разложения
Разложение веществ по действием электрического тока называется - электролизом
Данное уравнение отражает еще один процесс, протекающий в природе. Этот процесс называется фотолизом.
Задание 1. РАБОТА С ЭЛЕКТРОННМ УЧЕБНИКОМ: Прочитайте об этом процессе в электронном учебнике и ответьте на вопросы:
-
Что такое фотолиз?
-
Где протекает?
-
Какое значение имеет?
Ответ:
Фотолиз, или фотодиссоциация, - разложение воды под действием энергии солнечного света.
Фотолиз является частью фотосинтеза, которая протекает в гранах хлоропластов на световой фазе. При фотолизе энергия света, поглощённого хлорофиллом, используется для разложения воды на водород и кислород.
Кислород выделяется в виде побочного продукта, а водород связывается и затем включается в состав органических веществ. Идет фотосинтез.
Что вы знаете о нем?
Ответ:
Фотосинтез- это цепочка сложных биохимических реакций, в результате которых из воды и СО2 образуется кислород и глюкоза, общая схема фотосинтеза выглядит так:
6СО2+6Н2О =С6Н12О6+6О2
Каков тип данной реакции?
Ответ: Соединение
-
Реакции соединения
Значит, вода вступает в реакции соединения. Запишем разновидности этих реакций.
-
Фотосинтез - р. Соединения
6СО2+6Н2О =С6Н12О6+6О2
-
Взаимодействие с оксидами металлов
Данные реакции имеют огромное практическое значение. Сейчас при ремонте помещений используют обои или водоэмульсионную краску, а еще совсем недавно белили стены и потолки известью. ВНИМАНИЕ ОЛИМПИАДНЫЙ МОМЕНТ!
Получить известь для побелки можно и в домашних условиях: в магазине приобретали кусочки негашеной извести - оксид кальция, дома его заливали водой, пойдет бурная химическая реакция соединения . такую реакцию в промышленности называют гашением извести. СаО - негашеной известью, а Са(ОН)2 гашеной известью. Это их техническое название.
НА ЭКРАНЕ Часть схемы , которую заполняют дети в конспектах: MeO + H2O = MeOH (растворимое) - щелочь
Запишите уравнение гашение извести.
Как доказать, что в данной реакции получается щелочь?
Ответ: индикатором
Лакмус посинеет, фенолфталеин станем красным, метиловый оранжевый - желтым.
Эта реакции имеет свои особенности : оксиды металлов, имеющих нерастворимые основания в воде не растворяются. Приведите пример: взаимодействия оксида железа (III) с водой
Ответ у доски:
CaO + H2O = Ca(OH)2
Fe2O3 + H2O = , т.к. Fe (OH)3 нерастворимое основание
-
Взаимодействие с оксидами неметаллов
Ребята, а вы слышали о кислотных дождях, откуда они берутся в природе? Что в атмосфере у нас есть кислота, которая выпадает в виде осадков на землю? (ответы учащихся). Из-за небрежного отношения человека к природе в атмосфере накапливаются оксиды неметаллов. Они соединяются с парами воды, которые есть всегда в воздухе, и превращаются в кислоты
Запишем одну из таких реакций с оксидом серы (IV). Назовите продукты реакций
Ответ:
SO2 + H2O = H2SO3
Какой вывод можно сделать о протекании данных реакций:
Ответ
НА ЭКРАНЕ втора я часть схемы
Давайте проверим данное заключение на опыте. Приложение 1
Задание 2. Лабораторная работа: «Взаимодействие воды с оксидами неметаллов» (10 минут)
ТБ: сухие вещества набирает шпателем над лоточком, перемешиваем палочкой
По инструктивной карте проведите эксперимент. Оформите отчет:
-
Что делали (рисунком)?
-
Уравнения.
-
Наблюдения.
-
Вывод: о возможности протекания реакции и причины не возможности прохождения реакции.
Теперь давайте проверим, что у вас получилось: (на экране)
2 мл
Размешать стеклянной палочкой
Уравнение: P2O5 + 3H2O = 2H3PO4
У равнение:
SiO2 + H2O =т.к.
H2SiO3↓
равнение:
SiO2 + H2O =т.к.
H2SiO3↓
Наблюдение: Р2О5 вещество растворяется, лакмус покраснел
Наблюдение: SiO2 - не растворяется, лакмус не изменяет окраску
Вывод: Идет реакция с образование кислоты
Вывод: реакция не идет, т.к. кремниевая кислота нерастворима
Оцените себя (1 минутка)
Задание 3 для закрепления: (РАБОТА С ИНТЕРАКТИВНОЙ ДОСКОЙ)
Перед вами 7 уравнений реакций. Запишите уравнения возможных реакций соединения с водой. три уравнения мы рассмотрим вместе, а остальные самостоятельно.
Ответ:
-
Оксида серы (VI)
SO3 + H2O = H2SO4
-
Оксид свинца (II)
PbO + H2O ≠
-
Оксид азота (V)
N2O5 + H2O =2HNO3
-
Оксид лития
Li2O + H2O = 2LiOH
-
Оксид бария
BaO + H2O = Ba(OH)2
-
Оксид железа (III)
Fe2O3 + H2O ≠
-
Оксид фосфора (III)
P2O3+ H2O = 2H3PO3
Оцените себя (1 минутка)
-
Реакции замещения
Ребята, а как называются химические реакции между простым и сложным веществом? замещения (ответы учащихся). Посмотрим, как протекают данные химические реакции при участии воды
Демонстрационный опыт (проводит учитель) Приложение 3
Плыл по морю корабль, в трюмах которого был металлический натрий. И вдруг он наткнулся на рифы. В днище корабля образовалась пробоина, и вода быстро начала поступать к натрию. Натрий активно реагирует с водой, при этом выделяется большое количество водорода, который загорается от теплоты химической реакции. Корабль пошел ко дну, и ни один моряк не спас свой груз.
Что произошло? Составьте уравнение реакции.
Ответ: (ученик работает на доске)
2Na + 2H2 O = 2NaOH + H2
ВНИМАНИЕ ОЛИМПИАДНЫЙ МОМЕНТ!
Когда мы изучали реакции замещении, мы познакомились с рядом активности металлов. Для более глубокого понимания механизма данных реакций, связанных с водой, запишем схему:
Задание4. для закрепления: (Ученики по очереди записывают реакции на доске через документ камеру, а остальные в тетради)
РАБОТА С ДОКУМЕНТ - КАМЕРОЙ
Используя данную схему, составьте уравнения реакций замещения с водой:
(3 - Вместе, 3 - Самостоятельно)
Ответ:
-
Бария
-
Цинка
-
Серебра
-
Железа (до оксида железа (III))
-
Калия
-
Ртуть
Ba + 2H2O = Ba(OH) + H2 (н.у.)
Zn+ H2O = ZnO + H2 (t0)
Ag+ H2O≠
2Fe+ 3H2O = Fe2O3 + 3H2 (t0)
2K + 2H2O = 2KOH + H2 (н.у.)
Нg+ H2O≠
Оцените свою работу
Продолжаем работать дальше
Из неметаллов с водой реагируют, например, углерод и его водородное соединение (метан). Эти вещества гораздо менее активны, чем металлы, но все же способны реагировать с водой при высокой температуре:
НА ЭКРАНЕ: C + H2O = H2 + CO (при сильном нагревании)
-
Реакции обмена
Нам известно одно удивительное свойство воды: вода является хорошим растворителем. Каждое утро вы наверняка пьете сладкий чай, едите подсоленную пищу. А что происходит с сахаром, когда он растворяется в воде? А что происходит с солью, когда она попадет в воду? А что такое растворение?
Ответы учащихся
Это не простой процесс, в растворах идут сложные химические реакции обмена, в результате которых образуются сложные вещества.
Обратите внимание на таблицу растворимости, там есть соединения, растворимые воде (при этом вы ничего наблюдать не будете), и есть вещества, с прочерком, распадающиеся в воде.
НА ЭКРАНЕ Обменное взаимодействие веществ с водой, приводящее к их разложению, называют гидролизом.
Гидролиз бывает необратимым и обратимым (этот вопрос будет изучен в старших классах). Например, необратимо гидролизуется сульфид алюминия:
Al2S3+6HOH=2Al(OH)3↓+3H2S↑
или эту реакцию можно рассмотреть на примере взаимодействия:
CaC2 + 2HOH = C2H2↑ + Ca(OH)2↓
Видео фрагмент
Задание для закрепления: (Ученики по очереди записывают реакции на доске через документ камеру, а остальные в тетради)

-
Первичное закрепление приобретённых знаний с использование технологии «ученик - 1 интерактивная доска»
Давайте подведем некоторый итог изученного на уроке материала. Для этого выполним интерактивное задание «Типы химических реакций. Пазл «Угадай-ка» , LearningApps.org/display?v=pexa281qc
Таким образом, кроме основных четырех типов реакций можно выделить специфические реакции. Эти реакции похожи по механизму на основные типы, но имеющие особое название.
-
Первичное проверка знаний с использование технологии «2 ученика - 1 компьютер»
ПАРНАЯ РАБОТА
Итак, а теперь проверим наши знания по теме урока. Вам предлагается выполнить тест в программе «My Texty»
Выставьте полученные оценки в оценочный лист.
Подведем итог урока. Как вы поработали на уроке?
Шкала:
ЗАКЛЮЧЕНИЕ (Мотивация на дальнейшее изучение предмета)
А в заключении хочу показать, что нас ждем на следующих уроках о воде.
Эксперимент: Аномальные явления, связанные с водой
(На листе бумаги нарисованы стрелки. На них за ними ставится пробирка и наливается вода. На экране высвечивается: как стрелки меняют направление)
Приложение 1
В конспект урока 2 В конспект урока 3
Оценочный листработал вперед доски; вместе со всеми; не все понял в схеме; не смог разобраться
Работа по схеме
Подчеркните: работал вперед доски; вместе со всеми; не все понял в схеме; не смог разобраться
Печать на уроке
Сколько?
Электронный тест
ИТОГОВАЯ ОЦЕНКА
В конспект урока Приложение 2
Лабораторная работа
Тема: «Взаимодействие воды с оксидами неметаллов»
ЗАДАНИЕ:
По инструктивной карте проведите эксперимент. Оформите отчет:
-
Что делали (рисунком)?
-
Уравнения.
-
Наблюдения.
-
Вывод: о возможности протекания реакции и причины не возможности прохождения реакции.
.Лабораторная работа
Тема: «Взаимодействие воды с оксидами неметаллов»
В две пробирке насыпаем на кончике шпателя оксид фосфора (V) и оксид кремния. Приливаем по 2 мл воды.. Что наблюдаете? Какие реакции протекают? Составьте уравнение докажите наличие продуктов реакции
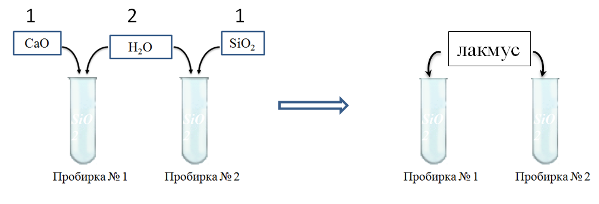
2 мл
Размешать стеклянной палочкой
Уравнение:
Уравнение:
Наблюдение:
Наблюдение:
Вывод: Реакция…….
Вывод: Реакция…….
В конспект 4 Приложение 3Na (или Li)
Вода
Фенолфталеин
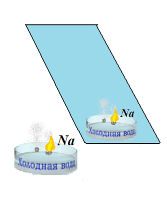
-
В воду капните 2-3 капли фенолфталеина
-
Под углом установить зеркало, чтобы поверхность чашки была хорошо видна
-
Металл освободите от масла с помощью фильтровальной бумаги и очистить скальпелем или ножом поверхностную пленку
-
Отрежьте металл (со спичечную головку) и опустите в чашку Петри
***Данный опыт можно показать с помощью графопроектора.
-
Чашка Петри или кристаллизатор
-
Документ-камера
-
Щипцы
-
Нож (или скальпель)
***Чтобы кусочек металла не прилип к стенке чашки или кристаллизатора, вымойте посуду с мылом или ополосните щелочью
![]() Начинается
реакция с выделением водорода и образованием щелочи:
Начинается
реакция с выделением водорода и образованием щелочи:
2Na + 2H2O = 2NaOH + H2
![]() Наличие
щелочи показывает малиновая окраска фенолфталеина
Наличие
щелочи показывает малиновая окраска фенолфталеина
Приложение 4
Опорный конспект урока
Тема: Типы химических реакций на примере свойств воды Дата:_______Лабораторная работа «Взаимодействие оксидов металлов с водой»
Уравнение:
Наблюдение:
Наблюдение:
Вывод: Реакция…….
Вывод: Реакция…….
В конспект урока Приложение 5
Задания для закрепления на уроке:
Задание на реакции соединения:
Ответ:
-
Оксида серы (VI)
SO3 + H2O = H2SO4
-
Оксид свинца (II)
PbO + H2O ≠
-
Оксид азота (V)
N2O5 + H2O =2HNO3
-
Оксид лития
Li2O + H2O = 2LiOH
-
Оксид бария
BaO + H2O = Ba(OH)2
-
Оксид железа (III)
Fe2O3 + H2O ≠
-
Оксид фосфора (III)
P2O3+ H2O = 2H3PO3
Задания на реакции замещения:
Ответ:
-
Бария
Ba + 2H2O = Ba(OH) + H2 (н.у.)
-
Цинка
Zn+ H2O = ZnO + H2 (t0)
-
Серебра
Ag+ H2O≠
-
Железа (до оксида железа (III))
2Fe+ 3H2O = Fe2O3 + 3H2 (t0)
-
Калия
2K + 2H2O = 2KOH + H2 (н.у.)
-
Ртуть
Нg+ H2O≠
Задания на реакции обмена: в конспект урока

В конспект урока Приложение 5
Электронный тест:
-
При взаимодействии бария с водой образуются:
-
Гидроксид бария и водород
-
Оксид бария и водород
-
Гидроксид бария
-
Оксид бария
-
С водой могут вступать в реакцию оба вещества пары
-
H2, Na
-
CuO, Ca
-
CO2 , P2O5
-
N2 , Fe
-
Сумма коэффициентов в уравнении реакции между оксидом азота (V) и водой равна:
-
4
-
2
-
5
-
6
-
Допишите фразу (в именительном падеже): процесс разложения воды под действием энергии солнечного света называется фотолиз.
-
Соотнесите:
Правая часть уравнения
Li2O + H2O =
LiOH
Li + H2O =
LiOH + H2
SO2 + H2O =
H2SO3
SO3 + H2O =
H2SO4
-
Составьте уравнение реакции: Mg2Si + H2O =
Коэффициент перед водой равен:
-
1
-
2
-
3
-
4
-
Выберите верные реакции:
-
Н2О = H2 + O2
-
3H2O + P2O5 = 2H3PO4
-
H2O + CO = H2CO3
-
H2O + SiO2 = H2SiO3
-
H2O + Na2O = 2 NaOH
-
H2O + CuO ≠
-
Выберите верное утверждение:
-
Электролиз - это разложение воды под действием электрического тока;
-
Гидролиз - это реакция замещения;
-
Фотолиз - это разновидность реакций соединения.
-
Выберите вещества, с которыми вступает в реакцию вода:
-
P2O5
-
Ag
-
Mg
-
K2O
-
SiO2
-
FeO
-
Распределите на группы - реакции соединения (А) и реакции замещения (Б), - в которые вступает вода:
-
CaO + H2O
-
Ba +H2O
-
AI +H2O
-
SO2 +H2O
-
Na + H2O
-
CO2 +H2O
Ответ:
А: 2, 4,6 Б: 1, 3, 5
</