- Учителю
- Конспект урока по химии на тему: Предельные ( насыщенные углеводороды. Метан ( 9 класс)
Конспект урока по химии на тему: Предельные ( насыщенные углеводороды. Метан ( 9 класс)
Конспект урока изучения нового материала в 9 классе по теме : « Предельные ( насыщенные ) углеводороды. Метан».
Дидактическая цель: создать условия для осознания и осмысления учащимися системы знаний по теме «Предельные углеводороды» методами личностно-ориентированного обучения и средствами ИКТ технологий .
Образовательный аспект: изучить строение молекулы метана, нахождение метана в природе, физические и химические свойства, применение метана и его производных; закрепить практические навыки составления химических уравнений и решения расчетных задач.
Воспитательный аспект: способствовать формированию коммуникативных компетенций учащихся, навыков сотрудничества, уважительного отношения к одноклассникам, культуры труда, экологической культуры личности.
Развивающий аспект: создавать условия для саморазвития личности, формирования навыков самоконтроля и самооценки, взаимоконтроля, сравнительно - сопоставительного анализа как способа изучения зависимости свойств от строения вещества; развития творческих способностей, логического мышления учащихся при решении поставленных проблем. Развивать практические умения моделирования молекул на примере молекулы метана.
Адаптивная цель для учащихся или уровневая цель для учащихся:
Репродуктивный уровень. Знать:
- положения и следствия теории химического строения веществ как основу для изучения основных понятий по данной теме: гомологический ряд, гомологическая разница, номенклатура, изомерия, свойства, получение и применение метана и его гомологов;
- признаки утечки газа и четкую последовательность действий при его обнаружении, правила техники безопасности для предотвращения утечки газа, правила оказания первой медицинской помощи пострадавшим в данной ситуации.
Конструктивный уровень:
- понимать зависимость свойств веществ от их состава, электронного и пространственного строения;
- составлять молекулы веществ по названиям и называть вещества по формулам, составлять формулы изомеров и гомологов, используя алгоритм; химические уравнения свойств метана и его гомологов;
- объяснять действие метана и его производных на организм человека при использовании их в быту, при проведении опытов;
- работать со схемой, инструктивной карточкой при выполнении практического задания.
Творческий уровень: уметь видеть проблему в необычной ситуации , предлагать варианты ее решения путем преобразования ранее известных знаний и способов действий.
Основные понятия: алканы; метан; реакции замещения, разложения; хлорпроизводные метана.
Межпредметные связи: математика, экология, биология, география.
Приемы обучения: опора на имеющиеся знания обучающихся, сравнение и анализ, моделирование, приемы интерактивного обучения ( «мозговой штурм», дифференциация игровые и проблемные задания; работа на опережение; ИКТ, групповые формы работы).
Методы обучения: частично -поисковые, словесные, иллюстрационные.
Формы организации учебной деятельности: индивидуальная, фронтальная , групповая;
беседа, химический диктант, решение задач, тестовая проверка знаний, самопроверка, взаимопроверка; отчет по опережающим заданиям; работа с таблицами, карточками, схемами, учебником.
Средства обучения: компьютер, мультимедийный проектор, мультимедийная доска, модель молекулы метана; учебник Химия: Учебник для 9 кл.общеобразоват.шк./ Н.Н.Нурахметов, К.М.Джексембина, Н.А.Заграничная и др. - 3-е изд., перераб., доп. -Алматы: Мектеп, 2013. - 272с., ил.
Тип урока: изучение нового материала.
Структура урока, основные формы и методы работы.
Этапы урока. Цели этапов урока.
Формы и методы работы.
Деятельность учителя и учащихся.
I.
4 мин.
Организационный момент.
Цель: создание положительного эмоционального настроя, подготовка учащихся к восприятию нового учебного материала, определение эмоциональное состояние учащихся на начало урока.
Методы: словесные, иллюстративные (упрощенный вариант цветового теста Люшера)
Учитель:
1.Приветствует учащихся.
2.Читает эпиграф к уроку (слайд 2) и просит учащихся поделиться своим пониманием данных строк.
3.Демонстрирует фигурки различных цветов (слайд 3) и просит учеников выбрать наиболее понравившихся им цвет.
Ученики :
1.Приветствуют учителя.
2. Высказывают свое понимание строк из стихотворения А.С. Пушкина
3.Выбирают цвет фигурки и фиксируют у себя на полях тетради.
Учитель: делает вывод о психологическом состоянии класса в начале урока.
II.
8 мин.
Актуализация опорных знаний и умений.
Цель: Воспроизведение в памяти системы опорных знаний и умений для осознанного восприятия нового учебного материала.
-
Химический диктант. Упражнение «Закончить фразу». ( Приложение 1.)
-
Самопроверка химического диктанта.
( Приложение2 , слайд 4).
-
Индивидуальная работа по карточкам на доске. ( Приложение 3.)
Методы: словесные, работа у доски по карточкам, самопроверка.
Формы работы: фронтальная, индивидуальная.
Учитель :
1.Проводит опрос учащихся по предыдущей теме:
- химический диктант;
- индивидуальная работа по карточкам.
Делает вывод о подготовке класса к восприятию нового материала.
Ученики. Выполняют задания учителя, настраиваются на определенный вид учебной деятельности, осуществляют самоконтроль и взаимоконтроль.
III.
8 мин.
Целеполагание и мотивация учебной деятельности.
Цель: пробуждение познавательного интереса к теме, создание атмосферы сотрудничества.
3.1. Определение темы урока решением проблемной ситуации. ( Приложение 4, слайд 5)
3.2. Краткая характеристика алканов. ( Рассказ учителя. Приложение 5.)
3.2. Постановка и сообщение целей и задач урока, построение плана изучения нового материала. (Работа с учебником, заполнение таблицы, определение границы знания и не знания. Приложение 6. Слайд 7.)
Методы работы: проблемная ситуация, «мозговой штурм», практические , словесные, аналитические.
Формы работы: индивидуальная, фронтальная.
Учитель:
1.Предлагает учащимся расчетную задачу на выведение химической формулы вещества, используя массовые доли химических элементов.
2. Дает краткую характеристику классу предельных углеводородов.
3. Подводит учащихся к осознанию основных целей и задач урока, консультирует, советует.
Учащиеся :
1. Решают расчетную задачу и на основании полученного результата формулируют тему урока .
2.Определив границы знания и не знания формулируют цели и задачи урока, составляют план достижения намеченной цели.
IV.
15 мин.
Изучение нового материала.
Цель. Сформировать представление
-
о строении молекулы, свойствах и применении метана;
-
о безопасном использовании природного газа.
4.1. История открытия метана.
-
Нахождение метана в природе.
-
Месторождения природного газа в Казахстане.
(Информационные сообщения учащихся .
Приложение 7.)
-
Особенности пространственного строения молекулы метана.
-
Рассказ учителя. (Слайд 8.9 Приложение 8.)
-
Проблемные вопросы (Слайд 10. Приложение 9.)
-
Объяснения учителя ( Слайды 11,12. Приложение 10)
-
Физические свойства метана.
-
Проблемный вопрос:
Анализ и комментарии учащимися слайдов 13,14 Приложение 10.)
-
-
Химические свойства метана .
-
( Объяснение учителя. Слайд ы 15,16. Приложение 11.)
-
-
Получение метана ( Рассказ учителя. Слайды 17,18 Приложение )
-
Применение метана. ( Работа с учебником. Анализ и пояснение схемы. Слайд 19 .)
-
Формы работы: коллективная, индивидуальная.
Методы работы: словесные ( диалог, объяснение, информационные сообщения); наглядные (демонстрационные, иллюстрационные).
Учитель:
1.Организует самостоятельную работу учащихся перед уроком и на уроке
( Подготовка и воспроизведение информационных сообщений
учащимися ).
2. Объясняет новый учебный материал с использованием ИКТ.
3. Создает проблемные ситуации, атмосферу творческого поиска,
консультирует учащихся и направляет их деятельность.
Учащиеся:
1.Изучают новую тему с помощью различных источников информации
( сообщения одноклассников, текст учебника, рассказ учителя, анализ схем)
2. Закрепляют навыки осуществлять логические операции ( анализ, сравнение, обобщение, выявление причинно- следственных связей, формулирование умозаключений, выводов).
V.
3 мин.
Первичное закрепление новых знаний.
Цель: осуществление первичного закрепления и выявление уровня усвоения новой темы.
-
Тестовая проверка (Слайды 20, 21. Приложение 11)
-
Взаимопроверка ( Слайд 22)
Учитель : демонстрирует тестовые задания на интерактивной доске .
Учащиеся: находят правильные ответы, закрепляют и корректируют полученные новые знания.
VI.
2 мин.
Домашнее задание .
Цель: закрепление знаний и умений , полученных на уроке.
Выучить § 46, выполнить упражнения на странице151.
-
Подготовить информационное сообщение на тему: «Биотоплево»
-
Решить расчетную задачу. Массовая доля углерода в алкане равна 83,72%. Установите молекулярную формулу алкана.
Учитель: объясняет домашнее задание.
Ученики: записывают, слушают объяснение.
VII.
5 мин.
Рефлексия.
Цель: осознание учениками смысла их деятельности на уроке, самоанализ усвоения нового материала.
-
Индивидуальная работа с карточкой 1, столбец 4. Самоанализ усвоения нового материала в соответствии с целями урока.
-
Работа с цветными фигурками. Определение эмоционального состояния класса в конце урока
(Слайд 21)
Учитель: Организует работу с карточкой 1 и цветными фигурками, побуждает учащихся к рефлексии, анализу полученного результата, подводит итоги занятия, озвучивает оценки за урок.
Ученики: заполняют карточку , анализируют свою деятельность на уроке, формулируют выводы и ставят цели по дальнейшей учебной деятельности с опорой на достигнутые результаты, озвучивают по просьбе учителя.
Приложение 1.
Химический диктант. Упражнение «Закончить фразу».
А) В состав углеводородов входят химические элементы…
Б) В органических соединениях валентность углерода равна …
В) Основные положения теории химического строения органических соединений сформулировал…
Г) Изомерами называются вещества…
Д) Вещества, имеющие сходное строение и свойства, но по составу отличающиеся друг от друга на одну или несколько групп СН2 , называются….
Приложение 2.
Самопроверка химического диктанта:
А) В состав углеводородов входят химические элементы… углерод и водород.
Б) В органических соединениях валентность углерода равна … четырем.
В) Основные положения теории химического строения органических соединений сформулировал…А.М.Бутлеров.
Г) Изомерами называются вещества, имеющие одинаковый …. состав молекул
Д) Вещества, имеющие сходное строение и свойства, но по составу отличающиеся друг от друга на одну или несколько групп СН2 , называются….гомологами.
Приложение 3.
Индивидуальная работа на доске.
Карточка 1.
Ученик.1.Составьте структурные формулы двух изомеров состава С5 Н12.
Ученик.2. Допишите к получившимся изомерам три гомолога.
Карточка 2.Из предложенных вариантов формул выбрать:
Ученик 1. Гомологи. Ученик 2. Изомеры.
1) СН3-СН2-СН2-СН2-СН2-СН3, 2) СН3-СН-СН2-СН2 ,
׀
СН3
3) СН3-СН2-СН2-СН-СН3,
4) СН3-СН2-СН2-СН2-СН3 5) СН3-СН-СН3, 6) СН3-СН2-СН2-СН3.
׀
СН3
Приложение 4.
Решите задачу и определите тему урока.
Относительная плотность по водороду неизвестного вещества, в котором массовая доля углерода 75%, водорода - 25%, равна 8. Найдите молекулярную формулу этого вещества.
Приложение 5.
Учитель. Углеводороды - это органические соединения, состоящие
из двух элементов - углерода и водорода. Таких соединений очень
много. Это самые простые органические вещества, что отнюдь не
умоляет их значения. Напротив, по определению немецкого химика
Карла Шорлеммера, «органическая химия есть химия углеводородов и
их производных».
Общую формулу углеводородов можно представить в виде CxHy, где x и
y связаны между собой определенным соотношением, определяющим класс
углеводорода. Единственный углеводород - метан - имеет в своем
составе один атом углерода; в остальных углеводородах число x
колеблется от двух до нескольких тысяч.
Метан относится к первой группе углеводорода, которые по
международной номенклатуре носят общее название «алканы». Алканы -
группа предельных углеводородов. Историческое название алканов -
парафины (лат. Parrumaffinis- малоактивный). По сравнению с другими
углеводородами они относительно менее активны.
Приложение 6.
Прогнозируемый вариант ответа. Карточка1.
Знаю ( +)
Известно частично
( + -)
Новый материал (-)
Цели.
Конец урока
Понятно все (+)
Понятно частично (+ -)
Ничего не понятно (-)
1.
Строение молекулы метана
1. Изучить строение молекулы метана ,знать химическую и структурную формулы метана
2.
Нахождение метана в природе.
2.Познакомиться с историей открытия метана, нахождением метана в природе, месторождениями метана в Казахстане.
3.
Физические свойства метана.
3. Изучить физические свойства метана , влияние метана на живые организмы.
4.
Химические свойства метана
4. Знать химические свойства, правила безопасного поведения при работе с метаном.
5.
Применение метана и его производных.
4. Рассмотреть применение метана и его производных.
Приложение 7.
4.1. История открытия метана. Ученик 1.
В ноябре 1776 года, итальянский физик Алессандро Вольта обнаружил метан в болотах озера Лаго-Маджоре на границе Италии и Швейцарии. На поиски его вдохновила статья, написанная Бенджамином Франклином о «горючем воздухе». Вольта собирал газ, выделяемый болотом, и в 1778 году получил чистый метан. Также он продемонстрировал возможность зажечь газ от электрической искры. Сэр Гемфри Дэви (учёный-химик) ещё в 1813 г. заключил из своих анализов, что рудничный газ есть смесь метана CH4 с небольшим количеством азота N2 и угольного ангидрида СО2 - то есть, что он качественно тождественен по составу с газом, выделяющимся из болот.
4.2. Нахождение метана в природе. Ученик 2.
Метан образуется в недрах Земли (природный газ)
В процессе гниения растительных остатков без доступа воздуха в озёрах, в болотах (болотный газ)
В угольных шахтах (рудничный газ)
Метан содержатся в атмосфере планет Солнечной системы: на Юпитере, Сатурне и его спутнике Титане, Уране, Нептуне, на Марсе. На Титане существуют (полярные) озёра метана и метановые дожди.
Кроме того, метан найден в хвосте кометы Хиякутаке и в метеоритах.
4.3. Месторождения природного газа в Казахстане. Ученик 3.
Производство природного газа - самая новая отрасль
промышленности в Казахстане. В основном природный газ добывают на
месторождениях, расположенных на полуострове Мангыстау, в бассейне
рек Эмбы, Урала и в Атырау.
Сравнительно недавно, в 2001 году в Жамбылской области открыто
новое месторождение природного газа Аманкельды. Общий запас
природного газа на территории Казахстана составляет 9,5 трлн.
м3, 68% всего природного газа сосредоточено в Уральской
области. В 2010 году по поручению президента страны Нурсултана
Назарбаева в Карагандинской области начата реализация проекта по
разведке и промышленному использованию метана из угольных
пластов.
Прогнозные ресурсы метана угольных месторождений Казахстана
оцениваются на уровне до 7 трлн м3, а ресурсы метана
Карагандинского угольного бассейна только до глубины 1500 метров
составляют 490,47 млрд м3. При этом содержание метана в газе
Карагандинского бассейна составляет от 80 до 98 процентов, что
позволяет использовать его как полноценную альтернативу
традиционному природному газу».
Приложение 8.
Современные представления о строении вещества не сводятся только к установлению порядка соединений атомов, но также включают рассмотрение пространственного строения молекул и электронной природы химических связей.
Предлагается написать молекулярную, электронную, структурную формулы метана, выяснить, что они показывают.
( ковалентная полярная)
3.
структурная формула
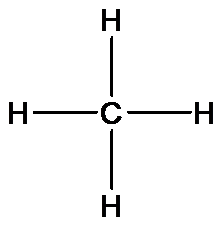
Порядок соединения атомов в молекуле
4.
пространственное
строение
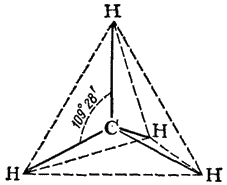
Правильная тригональная пирамида (тетраэдр) - реальное расположение атомов в молекуле метана.
Приложение 9
Работа с моделями молекулы метана.
Демонстрация шаростержневой модели молекулы метана, и объяснение особенностей ее строения.
Учащимся предлагаются проблемные вопросы:
- Почему молекула метана имеет такую пространственную форму?
- Чем объясняется направление валентных связей атома углерода от центра к вершинам тетраэдра?
Ответ следует искать в электронном строении атома углерода и молекулы метана.
Учащийся на доске записывает электронную формулу строения атома углерода.
Демонстрация слайдов 10, 11. Рассказ учителя.
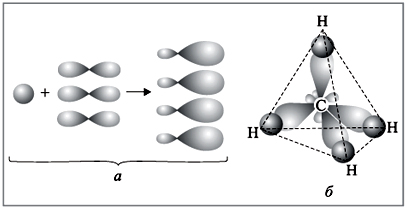
Вывод:
Молекула метана имеет тетраэдрическое строение, что обусловлено SP3-гибридизацией атома углерода, тетраэдрическим направлением четырёх гибридных электронных облаков атома углерода.
Сравнивая масштабную и шаростержневую модели молекул метана, можно отметить, что шаростержневая модель, появившаяся до возникновения электронной теории, более наглядно рассматривает строение молекулы метана
Приложение 10.
Физические свойства метана.
Метан - бесцветный газ без запаха, малорастворим в воде, легче воздуха. При использовании в быту, промышленности в метан обычно добавляют одоранты со специфическим «запахом газа». Обогащение одорантами делается для того, чтобы человек вовремя заметил утечку газа.
Имеются данные, что метан относится к токсическим веществам, действующим на центральную нервную систему. Проявляет наркотические свойства</, наркотическое действие ослабляется малой растворимостью в воде и крови. Накапливаясь в закрытом помещении, метан взрывоопасен.
С природным газом надо обращаться очень осторожно!
Приложение 11.
-
Первичное закрепление новых знаний:
Тестовые задания. Базовый уровень сложности
А1. Состав алканов выражается общей формулой
СпН2п
3)
СпН2п-2
2)
СпН2п+2
4)
СпН2п-6
А2. Алканом является вещество, формула которого
С4Н8
3)
С8Н10
2)
С22Н46
4)
С6Н6
А3. В молекуле метана атомы углерода находятся в состоянии гибридизации
sp
3)
sp3
2)
sp2
4)
sp2d
А4. Валентный угол связи С-Н в молекуле метана равен:
120º
3)
12º
2)
180º
4)
109º 28'
А5. Какие из приведенных утверждений о метане и его свойствах верны?
А) пространственное строение молекулы метана напоминает тетраэдр;
Б) метан является основным компонентом ( 80-97%) природного газа.
1. Верно только А; 3. Оба утверждения верны;
2. верно только Б; 4. Оба утверждения неверны.
Взаимопроверка: А1. -2; А2 - 2; А3 -3; А4 - 4; А5- 3.
9