- Учителю
- Технологическая карта Основные понятия за курс 8 класса
Технологическая карта Основные понятия за курс 8 класса
Технологическая карта « Основные понятия за курс 8 класса»
Состав атома
А Т О М


ЯДРО ЭЛЕКТРОНЫ


-1; ē
![]() р
0n m(ē) = в 1840 раз m( +1р)
р
0n m(ē) = в 1840 раз m( +1р)
m =1 m =1
Физический смысл порядкового № элемента, № периода и
№ группы в ПСХЭ Д.И.Менделеева.порядковый заряд ядра число общее число
№ элемента = (численно) = протонов в ядре = е- в атоме
№ периода = число энергетических уровней в атоме
№ группы = число валентных электронов
энергетический уровень - электроны, обладающие одинако-
вым запасом энергии
валентные электроны - наиболее слабо связанные с ядром
электроны (электроны внешнего энергетического уровня)
-
Степень окисления
Степень окисления - это условный заряд, который возник
бы на атоме, если бы обобщенные электроны были полностью
смещены к более ЭО атому.
А) C.о. элемента в простом веществе = 0.
Б) в соединениях: с.о. О -2, с.о. Н+1, с.о. F-1, с.о. Ме +n
В) тах (+) c.о. = № группы (число валентных электронов)
( - ) с.о. = № группы - 8
(для элементов главных подгрупп определяется числом электронов, которых не хватает атому для завершения внешнего энергетического уровня).
Г) с.о. всех атомов в молекуле = 0.
-
Химическая связь - взаимодействие атомов в молекуле
Виды химической связи
А) Ковалентная - осуществляется парой электронов


неполярная полярная 
(электронная плотность (общая электронная пара распределена симметрично смещена к атом большей относительно ядер атомов) ЭО)


ЭО (А) = ЭО (А) ЭО (А) < ЭО (Б)
(где А, Б - неметаллы)
Б) Ионная - связь между ионами, осуществляемая за счет
электростатического притяжения. ЭО (А) << ЭО (Б)(где А - Ме, Б - неМе)
В) Металлическая - связь между катионами металла и
обобществленными валентными электронами («электронный газ»).
Классификация неорганических веществ
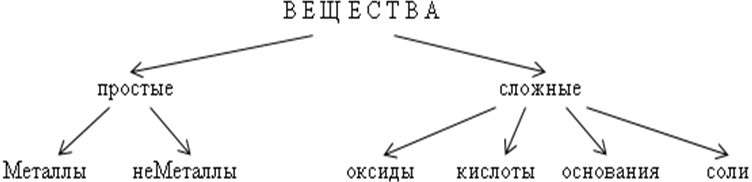
а) Оксиды - это сложные вещества, состоящие из двух химических
элементов, один из которых кислород в степени окисления -2 (ЭхОy).
б) Основания - сложные вещества, в состав которых входят атомы
металлов, соединенные с одной или несколькими гидроксогруппами.
в) Кислоты - сложные вещества, которые состоят из атомов водорода,
способных замещаться на атомы металлов, и кислотных остатков.
г) Соли - сложные вещества, образованные атомами металлов и
кислотными остатками.
Типы химических реакций
 а) А + Б
АХБY (реакция соединения),
а) А + Б
АХБY (реакция соединения),
 б)
АХБY А + Б (реакция разложения),
б)
АХБY А + Б (реакция разложения),
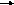 в)
АХБY + Г ГХБY + А
(реакция замещения),
в)
АХБY + Г ГХБY + А
(реакция замещения),
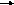 г)
АХБY + ВХГY
АХГY + ВХБY (реакция
обмена).
г)
АХБY + ВХГY
АХГY + ВХБY (реакция
обмена).
Задания для закрепления.
Карточка №1
-
Рассмотрите положение в периодической системе и строение атома с порядковым номером 12
-
Сравнить у кого больше выражены металлические свойства: Mg и AL
-
Определить степень окисления в соединениях:
Ca( NO3)2 , FeCL3, H 3PO4 SO3
-
Определить тип химической связи: Al; NO2 ; H2 ; K 2S
-
Распредилить вещества по классам:
NaCL , Cu (OH)2 , BaO , HNO3
-
Написать формулы сложных веществ: сульфат калия, гидроксид бария, угольная кислота, оксид железа (III).
-
Написать соответствие :
H 2SO4- ? Ca (OH)2- ? FeO- ? CO2-?
-
Расставьте коэффициенты, определите тип реакции
Mg + O2 = MgO
H2СОЗ → CO2 +H2O
Аl + Fe2O3 →Аl2О3 + Fe
Na2СO3 + НСl = NaСl + Н2СO3
CO +O2 =CO2
Задания для закрепления.
Карточка №2
-
Рассмотрите положение в периодической системе и строение атома с порядковым номером 16
-
Сравнить у кого больше выражены неметаллические свойства: N и P;
-
Определить степень окисления в соединениях:
Sr( NO3)2 , ALCL3, H2 SO4 SO3
-
Определить тип химической связи: Na 2O ; Br2; AI 2S3; Na
-
Распредилить вещества по классам:
-
Na2 CO3, Ca (OH)2 , MgO , HCl
-
Написать формулы сложных веществ: сульфит магния, гидроксид лития, сероводородная кислота, оксид бора.
-
Написать соответствие :
H 2SO3- ? Na (OH)- ? Fe 2O3 - ? SO2-?
-
Расставьте коэффициенты, определите тип реакции
CaCO3 → CaO +CO2
Аl + НСl →АlСl3 + Н2
FeСl2 + КОН = Fе(ОН)2 +КСl
Р + O2= Р2О5
KMnO4 → K2MnO4 +MnO2 +O2