- Учителю
- Конспект по химии на тему ' классификация и химические свойства оксидов' (8 класс)
Конспект по химии на тему ' классификация и химические свойства оксидов' (8 класс)
Данный урок посвящен обобщению знаний о классификации, номенклатуре и некоторых свойствах оксидов. Учитель объяснит, какие химические свойства характерны для кислотных и основных оксидов.
Тема: Обобщение пройденного материала
Урок: Классификация и химические свойства оксидов
Химическая природа оксидов проявляется в их отношении к кислотам и щелочам.
В связи с этим оксиды можно разделить на следующие группы (Рис. 1):
- солеобразующие, которые реагируют с образованием солей с кислотами или щелочами;
- несолеобразующие, которые не образуют солей с кислотами или щелочами.
В свою очередь, солеобразующие оксиды подразделяются на кислотные (реагируют со щелочами), основные (реагируют с кислотами) и амфотерные (реагируют как с кислотами, так и с щелочами).
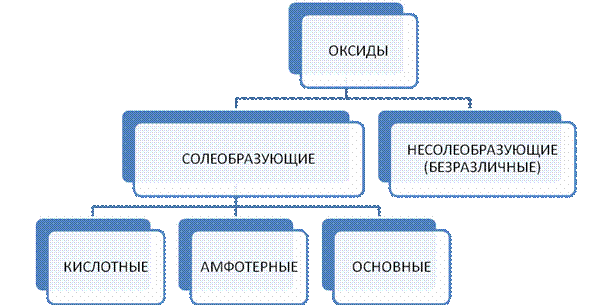
Рис. 1. Классификация оксидов
Кислотные оксиды - это оксиды, которые реагируют со щелочами с образованием соли и воды, но они не реагируют с кислотами. Например, при взаимодействии кислотного оксида - оксида углерода (IV) с гидроксидом натрия образуются карбонат натрия и вода:
CO2 + 2NaOH = Na2CO3 + H2O
К кислотным оксидам относятся, как правило, оксиды неметаллов (например, SO2, CO2, P2O5), и те оксиды металлов, в которых металл находится в валентности более III (например, Mn2O7, CrO3).
Кислотным оксидам соответствуют кислоты. Оксиду серы (IV) соответствуют сернистая кислота, оксиду углерода(IV) - угольная, оксиду фосфора(V) - ортофосфорная, оксиду марганца(VII) - марганцовая, оксиду хрома(VI) - хромовая.
Кроме реакций со щелочами, для многих кислотных оксидов характерны реакции с водой с образованием кислот и с основными оксидами.
Основные оксиды - это оксиды, которые реагируют с кислотами с образованием соли и воды, но не реагируют со щелочами. Например, при взаимодействии оксида магния с соляной кислотой образуются хлорид магния и вода:
MgO + 2HCl = MgCl2 + H2O
Основные оксиды образуют, как правило, металлы с валентностью - I, II или III. Основным оксидам соответствуют основания. Например, оксиду натрия соответствует гидроксид натрия NaOH, оксиду бария - гидроксид бария, оксиду меди(II) - гидроксид меди(II).
Основные оксиды могут реагировать с водой, если продуктом данной реакции является щелочь. При взаимодействии с водой оксида калия образуется щелочь - гидроксид калия, при взаимодействии оксида кальция с водой образуется гидроксид кальция:
K2O + H2O = 2KOH
CaO + H2O = Ca(OH)2
Основные оксиды также реагируют с кислотными оксидами с образованием солей.
Третья группа солеобразующих оксидов - амфотерные оксиды. Эти оксиды проявляют двойные свойства, т.е свойства и кислотных, и основных оксидов. Значит, они способны реагировать как со щелочами, так и с кислотами.
К амфотерным оксидам относятся, например, оксид алюминия, оксид цинка, оксид бериллия, оксид хрома(III):
Al2O3, ZnO, BeO, Cr2O3
Несолеобразующие, или безразличные оксиды не реагируют с образованием солей ни с кислотами, ни со щелочами. К такому виду оксидов относятся, например, оксиды азота N2O и NO, оксид углерода(II) - СО.
Названия оксидов составляются из слова «оксид» и названия образующего элемента с указанием валентности (если она переменная). Используется и другой подход: в названии указывается число атомов каждого элемента в оксиде. У многих оксидов есть и исторически сложившиеся названия. В соответствии с указанными правилами вещество с химической формулой SO2 можно назвать так:
- оксид серы(IV)
- диоксид серы («ди» - два)
- сернистый газ, или сернистый ангидрид
Сравним химические свойства кислотных и основных оксидов, которые по-разному относятся к кислотам и щелочам (Таблица 1).
Таблица 1. Химические свойства основных и кислотных оксидов
Основные оксиды
Кислотные оксиды
1. Взаимодействие с кислотами
Взаимодействуют с образованием соли и воды:
MgO+ 2HCl = MgCl2 + H2O
Реакция не характерна.
2. Взаимодействие со щелочами
Со щелочами с образованием солей не реагируют.
Взаимодействуют с образованием соли и воды:
CO2 + 2NaOH = Na2CO3 + H2O
3. Реакция с водой
Реагируют оксиды наиболее активных металлов, если образуются щелочи:
K2O + H2O = 2KOH
CaO + H2O = Ca(OH)2
Взаимодействуют с водой с образованием кислот:
СО2 + Н2О = Н2СО3
SO3 + H2O = H2SO4
Искл.: SiO2
4. Реакция с оксидами
Могут взаимодействовать между собой:
СаО + СО2 = СаСО3
3ВаО + P2O5 = Ba3(PO4)2
Список рекомендованной литературы
1. Сборник задач и упражнений по химии: 8-й кл.: к учеб. П.А. Оржековского и др. «Химия. 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. - М.: АСТ: Астрель, 2006. (с.119-123)
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под.ред. проф. П.А. Оржековского - М.: АСТ: Астрель: Профиздат, 2006. (с.124-126)
3. Химия. 8 класс. Учеб.для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. - М.:Астрель, 2013. (§36)
4. Химия: 8-й класс: учеб.для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005. (§44)
5. Химия: неорг. химия: учеб.для 8 кл. общеобразоват. учреждений / Г.Е. Рудзитис, Ф.Г. Фельдман. - М.: Просвещение, ОАО «Московские учебники», 2009. (§30)
6. Энциклопедия для детей. Том 17. Химия / Глав.ред. В.А. Володин, вед. науч. ред. И. Леенсон. - М.: Аванта+, 2003.