- Учителю
- Программа элективного учебного предмета Химия и военное дело 9 класс
Программа элективного учебного предмета Химия и военное дело 9 класс
Программа элективного учебного предмета
химия и военное дело
КЛАСС 8 - 9
ОБРАЗОВАТЕЛЬНАЯ ОБЛАСТЬ естествознание
МО естественно - математическое
УЧЕБНЫЙ ГОД
УЧИТЕЛЬ Исаева Лариса Константиновна
г. Ростов - на - Дону
2013 г.
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Одним из принципов определения содержания общего образования в Российской Федерации является его регионализация, опирающаяся на исторически сложившиеся национальные, культурные, социальные и хозяйственные особенности региона с учетом современных экономических и политических условий.
В связи с особенностью образовательного учреждения, в кадетском корпусе особое значение приобретает военно-патриотическая направленность в преподавании дисциплин.
Задачи образовательного и воспитательного процесса в ФГОУ кадетской школе - формирование личности на основе духовных, культурных и военных традиций донского казачества. Опираясь на эти традиции, учебно-воспитательный процесс в кадетском корпусе направлен на развитие высоких гражданских патриотических качеств кадет, их готовности выполнить свой воинский долг перед Родиной.
В связи с этим важно показать кадетам, какова роль химии в формировании военного потенциала страны и в современном военном деле.
Отличительной чертой контингента воспитанников кадетской школы является повышенный интерес к военному искусству, воинскому делу, поэтому применение нетрадиционных для естественных дисциплин межпредметных связей с военным делом помогает решить проблему более глубокого и прочного усвоения программы, т. к. интерес к изучаемому материалу стимулирует познавательную и мыслительную деятельность кадет, удерживает их внимание, то есть обеспечивает мотивацию к обучению.
Цели курса:
-
Ознакомление воспитанников с химическими веществами, применяемыми в военном деле, их свойствами, что позволит выделить ту ответственность, которая ложится на человечество, обладающее мощными средствами разрушения;
-
овладение умениями применять полученные знания для объяснения разнообразных химических явлений и свойств веществ, оценки роли химии в развитии современных технологий и получении новых материалов;
-
развитие познавательных интересов и интеллектуальных способностей в процессе самостоятельного приобретения химических знаний с использованием различных источников информации, в том числе компьютерных;
-
воспитание высоких нравственно - гуманистических качеств личности, убежденности в необходимости химически грамотного отношения к своему здоровью и окружающей среде; ответственности за безопасность личную, общественную и государственную;
-
показать достижения науки в военной технике, технологиях;
Виды работы:
- включение в урок текстов кадетской тематики, фрагментов фильмов, иллюстраций;
- решение задач, выполнение упражнений, диктантов, заданий кадетской тематики;
- домашние задания, в том числе требующие обращения к Интернету, к справочникам, к дополнительной литературе кадетской тематики;
- включение кадет в проектную деятельность, интегрирующую предметную и кадетскую тематику.
Рабочая программа рассчитана на 34 часа.
СПИСОК ЛИТЕРАТУРЫ
АВТОРЫ
НАЗВАНИЕ
ГОД ИЗДАНИЯ
ИЗД - ВО
1
Региональные программы донской средней общеобразовательной школы.
2007
Ростовский областной ИПК и ПРО
2
О мерах государственной поддержки общественных объединений, ведущих работу по военно-патриотическому воспитанию молодежи.
2012
Указ президента РФ № 727
3.
Азимов А.
Краткая история химии
2008
М.: Мир
4.
Алексинский В.Н.
Занимательные опыты по химии. Пособие для учителей.
2013
М.: Просвещение
5.
Барков С.А.
Галогены и подгруппа марганца. Элементы VI группы ПС. Пособие для учащихся.
2006
М.: Просвещение
6
Будников М.А.
Взрывчатые вещества и пороха.
2005
М.: Наука
7.
Буцкус П.Ф.
Книга для чтения по органической химии. Пособие для учащихся.
2009
М.: Просвещение
8.
Енякова Т.М.
Внеклассная работа по химии.
2004
М.: Дрофа
9
Казарян П.Е.
Химики в годы Великой Отечественной войны
2011
Химия в школе, №4
10
Князева Р.Н., Бородихина А.М.
Ознакомление с химическими веществами, применяемыми в военном деле.
2011
Химия в школе, №3
11
Крицман В.А.
Книга для чтения по неорганической химии. 2части
2006
М.: Просвещение
12.
Кузнецов В.И., Печенкин А.А.
Формирование мировоззрения учащихся при изучении химии. Пособие для учителей.
2012
М.: Просвещение
13
Паравян Н.А.
Соль нитрум, или просто селитра
1990
Химия и жизнь, №12
14
Секретова Л.В.
Прикладные аспекты преподавания химии в казачьей гимназии. Химия и военное дело. Методическая разработка для учителей химии.
2013
Ростов-на-Дону
15
Смирнов Ю.И.
Мир химии: Занимательные рассказы о химии.
2011
ИКФ «М и М-Экспресс»
16
Соловьев Ю.М.
История химии: Развитие химии с древнейших времен до конца 19 в. пособие для учителя.
2006
М.: Просвещение
17
Червонная С.Д.
Элементы в военном деле
2002
Химия. При-ложение к га-зете «1 сен-тября», №39
18
Шаталов М.А.
Межпредметные связи в формировании системы знаний
2008
Химия в школе, №5
19
Химия в бою: Сборник статей.
1970
М.: Воениздат
ГОДОВОЙ КАЛЕНДАРНЫЙ ПЛАН - ГРАФИК
Изучаемая тема
Кол-во часов
Виды контроля
Сообщ.
Презентации
ПР
СР
Тест-контроль
1
Введение
4
3
1
1.1
Предмет химии. Вещества.
Значение химии в формировании военного потенциала государства.
1
+
1.2
ПЗ Д.И.Менделеева. ПСХЭ.
Свойства урана и заурановых элементов. Ядерное и водо-родное оружие. Заражение окружающей среды радиоак-тивными компонентами.
1
1.3
Явление радиоактивности. У истоков великих открытий.
1
+
1.4
Открытие изотопов и их использование
1
+
2
Химия металлов
6
2
1
2
1
2.1
Химия металлических эле-ментов.
Легкие сплавы - авиационные материалы. Стали ружейные, орудийные, жаропрочные, режущие для производства боеприпасов, брони
1
+
2.2
Щелочные металлы.
1
+
2.3
Главный металл: железо.
1
+
2.4
Авиационные металлы. Алюминий. Титан, молибден, вольфрам.
1
+
2.5
Сплавы. Стали ружейные и орудийные. П.П.Аносов.
1
+
2.6
Токсичные, горючие и взрывоопасные вещества.
1
+
3
Химия неметаллических элементов
10
3
3
3
1
3.1
Кислород.
+
3.2
Водород.
+
3.3
Вода. Водные растворы.
+
3.4
Иван Алексеевич Каблуков и его роль в развитии теории растворов.
+
3.5
Галогены. Первые отравляю-щие вещества
+
3.6
Сера
+
+
3.7
Азот. Основы взрывчатых веществ.
3.8
Кислородные соединения азота. Взрывчатые вещества
+
3.9
Фосфор и его соединения
+
3.10
Электролиты.
+
4
Химические реакции в военном деле
2
1
1
4.1
ОВР - источник энергии.
4.2
Проблемы безопасного использования веществ и химических реакций в повседневной жизни.
+
+
5
ОРГАНИЧЕСКАЯ ХИМИЯ
7
1
2
1
5.1
Ароматические углеводороды.
+
5.2
Природные источники углеводородов.
5.3
Спирты и фенолы.
5.4
Альдегиды и карбоновые кислоты.
5.5
Сложные эфиры.
Отравляющие вещества.
+
+
5.6
Углеводы.
+
5.7
Сильнодействующие ядо-витые вещества.
Гидразин и его производ-ные.
6
Химическое оружие.
6
4
6.1
Химическое оружие первого и второго поколения - фос-форные ОВ нервно - парали-тического действия
+
6.2
Химическое оружие третьего поколения.
6.3
Проблема утилизации хими-ческого вооружения.
+
6.4
Ядерное вооружение.
+
6.5
ЭМИ или «несмертельное» оружие.
6.6
Химики в Великой Отечест-венной войне
+
КАЛЕНДАРНО - ТЕМАТИЧЕСКОЕ ПЛАНИРОВАНИЕ УРОКОВ
ПРЕДМЕТ ХИМИЯ И ВОЕННОЕ ДЕЛО
КЛАСС 8 - 9
УЧИТЕЛЬ ИСАЕВА Л. К.
КОЛИЧЕСТВО ЧАСОВ: 34
НАИМЕНОВАНИЕ РАЗДЕЛОВ И ТЕМ УРОКОВ;
РЕГИОНАЛЬНЫЙ КОМПОНЕНТ
КОЛ - ВО ЧАСОВ
ЭЛЕМЕНТЫ СОДЕРЖАНИЯ
ТРЕБОВАНИЯ К УРОВНЮ ПОДГОТОВКИ
ВИД КОНТРОЛЯ
I.
ВВЕДЕНИЕ
4
1.1
(1)
Предмет химии. Вещества.
Значение химии в формировании военного потенциала государства.
1
Военного потенциала государства.
Знать: роль химии в формировании воен-ной мощи страны.
Проверка усвоения материала в беседе.
1.2
ПЗ Д.И.Менделеева. ПСХЭ.
Свойства урана и заурановых элементов. Ядерное и водородное оружие. Заражение окружающей среды радиоактивными компонентами.
1
Особенности свойств урана и заурановых элеме-нтов. Ядерное и водород-ное оружие. Радиоактив-ные компоненты: откры-тие, применение.
Знать: практическое применение радиоак-тивных элементов.
Оценка сообщений и ответов обучающихся
1.3
Явление радиоактивности. У истоков великих открытий.
1
Исторические сведения из области открытия явления. Радиоактивность - ключ к овладению атомной энер-гией.
Знать: физический смысл явления;
значение для развития науки и промышлен-ности.
Оценка сообщений и ответов обучающихся.
1.4
Открытие изотопов и их использование
1
История открытия изото-пов. Физическое объясне-ние их существования. Применение известных изотопов.
Знать: роль открытия на развитие науки.
Оценка самостоятель-ной работы с дополни-тельной литературой.
2
ХИМИЯ МЕТАЛЛОВ
6
2.1
Химия металлических элементов.
Легкие сплавы - авиационные материалы. Стали ружейные, орудийные, жаропрочные, режущие для производства боеприпасов, брони
1
Состав легких сплавов, их основные параметры, ком-поненты трассирующих пуль, сигнальных ракет, зажигательных бомб.
Знать: вклад ученых в разработку легких сплавов; значение для создания новых типов вооружения.
Оценка самостоятель-ной работы с дополни-тельной литературой; участие в дискуссии.
2.2
Щелочные металлы.
1
Производство сверхлегких сплавов. Пиротехника. Металлическое оружие.
Знать: роль щелочных металлов в военной промышленности.
Проверка решения задач. Ответы на вопросы.
2.3
Главный металл: железо.
1
История открытия и применения железа. Осо-бые химические свойства: пассивация. Сплавы на основе железа.
Знать: основные об-ласти применения же-леза и его сплавов в военной промышлен-ности.
Проверка решения задач. Ответы на вопросы.
2.4
Авиационные металлы. Алюминий. Титан, молибден, вольфрам.
1
История открытия и применения. Особые фи-зические и химические свойства. Сплавы на осно-ве этих металлов.
Знать: основные облас-ти применения этих металлов и их сплавов в военной промыш-ленности.
Проверка решения задач. Оценка выступлений учащихся по индивиду-альным темам.
2.5
Сплавы. Стали ружейные и орудийные. П.П.Аносов.
1
История создания сплавов на основе различных металлов. Создание уни-версальных сплавов. Аносов П.П. - автор учения о стали.
Знать: роль сплавов в военном потенциале страны. Ученые - хи-мики - основополож-ники металлографии.
Оценка выступлений учащихся по индивиду-альным темам.
2.6
Токсичные, горючие и взрывоопасные вещества.
1
Характеристики веществ. Правила техники безопас-ности при обращении с этими веществами.
Знать: правила обра-щения с опасными веществами.
Ответы на вопросы. Тест по ПТБ.
3
ХИМИЯ НЕМЕТАЛЛИЧЕСКИХ ЭЛЕМЕНТОВ
10
3.1
Кислород.
1
«Греческий огонь». Оксиликвиты. Дыхатель-ные аппараты замкнутого цикла. Ракетное топливо. Порох.
Знать: особые фи-зические и химичес-кие свойства кислоро-да.
Проверка самостоятельно составленной схемы при-менения кислорода и результатов решения задач.
3.2
Водород.
1
Аэростаты. Гидриды металлов как источники водорода.
Знать: особые фи-зические и химичес-кие свойства водорода.
Решение задач.
3.3
Вода. Водные растворы.
1
Загрязнение природных вод при применении отравляющих веществ (ОВ). Способы очистки воды.
Знать: способы разде-ления смесей, очистки питьевой воды в походных условиях.
ПР: Очистка воды. Проверка составленной опорной схемы.
3.4
Иван Алексеевич Каблуков и его роль в развитии теории растворов.
1
Знать: вклад великих ученых в развитие науки.
Сообщения.
3.5
Галогены.
1
Боевые отравляющие ве-щества на основе галоге-нов.
Знать: особые фи-зические и химические свойства галогенов, их применение в военной химии.
Оценка докладов, сооб-щений, проверка рефера-тов.
3.6
Сера
1
Роль серной и азотной кислот при производстве ВВ. Черный порох.
Знать: взрывчатые вещества.
Проверка решения задач. Решение задач.
3.7
Азот. Основы взрывчатых веществ.
1
Азот в природе. Синтез аммиака.
Знать: особенности получения и свойств азота.
Оценка умения работать с дополнительной лите-ратурой, выступать с докладами и сообщени-ями
3.8
Кислородные соединения азота. Взрывчатые вещества
1
Соли аммония и нитраты - основа для производства взрывчатых веществ (ВВ).
Знать: история созда-ния ВВ.
Доклады.
3.9
Фосфор и его соединения
Фосфорные снаряды, ми-ны, зажигательные бомбы. ОВ. Древесный уголь. Противогаз. Огнетушите-ли.
Знать: особые свойства фосфора и его соедине-ний; компоненты вору-жения на основе фосфо-ра.
Тестирование. Заслушивание рефера-тов и сообщений.
3.10
Электролиты.
1
Аккумуляторы.
Знать: принцип дейст-вия
Оценка сообщений, реше-ние задач
4
Химические реакции в военном деле
2
4.1
ОВР - источник энергии.
1
Жидкое топливо для двигателей ВС. Ракетное топливо.
Знать: состав жидкого топлива; принцип дейст-вия.
Беседа. Сообщения.
4.2
Проблемы безопасного использования веществ и химических реакций в повседневной жизни.
1
Знать: основные прин-ципы безопасного обра-щения с химическими веществами; утилиза-ция химического вору-жения.
5
ОРГАНИЧЕСКАЯ ХИМИЯ
6
5.1
Ароматические углеводороды.
1
Тринитротолуол (тол).
Знать: способы получе-ния, свойства; безопас-ное обращение.
Проверка решения задач. Самоконтроль
5.2
Природные источники углеводородов.
1
«Греческий огонь». Напалм.
Знать: история созда-ния, принцип действия.
.
Ответы на вопросы. Фронтальный опрос.
5.3
Спирты и фенолы.
1
Нитроглицерин. Динамит. Тринитрофенол. Пикрино-вая кислота и пикраты.
Проверка усвоения материала в беседе. Решение задач.
5.4
Альдегиды и карбоновые кислоты.
1
Гербициды, дефолианты - фитотоксиканты.
Ответы на вопросы. Фронтальный опрос.
5.5
Сложные эфиры. Отравляющие вещества.
1
ОВ: зарин. ВИ - икс и другие производные изопропилового эфира.
Проверка конспекта. Решение задач.
5.6
Углеводы.
1
Нитроклетчатка (пироксидин)
Решение задач, ответы на вопросы.
5.7
Сильнодействующие ядовитые вещества. Гидразин и его производные.
1
Синтез ядовитых веществ. Действие на организм человека.
Решение задач, ответы на вопросы.
6
Химическое оружие.
6
6.1
Химическое оружие первого и второго поколения - фосфорные ОВ нервно - паралитического действия
1
Стойкие отравляющие ве-щества. Фосфорные отрав-ляющие вещества нервно - паралитического действия.
Знать: история; состав; принцип действия; безопа-сность.
Решение задач, ответы на вопросы.
6.2
Химическое оружие третьего поколения.
1
Кассетное оформление боеприпасов, использова-ние новейших достижений химии и техники аэрозо-лей, бинарная конструкция ОВ.
Знать: история; состав; принцип действия; безопа-сность.
Решение задач, ответы на вопросы.
6.3
Проблема утилизации химического вооружения.
1
6.4
Ядерное вооружение.
1
История создания ядерного вооружения; характерис-тика ядерных взрывов; развитие ядерного оружия.
Знать: история; состав; принцип действия; безопасность.
Решение задач, ответы на вопросы.
6.5
ЭМИ или «несмертельное» оружие.
1
Принцип действия.
Знать: история; состав; принцип действия; безо-пасность.
Решение задач, ответы на вопросы.
6.6
Химики в Великой Отечественной войне
1
Тематические и практические задачи к образовательной программе:
«Химия и военное дело»
Тема
Задания
1
ВВЕДЕНИЕ
1.1
Предмет химии. Вещества.
Значение химии в формировании военного потенциала государства.
1.2
ПЗ Д.И.Менделеева. ПСХЭ.
1.3
Явление радиоактивности.
1.4
Открытие изотопов и их использование
2
ХИМИЯ МЕТАЛЛОВ
2.1
Химия металлических элементов.
1. Этот редкий металл сыграл немаловажную роль в … защите Лондона от массированных налетов немецкой авиации во время второй мировой войны. Благодаря чрезвычайно высокой отражательной способности этого металла изготовленные из него зеркала позволяли прожекторам противовоздушной обороны в поисках воздушных пиратов легко «пробивать» мощными лучами плотный туман, частенько окутывающий британские острова. Поскольку этот металл принадлежит к легкоплавким металлам, во время работы прожектора зеркало постоянно нуждалось в охлаждении, однако английское ведомство охотно шло на дополнительные расходы, с удовлетворением подсчитать число сбитых вражеских самолетов.
1). О каком металле идет речь? (Индий)
2). Дайте характеристику индия по его положению в ПС.
3). Дайте полную характеристику химическому уравнению:
In2O3 + 3H2 ↔ 2In + 3H2
2. Оружейников древности и даже средневековья прочностные характеристики этого металла вполне устраивали. Во-первых, нагрузка, которую испытывал щит при ударе копьем или секирой, куда меньше пробивной силы винтовочного выстрела. Во-вторых, у древних металлургов не было другого металла, прочного и доступного, как этот. Не случайно античный бог-кузнец Гефест выковал непобедимому Ахиллесу щит …. Из какого металла? (Из меди)
1). Этот металл встречается в виде соединений очень часто. Особенно в виде сульфидов: Cu2S - медный блеск, CuFeS2 - медный колчедан (халькопирит).
- Определите массовую долю этого металла в каждом из соединений.
Получение идет по схеме:
2Cu2S + 3O2 = 2Cu2O + 2SO2
2Cu2O + Cu2S = SO2 + 6Cu
- Расставьте коэффициенты в уравнениях ОВР методом электронного баланса, укажите СО, окислитель и восстановитель.
- Рассчитайте массу полученной меди, если исходное вещество Cu2S, массой 250 кг, содержало 45% примесей, а выход первой реакции составил 65%, второй - 36%.
2.2
Щелочные металлы.
1. Как получить пероксид натрия? Напишите соответствующие уравнения реакции. Рассчитайте, какой объем кислорода необходим для получения 1,56 кг пероксида натрия. Почему этот объем не совпадает с объемом кислорода, выделяющимся при взаимодействии 1,56 кг пероксида натрия с диоксидом углерода: Na2O2 + CО2 = Na2CO3 + O2↑
2. Демонстрационный пиротехнический опыт (можно продемонстрировать).
Соли лития окрашивают в яркий красный цвет след трассирующих пуль и снарядов. Эту окраску можно продемонстрировать следующим образом. Сигарету поджечь до образования пепла, после чего опустить ее в соляную кислоту, чтобы соединения лития превратились в летучий хлорид. Снова внести сигарету в пламя, оно окрасится в характерный для лития ярко красный цвет. Соединения лития переходят в пепел при сгорании табачных листьев, в которых, как и во многих других растениях, в довольно больших количествах содержится.
Пепел, а точнее, содержащиеся в нем соединения лития, служат также катализатором процесса горения. Если на кусочек сахара насыпать немного пепла от сигареты и поднести сахар к пламени, то сахар ярко вспыхнет. Сахар без пепла гореть не будет.
2.3
Главный металл: железо.
1. В основе доменного процесса лежит реакция восстановления оксида железа (II) оксидом углерода (II). Составьте уравнение реакции, подобрав коэффициенты методом электронного баланса. Рассчитайте массу железа, если объем (н.у.) газообразного продукта реакции составил 67,2л.
2. К известному русскому химику В.В.Марковникову обратились из интенданства с просьбой объяснить, что происходит с лужеными чайниками, которыми снабжали русскую армию. Чайник, принесенный в лабораторию в качестве наглядного примера, был покрыт серыми пятнами и наростами, которые осыпались даже при легком постукивании рукой. Анализ показал, что и пыль, и наросты состояли из вещества без каких-либо примесей. Какое же вещество ведет себя так при низких температурах?
(Олово. При температуре ниже 13,20С в кристаллической структуре оловянного слитка начинается перестройка. Белое олово превращается в серое, и чем ниже температура, тем больше скорость этого процесса. Максимума она достигает при -39щС. по этой же причине погибла экспедиция Роберта Скотта, т.к. осталась без топлива, которое вытекло через швы, пропаянные оловом.)
2.4
Авиационные металлы. Алюминий.
Титан, молибден, вольфрам.
1. Титан обладает уникальными свойствами: почти вдвое легче железа, всего лишь в полтора раза тяжелее алюминия. При этом он превосходит в полтора раза сталь по прочности и плавится при более высокой температуре, обладает высокой коррозийной стойкостью. Идеальный металл для реактивных самолетов.
Впервые был получен в 1910г. американцем М. Хантером:
TiCl4 + 4Na = Ti + 4NaCl
Спустя 30 лет химиком Вильгельмом Кролем в качестве восстановителя было предложено использовать вместо натрия магний. С 1948г. в СССР началось промышленное получение титана по технологии, предложенной Кролем.
1). Запишите уравнение химической реакции получения титана по способу Кроля.
2). Рассчитайте, необходимое количество TiCl4 для получения 45 кг титана, если примеси в сырье составляют 20%, выход готового металла составляет 45%.
2. Демонстрационный пиротехнический опыт «Алюминий», «Катализ».
При производстве взрывчатых веществ горючей добавкой часто служит порошкообразный алюминий. Например, в состав аммонала входят тринитротолуол и порошок алюминия.
Смесь порошкообразного алюминия и кристаллического йода поместить на керамическую плитку и капнуть несколько капель воды (вода служит катализатором процесса). Происходит бурная химическая реакция (тяга обязательна!). H2O
2Al + 3I2 ---→ 2AlI3 + Q
2.5
Сплавы
1. Нержавеющая (легированная) сталь содержит 8% хрома и 18% никеля. Рассчитайте количество (моль) хрома и никеля, содержащихся в образце нержавеющей стали массой 100 гр.
2. Образец углеродистой стали массой 25гр растворили в хлороводородной кислоте. При этом выделилось 9,90л газа (н.у.). Рассчитайте массовую долю (%) углерода (II) в стали.
3
ХИМИЯ НЕМЕТАЛЛИЧЕСКИХ ЭЛЕМЕНТОВ
3.1
Кислород.
1. В подводных лодках и на космических кораблях для регенерации воздуха используют пероксид натрия. При этом пероксид натрия поглощает диоксид углерода с выделением кислорода:
2Na2O2 +2CО2 = 2Na2CO3 + O2↑
1). В результате какого процесса в воздухе подводной лодки накапливается диоксид углерода?
2). Рассчитайте массу и количество кислорода, которые можно получить из 1,56 кг пероксида водорода?
3). Какой объем занимает это количество кислорода, если удельную плотность кислорода при 200С принять равной 1,23г∕л?
4) Какой объем занимает это количество кислорода при н.у.? Почему эти объемы не совпадают?
5). Приведите формулу уже известного вам пероксида водорода. Для чего его применяют?
6). Какие еще способы получения кислорода вы знаете?
2. 17 июня 1808г. житель Бреста Пьер-Мари Тубулик запатентовал прибор для дыхания под водой, названный им «Ихтиозавр». К сожалению, детальное описание этого, по мнению некоторых историков, первого в мире водолазного аппарата замкнутого типа до нас не дошло. Известно только, что газовая смесь для дыхания поступала из «флакона», где якобы из морской воды добывался кислород. Для этого, согласно некоторым историческим источникам, изобретатель добавлял в воду «двуокись соды», сульфаты никеля и меди, разлагавшие ее на водород (который «откачивался») и необходимый для дыхания кислород. Ныряльщик регулировал подачу смеси с помощью «турникета» - ручки, закрепленной на «флаконе». Очевидно, что дошедшая до нас информация почти двухвековой давности искажена, да и терминология не везде соответствует современной.
Вопрос. Несмотря на все трудности, попытайтесь «отделить зерна от плевел», предположите, каков был принцип действия «Ихтиозавра». Подтверждают ли приведенные сведения гипотезу о том, что «Ихтиозавр» был водолазным аппаратом замкнутого типа (т.е. осуществляющим очистку выдыхаемого водолазом воздуха от углекислого газа и обогащение его кислородом, что позволяет снова использовать этот воздух для дыхания)?
(При первом же знакомстве с условиями задачи обращает на себя внимание термин «двуокись соды». Ключ к разгадке этого термина, явившегося следствием ошибки переводчика, в том, что в англо-и франкоязычных странах натрий до сих пор называют «содиум», поэтому очевидно, что «двуокись соды» - это двуокись натрия - старинное название вещества пероксида натрия. При добавлении пероксида натрия в воду он подвергается гидролизу:
Na2O2 + 2H2O = 2NaOH + H2O2
Сульфаты никеля и меди дадут в таком растворе гидроксиды:
NiSO4 + 2NaOH = Ni(OH)2↓ + Na2SO4
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Эти гидроксиды - катализаторы разложения пероксида водорода:
2 H2O2 = 2H2O + O2↑
Таким образом, водолаз периодически выпуская из «флакона» образовавшийся там кислород, использовал его для дыхания. Что же касается откачивания получающегося водорода - это, вероятно, результат проявления эффекта «испорченного телефона», ведь информация об изобретении Тубулика передавалась в виде догадок и домыслов в течение почти двух веков. По-видимому, дошедшие до нас сведения не подтверждают предположение о том, что «Ихтиозавр» был аппаратом замкнутого типа, поскольку в таких аппаратах кислород выделяется при реакции пероксида натрия (или другого вещества) с углекислым газом выдыхаемого воздуха:
2Na2O2 +2CО2 = 2Na2CO3 + O2↑
В рассматриваемом же аппарате выделение кислорода из реакционной смеси происходит постоянно.)
3.2
Водород.
1. В годы мировой войны американские летчики при авариях над морем использовали таблетки гидрида лития как источники водорода для наполнения спасательных жилетов, надувных лодок и сигнальных шаров-антенн. Ответьте на вопросы:
1). Какие соединения называются гидридами? Приведите формулы гидрида лития и других известных вам гидридов.
2). Почему для получения водорода летчики использовали именно гидрид лития? Рассчитайте массовую долю водорода в гидриде лития и в гидридах других металлов.
3). Составьте уравнение реакции взаимодействия гидрида лития с водой, в результате которой выделяется водород. При каких условиях получают водород из других гидридов, например, из гидрида титана?
4).Рассчитайте, какая масса гидрида лития потребуется для наполнения водородом сигнального шара объемом 1м3?
5). Вычислите подъемную силу 1м3 водорода в воздухе, используя закон Архимеда.
6). Как получить гидрид лития? Составьте уравнение реакции. Как вы считаете, на получение гидрида лития затрачивается столько же водорода, сколько его выделяется при разложении этого же количества гидрида лития водой? Если нет, то почему?
2. 16 июня 1904г. планировалось учебное погружение в Неве первой боевой подводной лодки русского флота «Дельфин». Подводная лодка приводилась в движение электромоторами, работавшими от аккумуляторных батарей. Водоизмещение позволяло брать на борт до 45 человек, кроме команды.
В этот день, кроме экипажа, в отсеках лодки разместились 24 матроса, осваивавшие азы подводного плавания. Из-за конструкторских недоработок и ошибок в управлении лодка ушла под воду с открытым люком. Поднять на поверхность ее удалось лишь через несколько часов. Трагедия унесла жизни командира и 24 матросов. Однако несчастья на этом не кончились. Во время откачки воды внезапно грянул взрыв, а за ним второй, изувечившие еще 4 моряков.
Тяжелым трудом, а порой и ценой жизни тысяч людей создавался российский подводный флот. Однако в чем причина внезапных взрывов? Следственная комиссия решительно отвергла предположение о возможности диверсии, несчастье не могло произойти из-за неосторожного обращения с боеприпасами, ведь их вообще не было на борту. Что взорвалось на «Дельфине»?
Взрывался гремучий газ (смесь водорода и кислорода), выделявшийся при электролизе воды, затопившей аккумуляторы:
эл. ток
2Н2О → 2Н2↑ + О2↑
Трудно сказать, что непосредственно вызвало взрыв. Это могло быть случайное перемещение предметов внутри лодки: при ударах возникли искры, а может быть, причина - местный нагрев от электрического тока.
Взрывы при затоплении подводных лодок, несущих аккумуляторные батареи, были нередки на заре развития подводных флотов различных стран. Поскольку подводные лодки чаще всего тонули не в пресных речках, а соленых морских водах, содержащих в среднем 19,35г хлорид-ионов на кг, то наряду с водородом и кислородом в образующейся газовой смеси оказывался и хлор:
2Cl- → Cl2 + 2e
Это еще более усугубляло положение, поскольку влажные смеси, содержащие хлор и водород, способны к самопроизвольной детонации, а хлор, кроме того, грозил отравлением оставшимся в живых морякам.)
3.3
Вода. Водные растворы.
1. Практическая работа: Очистка питьевой воды от вредных веществ и ее обеззараживание».
Цель: научиться очищать питьевую воду в походных условиях.
Оборудование: две емкости для воды, ткань или марля, активированный уголь, перманганат калия., вода.
1. Очистить воду от взвешенных частиц фильтрованием ч.
2. Если вода не является бесцветной, то в нее добавить растолченный активированный уголь, взболтать и отфильтровать.
3. Если вода имеет «затхлый» запах или застойный привкус, то в нее следует добавить немного раствора перманганата калия (до бледно- розовой окраски).
4. Прокипятить.
Хранить питьевую воду в походных условиях лучше всего в сосудах из высушенных декоративных тыкв, которые своим внутренним слоем волокнистой клетчатки очищают воду от мелко дисперсных взвесей и адсорбированных на них вредных примесей. Так хранили воду в походах казаки, которые называли эти сосуды «калабашками».
3.4
И. А. Каблуков и его роль в развитии теории растворов.
3.5
Галогены.
1. На рассвете 3 октября немцы, употребив удушливые газы, отравили три батальона 256-го полка и заняли первую линию наших окопов…
Валет, клацнув зубами, отпрыгнул, и на то место, где секунду назад стояли его ноги, спиленным деревом упал стоящий под сосной человек. Они перевернули его лицом вверх и тут только догадались, что под сосной нашел себе последний приют этот отравленный газами, бежавший от смерти, которую нес в своих легких, солдат одного из трех батальонов 256-го пехотного полка. Рослый, широкоплечий парень, он лежал, вольно откинув голову, с лицом, измазанным при падении клейкой грязью, с изъеденными газом, разжиженными глазами, из стиснутых зубов его черным глянцевитым бруском торчал пухлый, мясистый язык.
- Пойдем. Пойдем ради бога! Пусть он себе лежит,- шепнул товарищ, дергая Валета за руку.
Они пошли и сейчас же наткнулись на второй труп. Мертвые стали попадаться чаще. В нескольких местах отравленные лежали копешками, иные застыли, сидя на корточках, некоторые стояли на четвереньках - будто паслись, а один, у самого хода сообщения, ведущего во вторую линию окопов, лежал, скрючившись калачиком, засунув в рот искусанную от муки руку. (М.Шолохов, «Тихий Дон»)
1). О каком газе идет речь? Дайте его физическую характеристику. (Фосген СОCl2)
2). Получение: оксид углерода (II) реагирует с хлором на свету в присутствии катализатора - угля.
CO + Cl2 = COCl2
Что является окислителем, а что восстановителем в реакции образования фосгена?
Какое количество (в молях) и какой объем фосгена можно получить из 200л хлора и 120л СО, если выход реакции составляет 70%?
3.6
Сера
1. Кто и когда изобрел огнестрельный порох? (Роджер Бэкон, 1267г)
2. Из смеси каких веществ изготавливают порох? (Порох состоит из смеси селитры, серы и угля). Соотношение: нитрит калия : древесный уголь : сера = 15 : 43 : 2 (Дымный (черный) порох)
3. 1941год. Начало войны. Немецкие танки рвались к Москве. Катастрофически не хватало противотанковых средств. В этот критический момент ученые-энтузиасты за два дня на одном из заводов наладили выпуск бутылок КС (Качурина - Солодовникова) или просто бутылок с горючей смесью
1). Что представляли собой бутылки КС? К обыкновенной бутылке резинкой прикрепляли ампулы, содержащие концентрированную серную кислоту, бертолетову соль, сахарную пудру. В бутылку заливали бензин, керосин или масло.
2). Принцип действия, химические процессы, сопровождавшие действие смеси в бутылке?
Как только такая бутылка при ударе разбивалась о броню, компоненты запала вступали в химическую реакцию, происходила сильная вспышка, и горючее воспламенялось.
2KClO3 + H2SO4 = 2ClO2 + KСlO4 + K2SO4 + H2O
2ClO2 = Cl2 + 2O2
C12H22O11 + 12O2 = 12CO2 + 11H2O
3.7
Азот
1. В лабораторных условиях азот получают термическим разложением нитрита аммония NH4NO2. Составьте уравнение реакции и рассчитайте массу соли, необходимой для получения 5л азота.
2. Демонстрационный пиротехнический опыт «Получение дымного пороха».
Смесь растертых нитрата калия, серы и древесного угля поместить на керамическую плитку или железный лист и поджечь лучиной. Смесь сгорает, образует облако дыма:
6KNO3 + 2S + 3C = K2S + K2SO4 + K2CO3 + CO2↑ + CO↑ + 3N2↑ + 4O2↑
Для доказательства выталкивающей силы продуктов сгорания пороха следует поместить щепотку смеси в пробирку, укрепленную в лапке штатива. Для безопасности пробирку обернуть медной сеткой или жестяной трубочкой по размерам пробирки. Накрыть колпачком из алюминиевой фольги. Пробирку нагреть горелкой. Порох воспламенится, колпачок взлетит вверх.
3.8
Кислородные соединения азота
1. Селитра издавна использовалась для приготовления зажигательных смесей. Позже на основе той же природной селитры научились готовить черный порох. «Военные» наклонности нитросоединений объясняются тем, что они очень богаты кислородом и легко его отдают, вызывая мгновенную реакцию окисления - взрыв.
1). Рассчитайте массовую долю кислорода в: а) серной кислоте; б) азотной кислоте; в) нитрате калия; г) сульфате калия; д) фосфорной кислоте; е) фосфате калия. Сделайте вывод.
2.При нагревании щелочного нитрата калия в присутствии металлов с большой теплотой горения, может произойти реакция:
3KNO3 + 5 Al = 3KАlO2 + Al2O3 + 3∕2 N2. Эта реакция очень экзотермична и сопровождается взрывом.
1). Расставьте коэффициенты в реакции ОВР методом электронного баланса.
2).Рассчитайте объем выделившегося газа, если для реакции использовали 10г 25%-ного нитрата калия и 13 г алюминиевого порошка.
3.9
Фосфор и его соединения.
Углерод.
1. Этот ученый пришел к идее создания универсального противогаза, которая была основана на возможной сорбируемости почти всех ОВ, независимо от их химической природы. В качестве поглотителя он использовал активированный уголь. Инженер завода «Треугольник» Э.Л.Кумант предложил использовать для противогаза сконструированную им резиновую маску. Противогаз спас многие тысячи жизней и был принят на вооружение в русской, а затем и в союзнических армиях во время первой мировой войны.
1). Назовите имя ученого. (Н.Н.Зелинский)
2). В каком году? (1915г.)
2. Работы по использованию фосфористого водорода (PH3) в качестве ОВ проводились многие годы и были прекращены лишь в 1959 г. Фосфин - бесцветный ядовитый газ с неприятным чесночным запахом. Кипит при -87,40С, затвердевает при -1330С; воспламеняется на воздухе при температуре около 1500 и сгорает в фосфорную кислоту: РН3 + 2О2 = Н3РО4.
Получение фосфина: Са3Р2 + 6Н2О =2РН3 + 3Са(ОН)2
Рассчитайте массу полученного фосфина, если выход реакции составил 73%, а масса исходного Са3Р2 составляла 200гр.
3. Демонстрационный пиротехнический опыт «Изучение адсорбционных свойств активированного угля».
В стакан с водой внести немного любой гуашевой краски (раствор должен быть сильно разбавленным), добавить растолченную таблетку активированного угля и перемешать содержимое стакана стеклянной палочкой. Наблюдаемые результаты: окрашенный раствор постепенно обесцветится.
Вывод: активированный уголь - адсорбент. Его используют для поглощения ОВ в противогазах, для очистки питьевой воды от вредных веществ.
3.10
Электролиты.
4
Химические реакции в военном деле
4.1
ОВР - источник энергии.
1. Современное жидкое ракетное топливо - две жидкости, смешивающиеся в камере сгорания. Одна жидкость - окислитель, другая - восстановитель, т.е. топливо или горючее. В 1932г. Ф.А. Цандер (СССР) впервые предложил использовать жидкий фтор для ракетных двигателей, а смеси жидких кислородов и фтора - другой советский ученый, В.П. Глушков в 1933г.
1) Почему фтор как окислитель опасно использовать в чистом виде?
2). Какие еще окислители используются для различных видов топлива?
3). Двигатели немецких ракет «ФАУ - 2» работали на жидком кислороде и этиловом спирте. При полном окислении 1 моль этилового спирта выделяется 1370 кДж тепла. Какое количество тепла выделится при окислении 1т спирта.
С2Н5ОН + 3О2 = 2СО2 + 3Н2О + 1370 кДж
2. Подберите коэффициенты в уравнениях реакций:
1) FeSO4 + O2 + H2O = FeSO4(OH)
2) Ca3(PO4)2 + C + SiO2 = Ca2SiO4 + P4 + CO
3) FeCl3 + KI = FeCl2 + I2 + KCl
5
ОРГАНИЧЕСКАЯ ХИМИЯ
5.1
Ароматические углеводороды.
1. Что такое тротил, какова его химическая формула, к какому классу соединений он относится, где применяется?
Тротил - торговое название тринитротолуола С6Н2(СН3)(NO2)3. относится к классу нитросоединений. Применяется в разрывных снарядах, подводных минах, торпедах и т.д. в мирной технике применяется как примесь к взрывчатым веществам и бездымным охотничьим порохам.
Рассчитайте его относительную атомную массу; количественное соотношение элементов; массовые доли элементов в веществе.
5.2
Природные источники углеводородов.
1. Демонстрационный пиротехнический опыт «Получение бездымного пороха».
Приготовить нитрующую смесь из концентрированных азотной и серной кислот, поместить в нее комочек гигроскопической ваты. Стакан со смесью нагреть до 700С на водяной бане в течение 5 - 7 минут. Вату извлечь, промыть водой, отжать между слоями фильтровальной бумаги, высушить в фарфоровой чашке на кипящей водяной бане. К высушенной вате поднести зажженную лучинку. Вата моментально сгорает без дыма. (Опыт взрывоопасен. Работать под тягой!)
5.3
Спирты и фенолы.
1. Химический анализ показал, что органическое вещество, проявляющее свойства спирта, содержит 52,2% углерода и 13,0% водорода (по массе). Составьте формулу этого вещества. Приведите три примера химических реакций с его участием.
2. Пикриновая кислота или 2,4,6 - тринитрофенол - желтое кристаллическое взрывчатое вещество: С6Н2(NO2)3OH. Рассчитайте массовые доли всех элементов в этом соединении.
5.4
Альдегиды и карбоновые кислоты.
5.5
Сложные эфиры.
1. Тринитроглицерин - результат взаимодействия многоатомного спирта глицерина и азотной кислоты - сложный эфир. Это взрывчатое вещество и одновременно лекарственный препарат: 1%-ный спиртовой раствор применяется в медицине в качестве средства, расширяющего сосуды серLца.
Н2С - ОН H2C - O - NO2
I I
HC - OH + 3HNO3 → HC - O - NO2 + 3H2O
I I
H2C - OH H2C - O - NO2
Рассчитайте количество вещества (в молях) и массу глицерина, необходимые для получения 7,3гр тринитроглицерина, если выход реакции 87%. Сколько лекарственного препарата можно получить из этого количества.
5.6
Углеводы.
6
Химическое оружие.
Химическое оружие второго поколения - фосфорные ОВ нервно-паралитического действия
1. Незадолго до приезда Н.Д.Зелинского в Германию Л.Майер открыл тиофен и предложил Николаю Дмитриевичу осуществить синтез тетрагидротиофена. «Идя по пути такого синтеза, - писал Н.Д., - мною приготовлен был промежуточный продукт - дихлордиэтилсульфид, оказавшийся сильным ядом, от которого я жестоко пострадал, получив ожоги рук и тела».
1). Назовите самое сильное отравляющее вещество, которое впервые получил Н.Д.Зелинский. (иприт)
2). Приведите формулу этого ОВ, рассчитайте массовые доли химических элементов, входящих в состав этого вещества.
2. Инкапаситант LSD - ОВ первого поколения, ориентирован не на уничтожение живой силы противника, а на временный вывод ее из строя.
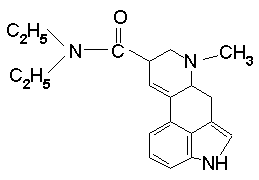
Рассчитайте молекулярную массу этого соединения; массовую долю азота.
3. Фосфорные ОВ были получены в Германии (табун - 1936 г., зарин - 1939 г., зоман - 1944 г.). В Советском Союзе целенаправленные разработки ФОВ интенсивно проводились, начиная с 1943 года.
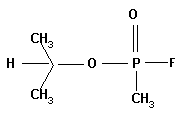 зарин
зарин
Одно из основных ОВ армий России и США. Уничтожает живую силу заражением приземного слоя воздуха. Отравляет при любом способе проникновения в организм: вдыхании пара, всасывании жидкого или парообразного вещества через неповрежденную или поврежденную кожу и слизистые оболочки глаз, приеме зараженной воды и пищи, контакте с поверхностями. Смертельная концентрация около 0,2 мг/л при минутной экспозиции. В капельно-жидком виде вызывает общее отравление через кожу.
Зоман вызывает общее отравление.
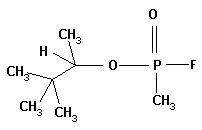 зоман
зоман
Рассчитайте молекулярные массы этих соединений; массовую долю фосфора и фтора.
7
Химики в Великой Отечественной войне.
</