- Учителю
- Конспект урока по химии Слабые и сильные электролиты 9 класс
Конспект урока по химии Слабые и сильные электролиты 9 класс
Урок № 11
Тема: Сильные и слабые электролиты. Степень диссоциации.
Цель: сформировать знания о степени диссоциации и силе электролитов.
Задачи:
Образовательные
-
Углубить понятия об электролитах и ЭД.
-
Показать влияние разбавления, температуры на степень диссоциации.
-
Определить понятие «степень ЭД», сильные и слабые электролиты.
Развивающие
-
Развивать умение написания реакции диссоциации.
-
Формировать понятие диссоциированных и недиссоциированных молекул.
-
Умение определять силу электролита в зависимости от степени диссоциации.
-
Развивать умение учащихся на основе теоретических знаний сравнивать, анализировать, обобщать, логически рассуждать, делать выводы, развивать устную речь.
Воспитательные:
-
Воспитывать интерес к знаниям, взаимопомощь, чувство товарищества, коммуникабельность, критичность по отношению к себе и другим, развивать самооценку.
Тип урока: изучение нового материла.
Методы: словесный, наглядный, практический.
Основные термины и понятия: степень ЭД, сильные и слабые электролиты.
Оборудование: прибор для определения электрической проводимости, концентрированные растворы хлорида натрия и уксусной кислоты.
Ход работы:
-
Организационный момент.
-
Актуализация знаний
1.Фронтальный опрос.
- Сформулируйте определение кислот с точки зрения теории ЭД.
- В чем сущность взаимодействия кислоты с водой?
- Сформулируйте определение оснований с точки зрения ТЭД.
- В чем сущность взаимодействия оснований с водой?
- Сформулируйте определение солей с точки зрения ТЭД.
2. Проверка домашнего задания.
Упр. 2 (с.29).
(Вызываю учеников к доске для обработки и закрепления уравнений ступенчатой диссоциации)
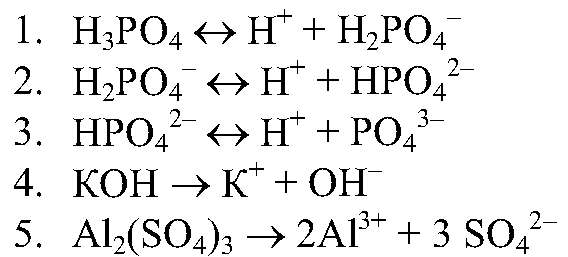
Упр.3 (с.29).
Задание в тетради:
![]()
![]()
![]()
![]() ;
;
![]()
Al2(SO4)3 = 2Al3+ + 3SO42-
Fe(OH)2 = Fe(OH)+ + OH-
Fe(OH)+ = Fe2+ + OH-
Учащиеся часто испытывают трудности при определении зарядов сложных ионов, образующихся при ступенчатой диссоциации. Следует научить их простому правилу.
Зарядность сложного иона изменяется с каждой ступенью на единицу. Проверим это правило для Н3РО4. Заряды ионов кислотных остатков изменяются следующим образом: -1; -2; -3. На первой ступени диссоциации зарядность сложного иона - 1, на второй - 2, на третей - 3. То же относится и к основаниям.
-
Изучение нового материала.
Демонстрация эксперимента по исследованию электропроводности концентрированных растворов хлорида натрия и уксусной кислоты. Учащиеся фиксируют результаты в тетрадях. Далее растворы разбавляются дистиллированной водой. Результаты также фиксируются.)
Сформулируем выводы выполненного эксперимента.
-
Разбавление концентрированного раствора хлорида натрия водой практически не влияет на его электропроводность (лампочка в обоих случаях горела ярко).
- От чего зависит яркость свечения лампочки? ( От числа ионов в растворе: чем их больше, тем ярче горит лампочка.
Вывод. Число ионов в растворе хлорида натрия не зависит от разбавления, то есть даже в концентрированных растворах этот электролит диссоциирует практически полностью на ионы.
-
Разбавление концентрированного раствора уксусной кислоты водой приводит к значительному увеличению его электропроводности, так как яркость свечения лампочки при этом усиливается.
Вывод. Число ионов в растворе уксусной кислоты зависит от разбавления водой. В концентрированных растворах этот электролит диссоциирует незначительно. При разбавлении его водой диссоциация электролита увеличивается. В концентрированных растворах уксусной кислоты содержится мало ионов, при разбавлении раствора число ионов увеличивается.
(Необходимо обратить внимание учеников на тип химической связи в обоих случаях: в хлориде натрия ионная связь, в уксусной кислоте - ковалентная полярная. Затем записывается уравнения диссоциации этих соединений на доске и акцентируется внимание ребят на знаках равенства (первая реакция) и обратимости (вторая реакция).)
NaCl = Na+ + Cl-,
CH3COOH CH3COO- + H+
Уксусная кислота диссоциирует частично. При разбавлении таких растворов равновесие реакции диссоциации смещается вправо, в сторону образования ионов; при увеличении концентрации раствора - влево, в сторону реакции ассоциации. Поэтому в уравнении реакции ставят знак обратимости.
Ассоциация - это процесс, обратный диссоциации.
Диссоциация хлорида натрия не зависит от концентрации раствора, даже в концентрированных растворах этот электролит полностью диссоциирован на ионы, поэтому в уравнении ставится знак равенства.
Вывод. Существуют два типа электролитов. Диссоциация одних зависит от разбавления раствора, других - не зависит. Одни электролиты диссоциируют частично, другие - полностью.
(Вводится понятие о степени электролитической диссоциации и фиксируется формула на доске.)
,
где α (альфа) - степень диссоциации, п - число диссоциированных молекул, N- общее число молекул.
Степень диссоциации равна отношению числа диссоциированных молекул к общему числу молекул в растворе.
Степень диссоциации α может иметь значения от 0 до 1 (или 100%). Таким образом, степень диссоциации является долей диссоциированных молекул.
(Учитель вводит понятия сильный и слабый электролиты. У слабых электролитов степень диссоциации стремится к нулю, а у сильных - к единице (или 100%). Следует отметить некоторую условность этого деления.
У сильных электролитов в растворах нет молекул, только ионы. Приведем несколько примеров: это НСl, HN03, КОН, почти все растворимые соли. У слабых электролитов в растворе присутствуют одновременно и молекулы, и ионы. Соотношение молекул и ионов зависит от степени разбавления. К слабым электролитам, помимо уксусной кислоты, относятся угольная, азотистая кислоты, водный раствор аммиака - гидроксид аммония и др.
(Учитель обобщает сведения о сильных и слабых электролитах в виде таблицы.)
Слабые электролиты
В водных растворах полностью диссоциируют на ионы; молекул электролитов в таких растворах нет
В водных растворах не полностью диссоциируют на ионы; в таких растворах одновременно содержатся продукты диссоциации и ассоциации (ионы и молекулы электролита)
а -> 100%
а -> 0
Примеры: щелочи - растворимые основания щелочных и щелочноземельных металлов: LiOH, NaOH, КОН, CsOH, Са(ОН)2, Sr(OH)2, Ва(ОН)2; сильные кислоты: НС1, HBr, HI, H2S04, HNO3, НС104; почти все растворимые соли
Примеры: плохо растворимые в воде основания: Сu(ОН)2, Fe(OH)2, Mg(OH)2 - и щелочь NH4OH; слабые кислоты: Н2С03, H2S, H2S03, HN02, Н3РО4, HF, CH3COOH, H2Si03; вода H20
(Данные таблицы нужны будут учащимся для составления уравнений реакций ионного обмена. Поэтому рекомендуется дать классу задание на дом - выучить формулы сильных и слабых электролитов. Учитель закрепляет знания в ходе выполнения следующих заданий.)
-
Составить уравнения диссоциации сильных электролитов: Ca(N03)2, HN03, LiOH.
-
Составить уравнения диссоциации слабых электролитов: HN02, Fe(OH)2, H2S.
-
Вычислить степень диссоциации электролита (в %), если из:
а) 1000 молекул продиссоциировало 500 (0,5 (в долях), или 50%);
б) 50 молекул продиссоциировало 5 (0,1, или 10%);
в) 1000 молекул продиссоциировало 3 (0,003, или 0,3%). Помните, что перевод долей в проценты осуществляется умножением на 100.
Домашнее задание
-
</ § 8, выполнить упр.1-4 (с. 32).
-
Выучить формулы сильных и слабых электролитов.