- Учителю
- Моделирование урока химии в 8 классе по технологии развития критического мышления
Моделирование урока химии в 8 классе по технологии развития критического мышления
Моделирование урока химии на развитие критического мышления учащихся 8 класса
Тема урока Оксиды: классификация, физические свойства.
Цели и задачи урока:
Обучающие цели:
- сформировать понятие «оксиды»;
- дать представление о классификации оксидов;
- продемонстрировать физические свойства оксидов.
Развивающие цели:
- сформировать умение создавать проблемные ситуации и видеть пути их решения;
- развивать умение аргументировано излагать свою точку зрения.
Воспитательные цели:
- формировать коммуникативность;
- воспитывать социальную компетентность.
Задачи урока:
- развивать образовательную мотивацию путём повышения интереса к процессу обучения и активного восприятия учебного материала;
- формировать информационную грамотность развитием способности к самостоятельной аналитической и оценочной работе с информацией любой сложности;
- способствовать становлению социальной компетентности через формирование коммуникативных навыков и ответственности за знания.
Тип урока: усвоение новых знаний.
Обеспечение урока:
- таблица «Периодическая система химических элементов Д.И.Менделеева»;
- образцы оксидов металлов и неметаллов;
- электронная презентация «Физические свойства оксидов»;
- компьютер, проектор, экран;
- раздаточный материал - карточки с текстом «Оксиды», таблица для анализа текста по приёму INSERT, информационные карточки «Классификация оксидов».
Ход урока
1. Этап вызова (актуализации)
Чтение текста с пометками - применение приема INSERT (инсерт). Этот прием дает возможность по-новому работать с текстом - повторить уже известное, выделить новое, определить вопросы для углубленного изучения, поставить для себя проблемы и определить пути их решения.
На доске написана расшифровка приёма, учащимся предоставлены раздаточные карточки с текстом «Оксиды». Работа в парах. Каждому учащемуся представлена карточка с аналитической таблицей.
Надпись на доске
Дата урока
Тема урока
INSERT:
I - interactive - самоактивизация - "v" - уже знал ;
N - noting - новая информация - "+" - новое;
S - system - системная разметка - "-" - думал иначе;
E - effective - эффективная информация - "?" - не понял, есть вопросы;
R, T }- reading and thinking - чтение и обдумывание.
Карточка 1
Оксиды
Окси́д (о́кисел) - бинарное соединение химического элемента с кислородом. Оксиды - это сложные химические соединения, состоящие из двух элементов, один из которых обязательно кислород.
Оксиды - весьма распространённый тип соединений, содержащихся в земной коре и во Вселенной вообще. Примерами таких соединений являются глина, вода, песок, стекло, хрусталь, углекислый газ. Оксидами также является класс минералов, представляющих собой соединения металла с кислородом.
Общая формула оксидов: ЭmОn (m- число атомов элемента, n- число атомов кислорода). Примеры формул оксидов: K2O, CaO, SO2, P2O5. Формулы оксидов составляются по валентности химического элемента, а валентность кислорода в оксидах - II.
В соответствии с номенклатурой ИЮПАК, оксиды называют словом «оксид», после которого следует наименование химического элемента в родительном падеже, например: Na2O - оксид натрия, Al2O3 - оксид алюминия. Если элемент имеет переменную степень окисления, то в названии оксида указывается его степень окисления римской цифрой в скобках сразу после названия (без пробела). Например, Cu2О - оксид меди(I), CuO - оксид меди(II), FeO - оксид железа(II), Fe2О3 -оксид железа(III), Cl2O7 - оксид хлора(VII).
Часто используют и другие наименования оксидов по числу атомов кислорода: если оксид содержит только один атом кислорода, то его называют монооксидом или моноокисью, если два -диоксидом или двуокисью, если три - то триоксидом или триокисью. Например: монооксид углерода - CO, диоксид углерода - СО2, триоксид серы - SO3.
Также распространены исторически сложившиеся (тривиальные) названия оксидов, например, угарный газ - CO, серный ангидрид - SO3 и др.
Задание
Прочитайте текст, проанализируйте информацию и заполните таблицу «Мои знания об оксидах». Время выполнения задания 10 мин.
Карточка 2
Мои знания об оксидахv - знакомая информация
(это я уже знаю)
+ - новая информация
(это для меня новое)
- -противоречивая информация (я думал иначе)
? - недостаточная информация (об этом хотелось бы узнать больше)
Заполненная таблица является опорным конспектом по теме.
2. Этап реализации (осмысления)
2.1. Обсуждение маркировки текста INSERT сначала в парах, потом в группах и всем классом. Диалогическая беседа. (10 мин).
Вопросы
1. Какие знания, которые вы имели, помогают вам понять новый материал?
2. Какую дополнительную информацию вы получили из текста?
3. Какие вопросы возникли у вас при чтении текста? Каковы пути решения этих вопросов?
2.2. Составление кластера «Классификация оксидов» - 10 мин. Учащиеся объединяются в малые группы по 4-5 человек.
Карточка 3
Классификация оксидов
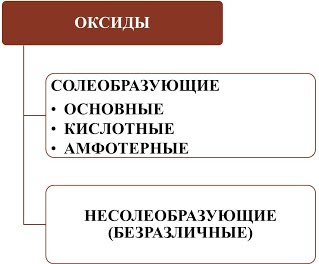
В зависимости от химических свойств различают:
Солеобразующие оксиды:
- основные оксиды (например, оксид натрия Na2O, оксид меди(II) CuO): оксиды металлов, степень окисления которых I-II;
- кислотные оксиды (например, оксид серы(VI) SO3, оксид азота(IV) NO2): оксиды металлов со степенью окисления V-VII и оксиды неметаллов;
- амфотерные оксиды (например, оксид цинка ZnO, оксид алюминия Al2О3): оксиды металлов со степенью окисления III-IV и исключения (ZnO, BeO, SnO, PbO);
Несолеобразующие оксиды: оксид углерода(II) СО, оксид азота(I) N2O, оксид азота(II) NO, оксид кремния(II) SiO.
Все оксиды можно разделить на две группы: солеобразующие (основные, кислотные, амфотерные) и несолеобразующие или безразличные.
 </</span>
</</span>
МехОу
Оксиды неметаллов неМехОу
Основные
Кислотные
Амфотерные
Кислотные
Безразличные
I, II
Ме
V-VII
Me
ZnO,BeO,Al2O3,
Fe2O3, Cr2O3
> II
неМе
I, II
неМе
CO, NO, N2O
2.3. Представление учащимися кластеров. Обсуждение результатов работы.- 5 мин.
Вопросы
1. Какие знания вы использовали при составлении кластера?
2. Что нового вы узнали об оксидах?
2.4. Демонстрация электронной презентации «Физические свойства оксидов», демонстрация образцов оксидов металлов и неметаллов - 5 мин.
Физические свойства оксидов
При комнатной температуре большинство оксидов - твердые вещества (СаО, Fe2O3 и др.), некоторые - жидкости (Н2О, Сl2О7 и др.) и газы (NO, SO2 и др.).
3. Этап рефлексии (консолидации) - 5 мин.
Методический прием «Верные и неверные суждения» - 3 мин
Учащимся предлагаются суждения, из которых они должны выбрать
верные.
Тема «Оксиды»
1. Оксиды - это сложные вещества.
2. Оксиды - это простые вещества.
3. Оксиды состоят из 2-х атомов.
4. Оксиды состоят из атомов 2-х химических элементов.
5. Оксиды образуются при взаимодействии простых веществ металлов с
кислородом.
6. Все оксиды являются твердыми веществами.
7. Оксиды образуются только при взаимодействии простых веществ с
кислородом.
8. Все вещества состоят из атомов 2-х химических элементов.
9. Все вещества, состоящие из атомов двух химических элементов,
одним из которых является кислород называются оксидами.
Подведение итогов урока, домашнее задание - 2 мин.
Домашнее задание
1. Составление сенкана по алгоритму:
1-я строка - одно существительное: главное, о чем идет речь в данной теме; 2-я строка - два прилагательных: описывают изученное явление (представлено в первой строке);
3-я строка - три слова: глаголы или описание действия;
4-я строка - четыре слова: фраза, которая предусматривает личностное отношение к теме;
5-я строка - одно - два слова: синоним к существительному в 1-й строке.
2. работа с опорной таблицей, заполнение памятки по химии,
ответы на возникшие вопросы, чтение материала учебника.