- Учителю
- Комплект контрольно-оценочных средств промежуточной аттестации по химии
Комплект контрольно-оценочных средств промежуточной аттестации по химии
министерство образования, науки и молодежи
РЕСПУБЛИКи КРЫМ
Государственное бюджетное профессиональное образовательное учреждение республики крым
«Ялтинский экономико-технологический колледж»
УтверждЕН
на заседании методического совета
«___»______20____ г., протокол №____
Председатель методического совета
____________________Г.Л.Шеренговская
Комплект
контрольно-оценочных средств
промежуточной аттестации
по учебной дисциплине
ОДп.11 Химия, ОДб.06 Химия, ОДб.06 Химия
основной профессиональной образовательной программы (ОПОП)
по профессиям СПО
19.01.17 (260807.01) Повар, кондитер,
08.01.05 (270802.07) Мастер столярно-плотничных и паркетных работ,
15.01.05 (150709.02) - Сварщик (Электросварочные и газосварочные работы)
Ялта, 2015
|
ОДОБРЕНО на заседании цикловой методической комиссии естественно-математических дисциплин Протокол № ____ от «_____»_______2015г. Председатель комиссии _____________________С.Н. Филлипова |
|
Комплект контрольно-оценочных средств разработан на основе программ учебных дисциплин ОДп.11 Химия, ОДб.06 Химия, ОДб.06 Химия
Разработчик: Острова О.И., преподаватель химии ГБПОУ РК «ЯЭТК»,
Рецензент: Филиппова С.Н., председатель цикловой методической комиссии естественно-математических дисциплин.
I. Паспорт комплекта оценочных средств
-
Область применения комплекта оценочных средств
Комплект оценочных средств предназначен для проведения промежуточной аттестации оценки результатов освоения Химии основной профессиональной образовательной программы (далее ОПОП) по профессиям СПО 19.01.17 (260807.01) Повар, кондитер, 08.01.05 (270802.07) Мастер столярно-плотничных и паркетных работ, 15.01.05 (150709.02) - Сварщик (Электросварочные и газосварочные работы)
В результате освоения учебной дисциплины Химия студент должен обладать предусмотренными ФГОС по профессиям СПО 19.01.17 (260807.01) Повар, кондитер, 08.01.05 (270802.07) Мастер столярно-плотничных и паркетных работ, 15.01.05 (150709.02) - Сварщик (Электросварочные и газосварочные работы) следующими умениями, знаниями, которые формируют профессиональную компетенцию, и общими компетенциями:
знать/понимать:
З 1 роль химии в естествознании, ее связь с другими естественными науками, значение в жизни современного общества;
З 2 важнейшие химические понятия: вещество, химический элемент, атом, молекула, масса атомов и молекул, ион, радикал, аллотропия, нуклиды и изотопы, атомные s-, p-, d-орбитали, химическая связь, электроотрицательность, валентность, степень окисления, гибридизация орбиталей, пространственное строение молекул, моль, молярная масса, молярный объем газообразных веществ, вещества молекулярного и немолекулярного строения, комплексные соединения, дисперсные системы, истинные растворы, электролитическая диссоциация, кислотно-оснóвные реакции в водных растворах, гидролиз, окисление и восстановление, электролиз, скорость химической реакции, механизм реакции, катализ, тепловой эффект реакции, энтальпия, теплота образования, энтропия, химическое равновесие, константа равновесия, углеродный скелет, функциональная группа, гомология, структурная и пространственная изомерия, индуктивный и мезомерный эффекты, электрофил, нуклеофил, основные типы реакций в неорганической и органической химии;
З 3 основные законы химии: закон сохранения массы веществ, закон постоянства состава веществ, Периодический закон Д.И. Менделеева, закон Гесса, закон Авогадро;
З 4 основные теории химии; строения атома, химической связи, электролитической диссоциации, кислот и оснований, строения органических и неорганических соединений (включая стереохимию), химическую кинетику и химическую термодинамику;
З 5 классификацию и номенклатуру неорганических и органических соединений;
З 6 природные источники углеводородов и способы их переработки;
З 7 вещества и материалы, широко используемые в практике: основные металлы и сплавы, графит, кварц, минеральные удобрения, минеральные и органические кислоты, щелочи, аммиак, углеводороды, фенол, анилин, метанол, этанол, этиленгликоль, глицерин, формальдегид, ацетальдегид, ацетон, глюкоза, сахароза, крахмал, клетчатка, аминокислоты, белки, искусственные волокна, каучуки, пластмассы, жиры, мыла и моющие средства;
уметь:
У 1 называть: изученные вещества по «тривиальной» или международной номенклатурам;
У 2 определять: валентность и степень окисления химических элементов, тип химической связи в соединениях, заряд иона, пространственное строение молекул, тип кристаллической решетки, характер среды в водных растворах, окислитель и восстановитель, направление смещения равновесия под влиянием различных факторов, изомеры и гомологи, принадлежность веществ к разным классам неорганических и органических соединений; характер взаимного влияния атомов в молекулах, типы реакций в неорганической и органической химии;
У 3 характеризовать: s-, p-, d-элементы по их положению в Периодической системе Д.И. Менделеева; общие химические свойства металлов, неметаллов, основных классов неорганических и органических соединений; строение и свойства органических соединений (углеводородов, спиртов, фенолов, альдегидов, кетонов, карбоновых кислот, аминов, аминокислот и углеводов);
У 4 объяснять: зависимость свойств химического элемента и образованных им веществ от положения в Периодической системе Д.И. Менделеева; зависимость свойств неорганических веществ от их состава и строения, природу химической связи, зависимость скорости химической реакции от различных факторов, реакционной способности органических соединений от строения их молекул;
У 5 выполнять химический эксперимент по распознаванию важнейших неорганических и органических веществ, получению конкретных веществ, относящихся к изученным классам соединений;
У 6 проводить расчеты по химическим формулам и уравнениям реакций;
У 7 осуществлять самостоятельный поиск химической информации с использованием различных источников (справочных, научных и научно-популярных изданий, компьютерных баз данных, ресурсов Интернета); использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах;
У 8 Связывать: изученный материал со своей профессиональной деятельностью;
У 9 использовать приобретенные знания и умения в практической деятельности и повседневной жизни:
• для понимания глобальных проблем, стоящих перед человечеством: экологических, энергетических и сырьевых;
• объяснения химических явлений, происходящих в природе, быту и на производстве;
• экологически грамотного поведения в окружающей среде;
• оценки влияния химического загрязнения окружающей среды на организм человека и другие живые организмы;
• безопасной работы с веществами в лаборатории, быту и на производстве;
• определения возможности протекания химических превращений в различных условиях и оценки их последствий;
• распознавания и идентификации важнейших веществ и материалов;
-
оценки качества питьевой воды и отдельных пищевых продуктов;
-
критической оценки достоверности химической информации, поступающей из различных источников.
-
ЭЛЕМЕНТЫ ОБЩИХ КОМПЕТЕНЦИЙ:
-
ОК.4. Осуществлять поиск информации, необходимой для эффективного выполнения профессиональных задач
-
ОК.6. Работать в команде, эффективно общаться с коллегами, руководством, клиентами
Формой промежуточной аттестации по учебной дисциплине является дифференцированный зачет.
1.2. Результаты освоения учебной дисциплины, подлежащие проверке
В результате аттестации по учебной дисциплине осуществляется комплексная проверка следующих умений и знаний, а также динамика формирования элементов общих и профессиональных компетенций:
Таблица 1.1
Показатели оценки результата
Номер задания для проверки
Уметь:
У 1. Называть: изученные вещества по тривиальной или международной номенклатуре.
Выполнение, определение, выделение, решение, получение.
Вариант 1: задания: А20,
Вариант 2: задания:
А20,
Вариант 3: задания:
А20,
Вариант 4: задания:
А20,
У 2. Определять: валентность и степень окисления химических элементов, тип химической связи в соединениях, заряд иона, пространственное строение молекул, тип кристаллической решетки, характер среды в водных растворах, окислитель и восстановитель, направление смещения равновесия под влиянием различных факторов, изомеры и гомологи, принадлежность веществ к разным классам неорганических и органических соединений; характер взаимного влияния атомов в молекулах, типы реакций в неорганической и органической химии.
ОК.4. Осуществлять поиск информации, необходимой для эффективного выполнения профессиональных задач
Обоснование, формирование, выполнение, решение, определения, доказательства
Вариант 1: задания А13, А15, А17, А 22
Вариант 2: задания А13, А15, А17, А 22 Вариант 3: задания А13, А15, А17, А 22 Вариант 4: задания А13, А15, А17, А 22
У 3. Характеризовать: s-, p-, d-элементы по их положению в Периодической системе Д.И. Менделеева; общие химические свойства металлов, неметаллов, основных классов неорганических и органических соединений; строение и свойства органических соединений (углеводородов, спиртов, фенолов, альдегидов, кетонов, карбоновых кислот, аминов, аминокислот и углеводов).
Выполнение, создание, формулирование, обоснование, решение.
Вариант 1: задания А1, А4, А11, А12, А14, А10, А8
Вариант 2: задания А1, А4, А11, А12, А14, А10, А8
Вариант 3: задания А1, А4, А11, А12, А14, А10, А8
Вариант 4: задания А1, А4, А11, А12, А14, А10, А8
У 4. Объяснять: зависимость свойств химического элемента и образованных им веществ от положения в Периодической системе Д.И. Менделеева; зависимость свойств неорганических веществ от их состава и строения. Природу химической связи (ионной ковалентной, металлической и водородной), зависимость скорости химической реакции от различных факторов, и положение химического равновесия от различных факторов, реакционной способности органических соединений от строения их молекул.
Нахождение, доказательство, определение, решение.
Вариант 1: задания В1
Вариант 2: задания В1 Вариант 3: задания В1 Вариант 4: задания В1
У 5. Выполнять химический эксперимент: по распознаванию важнейших неорганических и органических соединений; получению конкретных веществ, относящихся к изученным классам соединений.
ОК.6. Работать в команде, эффективно общаться с коллегами, руководством, клиентами
Доказательства, определение, решение, выполнение, демонстрация, получение, изготовление.
Вариант 1: заданияА21
Вариант 2: заданияА21 Вариант 3: заданияА21 Вариант 4: заданияА21
У 6. Осуществлять самостоятельный поиск химической информации с использованием различных источников (научно-популярных изданий, компьютерных баз данных, ресурсов Интернета); использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах.
Нахождение, определение, доказательства, решение, выполнение, создание.
Вариант 1: задания часть В
Вариант 2: задания часть В
Вариант 1: задания часть В
Вариант 3: задания часть В
Вариант 4: задания часть В
У 7. Решать: расчетные задачи по химическим формулам и уравнениям; проводить: расчеты по химическим формулам и уравнениям реакций.
ОК 6. Работать в коллективе и команде, эффективно общаться с коллегами, руководством, потребителями.
Выполнение, создание, получение, нахождение, решение.
Вариант 1: часть В
Вариант 2: часть В Вариант 3: часть В Вариант 4: часть В
У 8. Связывать: изученный материал со своей профессиональной деятельностью.
Доказательство, определение, нахождение, обоснование.
Вариант 1: задания С1, А7
Вариант 2: задания С1, А7
Вариант 3: задания С1, А7
Вариант 4: задания С1, А7
У 9. Использовать приобретенные знания и умения в практической деятельности и повседневной жизни.
Нахождение, выполнение, формулирование, доказательство, решение, получение.
Вариант 1: задания В2
Вариант 2: задания В2 Вариант 3: задания В2 Вариант 4: задания В2
Знать:
З 1.
важнейшие химические понятия, теории и законы химии.
Формулирование, нахождение, выполнение, получение, решение.
Вариант 1: задания А9,
А18
Вариант 2: задания А9,
А18
Вариант 3: задания А9,
А18
Вариант 4: задания А9,
А18
З 2.
классификацию и номенклатуру неорганических и органических соединений;
Выполнение, определение, выделение, решение, получение.
Вариант 1: задания А5, А6,
Вариант 2: задания А5, А6,
Вариант 3: задания А5, А6,
Вариант 4: задания А5, А6
З 3.
важнейшие вещества и материалы
Определение, выделение, демонстрация, выполнение, создание, решение.
Вариант 1: задания А2, А3, А16
Вариант 2: задания А2, А3, А16
Вариант 3: задания А2, А3, А16
Вариант 4: задания А2, А3, А16
З 4.
безопасное обращение с горючими и токсичными веществами и лабораторным оборудованием;
Выделение, демонстрация, определение, решение, получение.
Вариант 1: задания В
Вариант 2: задания В
Вариант 3: задания В
Вариант 4: задания В
З 5.
приготовления растворов заданной концентрации в быту и на производстве
Выделение, демонстрация, определение, решение, получение.
Вариант 1: задания В,
Вариант 2: задания В,
Вариант 3: задания В,
Вариант 4: задания В,
З 6.
критически оценивать достоверность химической информации, поступающей из разных источников
Доказательство, выделение, определение, нахождение, обоснование.
Вариант 1: заданияА22
Вариант 2: заданияА22 Вариант 3: заданияА22 Вариант 4: заданияА22
З 7.
роль химии в естествознании, ее связь с другими естественными науками, значение в жизни современного общества;
Выделение, определение, нахождение, обоснование.
Вариант 1: задания А18, А19
Вариант 2: задания А18, А19
Вариант 3: задания А18, А19
Вариант 4: задания А18, А19
З 8.
природные источники углеводородов и способы их переработки;
Выполнение, демонстрация, выделение, получение, решение.
Вариант 1: задания В,
Вариант 2: задания В, Вариант 3: задания В, Вариант 4: задания В,
2. Комплект оценочных средств1
2.1. Комплект материалов для оценки сформированности знаний и умений по учебной дисциплине (задания для дифференцированного зачета)
Примерные тесты для зачета
Вариант 1
На выполнение заданий отводится 90 минут. Работа состоит из двух частей. Часть А содержит 22 заданий, в которых надо выбрать правильный ответ или ответы из четырех предложенных (подробнее смотри инструкцию к каждому вопросу). За каждый правильный ответ - 1 балл. Часть В содержит задание с открытым ответом, задания оцениваются по 5 баллов.
Часть А:
1. Одноосновная бескислородная кислота (1 бал)
А) H2S Б) H2CO3 В) HF Г) HNO3
2. Сумма коэффициентов в полном ионном уравнении BaCl2 + H2SO4=
(1 бал)
А) 11 Б) 10 В) 7 Г) 9
3. Коэффициенты перед AlCL3 и NH4Cl в уравнении реакции NH4NO3 + AlCL3 = Al(NO3)3 + NH4Cl соответственно равны… (1 бал)
А) 1 и 2 Б) 1 и 3 В) 3 и 1 Г) 2 и 1
4. Элементы только побочных подгрупп находятся в ряду (1 бал)
А) Sc, Mo, W Б) Ta, Ca, Mn В) As, Br, Cr Г) Sb, Co, Ge
5. Металлические свойства убывают в ряду (1 бал)
А) Ge, Sn, Pb Б) Sr, Y, Mo В) Tc, Nb, Sr Г) K, Rb, Cs
6. Самый активный неметалл (1 бал)
А) At Б) F В) B Г) Si
7. Максимальная валентность атома Se равна (1 бал)
А) 2 Б) 4 В) 8 Г) 6
8. Относительная молекулярная масса K2S (1 бал)
А) 71 Б) 110 ат. ед. м. В) 110 Г) 71 ат. ед. м.
9. Электронное строение атома калия соответствует выражению (1 бал)
А) 1S22S22P63S23P64S1 Б) 1S22S22P63S23P63d1
В) 1S22S22P63S23P7 Г) 1S22S22P63S23P64S2
10. Количество элементов в 5 периоде (1 бал)
А) 18 Б) 32 В) 8 Г) 24
11. Максимальное число электронов на р-орбиталях: (1 бал)
А) 2; Б) 6; В) 10; Г) 14.
12. Число нейтронов в атоме цинка равно: (1 бал)
А) 65; Б) 22; В) 30; Г) 35.
13. В периоде слева направо уменьшается (1 бал)
А) число уровней Б) число валентных электронов
В) радиус атома Г) активность неметаллов
14. Степень окисления атома углерода в соединении Ca(ClO2)2 равна
(1 бал)
А ) -4 Б) -3 В) +4 Г) +3
15. Сумма коэффициентов в полном ионном уравнении реакции
взаимодействия хлорида кальция и нитрата серебра (1 бал)
А) 10 Б) 8 В) 14 Г) 12
16. Сокращённое ионное уравнение: Fe2+ + 2OH- = Fe (OH)2 соответствует взаимодействию (1 бал)
А) FeCO3 + 2NaOH В) Fe(NO3)2 + 2NaOH С) FeSiO3 + LiOH
D) FeCl2 + Cu(OH)2 Е) FeS+ 2KOH
17. Изомером бутина-2 является вещество: (1 бал)
A) СН2=СН - С2Н5
Б) СН3 - СН - СН3
│
СН3
В) НС ≡С - С2Н5
Г) Н2С = СН - СН2 - СН3
18. При повышении давления химическое равновесие сместится в сторону исходных веществ в системе… (1 бал)
А)2SO2 + O2![]() 2SO3 +Q
2SO3 +Q
Б) CH4 + H2O ![]() CO + 3H2 - Q
CO + 3H2 - Q
В) CO + 2H2![]() CH3OH + Q
CH3OH + Q
Г) 4HCl + O2![]() 2H2O
+ Cl2 + Q
2H2O
+ Cl2 + Q
19. «Бесцветная жидкость с резким запахом, легче воды, хорошо растворим в воде, гигроскопичен, обладает бактерицидными свойствами» - данные свойства соответствуют: (1 бал)
А) бензол Б) этиловый спирт В) сахароза Г) бензол
20. Название вещества (1 бал)
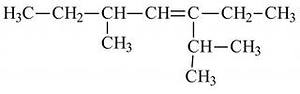
а) 3 метал 5 пропил гептан б) 3 пропил 5 метил гептен3
в) 3 пропил 5 метил гептан г) 2, 5 диметил 3этил гептен 3
21. (Выбрать несколько вариантов ответа)С какими веществами взаимодействует HNO3 (1 бал)
а) HCL б) Mg в) P2O5 г) Fe2O3
22. (Выбрать несколько вариантов ответа)Выбрать кислоты: (1 бал)
А) MgCl2 Б) Al(OH)3 В) H3PO4 Г) HF Д) NaOH Е) CO2
Часть В: задания с открытым ответом (по 4 балла за каждый вопрос)
-
Дайте характеристику непредельным углеводородам ( общая формула и химическое строение гомологов данного ряда. Свойства и применение этилена).
-
Дайте понятие химической связи, расскажите о её видах
Шкала перевода балловВариант 2
На выполнение заданий отводится 90 минут. Работа состоит из двух частей. Часть А содержит 22 заданий, в которых надо выбрать правильный ответ или ответы из четырех предложенных (подробнее смотри инструкцию к каждому вопросу). За каждый правильный ответ - 1 балл. Часть В содержит задание с открытым ответом, задания оцениваются по 5 баллов.
Часть А
1. Двухосновная бескислородная кислота (1балл)
А) HNO3 Б) H2SO4 В) H2S Г) HCl
2. Сумма коэффициентов в полном ионном уравнении CuSO4 + NaOH=
(1балл)
А) 9 Б) 8 В) 10 Г) 12
3. Коэффициенты перед Na2SO4 и NaCl в уравнении реакции Na2SO4 + KCL = K2SO4 + NaCl соответственно равны… (1балл)
А) 2 и 1 Б) 2 и 2 В) 1 и 2 Г) 1 и 1
4. Элементы только главных подгрупп находятся в ряду (1балл)
А) P, Te, W Б) Sn, K, Al В) Ca, Sc, Ga Г) Ag, Cu, Na
5. Неметаллические свойства увеличиваются в ряду (1балл)
А) As, Sb, Br Б) Sn, Sb, I В) Ti, Sc, Ca Г) Cu, Ag, Au
6. Самый активный металл (1балл)
А) K Б) Ca В) Fe Г) Ba
7. Массовая доля магния в MgI2 (1балл)
А) 18,5 % Б) 15,8 % В) 50 % Г) 63%
8. Максимальная валентность атома Ga равна (1балл)
А) 5 Б) 2 В) 1 Г) 3
9. Относительная молекулярная масса Na2O (1балл)
А) 62 ат. ед. м. Б) 39 ат. ед. м. В) 62 Г) 39
10. Электронное строение атома серы соответствует выражению (1балл)
А) 1S22S22P63S23P5 Б) 1S22S22P63S23P6
В) 1S22S22P63S23P4 Г) 1S22S22P63S13P5
11. Количество элементов в 6 периоде (1балл)
А) 18 Б) 32 В) 24 Г) 8
12. Максимальное число электронов на четвертом энергетическом уровне: (1балл)
А) 14; Б) 32; В) 26; Г) 18.
13. Число нейтронов в атоме марганца равно: (1балл)
А) 25; Б) 29; В) 30; Г) 55.
14. В группе сверху вниз уменьшается (1балл)
А) высшая степень окисления Б) число валентных электронов
В) радиус атома Г) активность неметаллов
15. Степень окисления атома углерода в соединении C2H5NH2 равна (1балл)
А) -2 Б) - 4 В) +1 Г) +4
16. Сокращённое ионное уравнение: Cu2+ + 2OH- = Cu(OH)2 соответствует взаимодействию (1балл)
А) CuCO3 + 2NaOH Б) CuSiO3 + LiOH
В) CuCl2 + Fe(OH)2 Г) Cu(NO3)2 + 2NaOH
17. Изомером бутена-2 является вещество: (1балл)
A) CH3 - CН2 - CH2 - CH3 В) СН3 - СН2 - СН = СН2
Б) СН3 - СН - СН3 Г) СН3 - СН - СН = СН2
Р Р
СН3 СН3
18. Изменение давления практически не влияет на смещение химического равновесия в системе.. (1балл)
А) N2 + 3H2![]() 2NH3
2NH3
Б) 2H2 + O2![]() 2H2O
2H2O
В) H2 + Cl2![]() 2HCl
2HCl
Г) SO2 + Cl2![]() SO2Cl2
SO2Cl2
19 . «Бесцветный газ, легче воздуха, не имеет запаха, входит в состав природного газа» - данные свойства соответствуют: (1балл)
А) этилен Б) нефть В) глицерин Г) бензол
20. Название вещества (1балл)
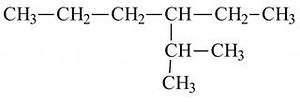
а) 3метил гексан б) 4 пропил гексан
в) 3 пропил гексан г) 2 метил 3 этил гексан
21. (Выбрать несколько вариантов ответа) С какими веществами взаимодействует Na2O (1балл)
а) KOH б) HNO3 в) KCl г) H2O
22. (Выбрать несколько вариантов ответа) Выбрать соли. (1балл)
А) Ba(NO3)2 Б) AL2O3 В) P2O5 Г) AL(OH)3
Д) MgCL2 Е) Fe(OH)3
Часть В: задания с открытым ответом
-
Назовите основные положения теории химического строения органических веществ А. М. Бутлерова.
-
Сформулируйте периодический закон и расскажите о периодической системе химических элементов Д. И. Менделеева на основе представлений о строении атомов. Каково значение периодического закона для развития науки.
Шкала перевода баллов
Вариант 3
На выполнение заданий отводится 90 минут. Работа состоит из двух частей. Часть А содержит 22 заданий, в которых надо выбрать правильный ответ или ответы из четырех предложенных (подробнее смотри инструкцию к каждому вопросу). За каждый правильный ответ - 1 балл. Часть В содержит задание с открытым ответом, задания оцениваются по 5 баллов.
Часть А
1. Двухосновная кислородсодержащая кислота (1балл)
А) H2S Б) H3PO4 В) H2CO3 Г) HF
2. Сумма коэффициентов в полном ионном уравнении Ba(NO3)2 + H2SO4= (1балл)
А) 11 Б) 10 В) 12 Г) 9
3. Коэффициенты перед Na2SO4 и NaCl в уравнении реакции Na2SO4 + BaCL2 = BaSO4 + NaCl соответственно равны… (1балл)
А) 1 и 2 Б) 2 и 1 В) 2 и 2 Г) 1 и 1
4. Элементы только побочных подгрупп находятся в ряду
А) Sc, Ti, As Б) Zr, Na, In В) Co, Ag, Au Г) Fe, Os, I
5. Металлические свойства увеличиваются в ряду ( 1балл)
А) Ra, Ba, Ca Б) K, Cs, Fr В) Sc, Ti, V Г) Bi, Sb, As
6. Менее активный неметалл (1балл)
А) O Б) At В) S Г) Cl
7. Массовая доля кислорода в Ca(OH)2 (1балл)
А) 27 % Б) 68,2 % В) 70 % Г) 54%
8. Максимальная валентность атома Br равна (1балл)
А) 3 Б) 5 В) 4 Г) 7
9. Относительная молекулярная масса BaCl2 (1балл)
А) 172,5 Б) 172,5 ат. ед. м. В) 208 Г) 208 ат. ед. м.
10. Электронное строение атома скандия соответствует выражению (1балл)
А) 1S22S22P63S23P64S3 Б) 1S22S22P63S23P64S24P1
В) 1S22S22P63S23P7 4S23d1 Г) 1S22S22P63S23P64S24P2
11. Количество элементов в побочной подгруппе 8 группы (1балл)
А) 11 Б) 6 В) 10 Г) 5
12. Максимальное число электронов на d - орбиталях: (1балл)
А) 14; Б) 10; В) 6; Г) 2.
13. Число нейтронов в атоме ниобия равно: (1балл)
А) 42 Б) 41 В) 52 Г) 24
14. В периоде слева направо уменьшается(1балл)
А) число уровней Б) число валентных электронов
В) радиус атома Г) активность неметаллов
15. Степень окисления атома углерода в соединении Вa(NO3)2 равна (1балл)
А) +3 Б) -3 В) +5 Г) -5
16. Сокращённое ионное уравнение: 2H++CO32- =H2O+CO2 соответствует взаимодействию (1балл)
А) CaCO3 + 2HCl Б) Na2CO3 + H2SiO3 В) CaCO3 + H2SiO3
Г) Na2CO3 + 2HCl Д) BaCO3 + 2HCl
17. Изомером пентадиена-2,3 является вещество: (1балл)
А) СН2 = СН - СН2 - СН2 - СН3
Б) СН3
│
СН3 - СН - СН = СН2
В) СН3 - С = СН2
│
СН - СН3
Г) СН2 = СН - СН2 - СН=СН2
18. При увеличении общего давления равновесие сместится в сторону продуктов в реакции… (1балл)
А) H2 + Br2![]() HBr
HBr
Б ) 2NH3![]() N2
+ 3H2
N2
+ 3H2
В) C2H6![]() C2H4
+ H2
C2H4
+ H2
Г) 2SO2 + O2![]() 2SO3
2SO3
19. «Твердое волокнистое вещество, входящее в состав растений, образуя в них оболочки клеток, вещество не растворимое в воде и в обычных органических растворителях является сырьем для производства ацетатного волокна» - данные свойства соответствуют: (1балл)
А) полиэтилен Б) каучук В) целлюлоза Г) бензол
20 . Название вещества (1балл)
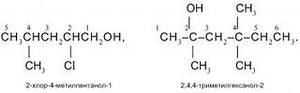
а) 2,4 диметил гексанол 2,4 б) 3,5 диметил гексанол 3,5
в) 2 метил гексанол 2,5 г) 2, 4, 4 три метил гексанол 2
21. (Выбрать несколько вариантов ответа) С какими веществами взаимодействует NaOH (1балл)
а) Al2O3 б) H2SO4 в) H2O г) CuCl2
22. (Выбрать несколько вариантов ответа) Выбрать оксиды. (1балл)
А) Al(OH)3 Б) SO2 В) MgCl2 Г) K2SiO3
Д) Fe2O3 Е) CaSO4
Часть В: задания с открытым ответом
-
Охарактеризуйте ацетилен, его свойства, получение и применение.
-
Какие типы химических реакций выделяют в неорганической химии, дайте им характеристику.
Шкала перевода баллов
Вариант 4
На выполнение заданий отводится 90 минут. Работа состоит из двух частей. Часть А содержит 22 заданий, в которых надо выбрать правильный ответ или ответы из четырех предложенных (подробнее смотри инструкцию к каждому вопросу). За каждый правильный ответ - 1 балл. Часть В содержит задание с открытым ответом, задания оцениваются по 5 баллов.
Часть А
1. Одноосновная кислородсодержащая кислота ( 1 балл)
А) H3PO4 Б) HBr В) HNO2 Г)H2SiO3
2. Сумма коэффициентов в полном ионном уравнении NaNO3 + Fe(OH)3= ( 1 балл)
А) 13 Б) 12 В) 15 Г) 17
3. Коэффициенты перед NaI и Na2SO4 в уравнении реакции NaI + MgSO4 = MgI2 + Na2SO4 соответственно равны… ( 1 балл)
А) 1 и 2 Б) 2 и 1 В) 2 и 2 Г) 1 и 1
4. Элементы только главных подгрупп находятся в ряду ( 1 балл)
А) Se, Br, Co Б) Ga, Ge, Zr В) Ba, Rb, Cu Г) Ra, Sr, Be
5. Неметаллические свойства уменьшаются в ряду ( 1 балл)
А) Ca, Sr, Ba Б) Cl, S, Si В) Cl, Br, I Г) B, N, F
6. Менее активный металл ( 1 балл)
А) Na Б) Rb В) Mg Г) Ti
7. Массовая доля кислорода в H2CO3 ( 1 балл)
А) 54% Б) 25,8 % В) 60 % Г) 77,4%
8. Максимальная валентность атома Rb равна ( 1 балл)
А) 6 Б) 3 В) 5 Г) 1
9. Относительная молекулярная масса AlCl3 ( 1 балл)
А) 98 Б) 98 ат. ед. м. В) 133,5 Г) 133,5 ат. ед. м.
10. Электронное строение атома кремния соответствует выражению
( 1 балл)
А) 1S22S22P63S23P2 Б) 1S22S22P63S23P6
В) 1S22S22P63S13P3 Г) 1S22S22P63S13P5
11. Количество элементов в главной подгруппе 6 группы ( 1 балл)
А) 7 Б) 4 В) 5 Г) 6
12. Максимальное число электронов на третьем энергетическом уровне: ( 1 балл)
А) 14; Б) 6; В) 10; Г) 18.
13. Число нейтронов в атоме железа равно: ( 1 балл)
А) 56 Б) 30 В) 26; Г) 36
14. В группе сверху вниз увеличивается ( 1 балл)
А) число уровней Б) число валентных электронов
В) высшая степень окисления Г) активность неметаллов
15. Степень окисления атома углерода в соединении KMnO4
равна
( 1 балл)
А) +5 Б) + 7 В) -7 Г) +3
16. Кратное ионное уравнение к данной реакции Al(NO3)3 + 3KOH=AL(OH)3 +3KNO3 ( 1 балл)
A)Cu2++2OH-=Cu(OH)2 Б)H++OH-=HOH В)Al3++3OH-=Al(OH)3
Г)Cu2++S2-=CuS Д)Fe2++2OH-=Fe(OH)2
17. Изомером пентена-2 является вещество: ( 1 балл)
A) CH3 - CН2 - CH2 - CH2 - CH3 В) СН3 - CH2 -СН2 - СН = СН2
Б) СН3 - СН - CH2 - СН3 Г) СН3 - СН - CH2 - СН = СН2
Р Р
СН3 СН3
18. При уменьшении общего давления равновесие сместится в сторону продуктов в реакции… ( 1 балл)
А) Н2 + I2 ![]() 2НI
2НI
Б) C2H6 ![]() C2H4 + H2
C2H4 + H2
В) FeS ![]() Fe + S
Fe + S
Г) 2SO2 + O2 ![]() 2SO3
2SO3
19. «Твердое вещество, важнейшее свойство его -эластичность, а также устойчивость к истиранию, водо и газонепроницаемость» - данные свойства соответствуют: ( 1 балл)
А) полиэтилен Б) каучук В) целлюлоза Г) Бензол
20. Название вещества ( 1 балл)
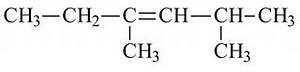
а) 2 метил 4 этил пентен3 б) 3, 5 диметил гексен 3
в) 2 этил 4 метил пентен 2 г) 2, 4 диметил гексен 3
21. (Выбрать несколько вариантов ответа) С какими веществами взаимодействует Ва(OH)2 ( 1 балл)
а) Al2O3 б) H2SO4 в) H2O г) CuCl2
22. (Выбрать несколько вариантов ответа) Выбрать основания. ( 1 балл)
А) AlCl3 Б) Mg(OН)2 В) SO3 Г) Cu(NO3)2
Д) Fe(OH)3 Е) KF
Часть В: задания с открытым ответом
-
Дайте понятие альдегидам, опишите их химическое строение и свойства. Каковы области применения муравьиного и уксусного альдегидов.
-
Дайте характеристику кислотам, основаниям и солям их классификации и свойствам на основе представлений об электролитической диссоциации.
Шкала перевода баллов
ПАКЕТ ПРЕПОДАВАТЕЛЯ
Показатели оценки результатов освоения знаний и умений (Часть А)Максимальное количество баллов - 1
правильно выбран ответ - 1 балл
В задании А2 правильно выбраны сумма коэффициентов в полном ионном уравнении
Максимальное количество баллов - 1
правильно выбран ответ - 1 балл
В задании А3 правильно выбраны коэффициенты, стоящие перед формулами в уравнении реакции
Максимальное количество баллов - 1
правильно выбран ответ - 1 балл
В задании А4 правильно выбраны элементы побочных подгрупп
Максимальное количество баллов - 1
правильно выбран ответ - 1 балл
В задании А5 правильно выбран ряд в котором убывают или усиливаются металлические свойства
Максимальное количество баллов - 1
правильно выбран ответ - 1 балл
В задании А6 правильно выбран самый активный или неактивный металл
Максимальное количество баллов - 1
правильно выбран ответ - 1 балл
В задании А7 правильно выбрана максимальная валентность атома
Максимальное количество баллов - 1
правильно выбран ответ - 1 балл
В задании А8 правильно выбрано относительная молекулярная масса
Максимальное количество баллов - 1
правильно выбран ответ - 1 балл
В задании А9 правильно выбрано электронное строение атома
Максимальное количество баллов - 1
правильно выбран ответ - 1 балл
В задании А10 правильно выбрано количество элементов в группе, периоде
Максимальное количество баллов - 1
правильно выбран ответ - 1 балл
В задании А11 правильно выбрано максимальное количество электронов на орбиталях
Максимальное количество баллов - 1
правильно выбран ответ - 1 балл
В задании А12 правильно выбрано число протонов нейтронов и электронов
Максимальное количество баллов - 1
правильно выбран ответ - 1 балл
В задании А13 правильно выбрано свойство, изменяющееся в периоде или группе
Максимальное количество баллов - 1
правильно выбран ответ - 1 балл
В задании А14 правильно выбрано степень окисления элемента
Максимальное количество баллов - 1
правильно выбран ответ - 1 балл
В задании А15 правильно выбрана сумма коэффициентов в полном ионном уравнении реакции
Максимальное количество баллов - 1
правильно выбран ответ - 1 балл
В задании А16 правильно выбрано уравнение реакции, которому соответствует сокращенное
Максимальное количество баллов - 1
правильно выбран ответ - 1 балл
В задании А17 правильно выбран изомер к данному веществу
Максимальное количество баллов - 1
правильно выбран ответ - 1 балл
В задании А18 правильно выбрано уравнение в котором происходит смещение химического равновесия
Максимальное количество баллов - 1
правильно выбран ответ - 1 балл
В задании А19 правильно выбрано вещество в соответствии с данными свойствами
Максимальное количество баллов - 1
правильно выбран ответ - 1 балл
В задании А 20 правильно выбрано название углеводорода
Максимальное количество баллов - 1
правильно выбран ответ - 1 балл
В задании А21 правильно выбраны вещества, с которыми взаимодействует данное
Максимальное количество баллов - 1
правильно выбраны все ответы - 1 балл
В задании А22 правильно выбраны кислоты, основания, соли, оксиды
Максимальное количество баллов - 1
правильно выбран ответ - 1 балл
Показатели оценки результатов освоения знаний и умений (Часть А)
«5» баллов за каждый теоретических вопросов ставится, если в ответе обучающегося присутствуют важнейшие понятия, раскрывающие содержание данной темы (основные законы и теории химии, закономерности протекания химических реакций и др.), а степень их раскрытия соответствует тому уровню, который предусмотрен государственным образовательным стандартом. Ответ демонстрирует овладение экзаменуемым ключевыми умениями, отвечающими требованиям стандарта к уровню подготовки выпускников (грамотное владение химическим языком; использование химической номенклатуры - «тривиальной» или международной; умение классифицировать вещества и реакции, терминологически грамотно характеризовать любой химический процесс, объяснять обусловленность свойств и применения веществ их строением и составом, сущность и закономерность протекания изученных видов реакций).
«4» балла ставится, если в ответе обучающегося присутствуют важнейшие понятия, раскрывающие содержание данной темы, но при их раскрытии допущены неточности, которые свидетельствуют о недостаточном уровне овладения отдельными ключевыми умениями (ошибки при определении классификационных признаков веществ, использовании номенклатуры, написании уравнений химических реакций и т.п.).
«3» балла ставится, если в ответе отсутствуют некоторые понятия, необходимые для раскрытия основного содержания темы, проявляется недостаточная системность знаний или недостаточный уровень владения соответствующими ключевыми умениями.
«1»-«2» балла ставится, если учащийся уходит от темы или пытается подменить ее другой, которой владеет лучше, при этом присутствуют некоторые понятия, необходимые для раскрытия основного содержания темы
«0» баллов ставится, если ответ отсутствует.
Время на подготовку и выполнение
Условия проведения.
На выполнение контрольной работы отводится 90 минут. Работа состоит из двух частей. Часть А содержит 22 заданий, в которых надо выбрать правильный ответ или ответы из четырех предложенных (подробнее смотри инструкцию к каждому вопросу). За каждый правильный ответ - 1 балл. Часть В содержит 2 задания теоретического уровня с открытым ответом, каждый вопрос оценивается в 5 баллов.
Шкала перевода баллов
Ответы
Часть АВариант
Задание
1
2
3
4
№1
в
в
в
в
№2
а
в
а
г
№3
б
в
а
б
№4
а
б
в
г
№5
б
б
б
б
№6
б
г
б
а
№7
г
г
г
г
№8
в
в
в
в
№9
а
в
в
а
№10
а
б
а
г
№11
б
б
б
г
№12
г
в
г
б
№13
в
г
в
г
№14
г
а
в
б
№15
г
г
б
а
№16
в
г
г
в
№17
в
в
г
в
№18
б
в
г
б
№19
б
а
в
б
№20
г
г
г
г
№21
бг
бг
бг
бг
№22
вг
ад
бд
бд
Ответы на вопросы части В
Вариант 1
-
Дайте характеристику непредельным углеводородам ( общая формула и химическое строение гомологов данного ряда. Свойства и применение этилена).
Алкены - углеводороды, содержащие в молекуле одну двойную связь между атомами углерода, а качественный и количественный состав выражается общей формулой
СnН2n, где n ≥ 2.
Алкены относятся к непредельным углеводородам, так как их молекулы содержат меньшее число атомов водорода, чем насыщенные.
Строение двойной связи С=С
Двойная связь является сочетанием s- и p-связей (хотя она изображается двумя одинаковыми черточками, всегда следует учитывать их неравноценность). s-Связь возникает при осевом перекрывании sp2-гибридных орбиталей, а p-связь - при боковом перекрывании р-орбиталей соседних атомов углерода. p-связь менее прочная вследствие меньшей эффективности перекрывания р-орбиталей.
Гомологический ряд алкенов
По систематической номенклатуре названия алкеновых углеводородов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса -ан на -ен: 2 атома С этан этен; 3 атома С пропан пропен и т.д.
Главная цепь выбирается таким образом, чтобы она обязательно включала в себя двойную связь (т.е. она может быть не самой длинной). Нумерацию углеродных атомов начинают с ближнего к двойной связи конца цепи. Цифра, обозначающая положение двойной связи, ставится обычно после суффикса -ен.
Физические свойства
Алкены плохо растворимы в воде, но хорошо растворяются в органических растворителях.
С увеличением молекулярной массы алкенов, в гомологическом ряду, повышаются температуры кипения и плавления, увеличивается плотность веществ.
Получение алкенов
В природе алкены встречаются в значительно меньшей степени, чем предельные углеводороды, по-видимому, вследствие своей высокой реакционной способности. Поэтому их получают с использованием различных реакций.
I. Крекинг алканов:
CnH2n+2 CmH2m + CpH2p+2, где m + p = n
Например:
С7Н16 СН3СН=СН2 + С4Н10
II. Отщепление (элиминирование) двух атомов или групп атомов от соседних атомов углерода с образованием между ними -связи.
1. Дегидрогалогенирование моногалогеналканов при действии спиртового_раствора щелочи :
СН3СНBrCH3 + KOH (спирт) CH3CH=CH2 + KBr + H2O
2. Дегидратация спиртов при t > 150 C в присутствии водоотнимающих реагентов H2SO4
CH3CH2OH CH2=CH2 + H2O
СH3CHOHCH2CH3 CH3CH=CHCH3 + H2O
Реакции элиминирования идут в соответствии с правилом Зайцева:
Отщепление атома водорода в реакциях дегалогенирования и дегидратации происходит преимущественно от наименее гидрогенизированного атома углерода.
Современная формулировка: реакции отщепления идут с образованием более замещенных при двойной связи алкенов. Такие алкены обладают более низкой энергией.
3. Дегалогенирование дигалогеналканов, имеющих атомы галогена у соседних атомов углерода, при действии активных металлов:
СH2BrCHBrCH3 + Mg CH2=CHCH3 + MgBr2
4. Дегидрирование алканов при 500 С:
Cr2O3
СH3CH2CH3 CH3CH=CH2 + Н2
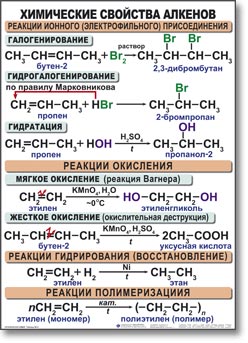
Так, в реакции HCl c пропиленом из двух возможных структурных изомеров 1-хлорпропана и 2-хлорпропана, образуется последний:
CH2=CHСН3 + HCl СН3CHCl CH3
пропилен 2-хлорпропан
-
Дайте понятие химической связи, расскажите о её видах
♦ По числу и составу исходных и полученных веществ химические реакции бывают:
-
Соединения - из двух или нескольких веществ образуется одно сложное вещество:
Fe + S = FeS
(при нагревании порошков железа и серы образуется сульфид железа) -
Разложения - из одного сложного вещества образуется два или несколько веществ:
2H2O = 2H2 + O2
(вода разлагается на водород и кислород при пропускании электрического тока) -
Замещения - атомы простого вещества замещают один из элементов в сложном веществе:
Fe + CuCl2 = Cu↓ + FeCl2
(железо вытесняет медь из раствора хлорида меди (II)) -
Обмена - 2 сложных вещества обмениваются составными частями:
HCl + NaOH = NaCl + H2O
(реакция нейтрализации - соляная кислота реагирует с гидроксидом натрия с образованием хлорида натрия и воды)
♦ Реакции, протекающие с выделением энергии (тепла), называются экзотермическими. К ним относятся реакции горения, например серы:
S + O2 = SO2 + Q
Образуется оксид серы (IV), выделение энергии обозначают + Q
Реакции, требующие затрат энергии, т. е. протекающие с поглощением энергии, называются эндотермическими. Эндотермической является реакция разложения воды под действием электрического тока:
2H2O = 2H2 + O2 − Q
♦ Реакции, сопровождающиеся изменением степеней окисления элементов, т. е. переходом электронов, называются окислительно-восстановительными:
Fe0 + S0 = Fe+2S−2
Противоположностью являются электронно-статичные реакции, часто их называют просто реакции, протекающие без изменения степени окисления. К ним относятся все реакции обмена:
H+1Cl−1 + Na+1O−2H+1 = Na+1Cl−1 + H2+1O−2
Вариант 2
-
Назовите основные положения теории химического строения органических веществ А. М. Бутлерова.
Теория химического строения органических соединений раскрывает закономерности и порядок связи атомов друг с другом в молекулах. Разработана А.М. Бутлеровым в 1861г.
Основные положения теории.
-
Атомы в молекулах органических веществ соединены между собой химическими связями в определенной последовательности согласно их валентности. Углерод в органических соединениях всегда четырехвалентен.
Формулы строения:
а) структурная формула - описывает порядок соединения атомов в молекуле, т.е. ее химическое строение. Химические связи в структурной формуле изображают черточками. Связь между водородом и другими атомами обычно не указывается (такие формулы называются сокращенными структурными).
Например, полная и сокращенная структурные формулы н-бутана C4H10 имеют вид:
Н Н Н Н
׀ ׀ ׀ ׀
Н - С - С - С - С - Н СН3 - СН2 - СН2 - СН3
׀ ׀ ׀ ׀
Н Н Н Н
полная структурная формула сокращенная структурная формула
б) молекулярная (брутто) формула C4H10, показывает только, какие элементы и в каком соотношении входят в состав вещества (т.е. качественный и количественный элементный состав), но не отражает порядка связывания атомов.
-
Свойства органических веществ зависят не только от их качественного и количественного состава, но и от порядка их расположения атомов в молекуле, т.е. от химического строения молекулы.
Например, н-бутан и изобутан имеют одну молекулярную формулу C4H10, но разную последовательность связей
Н Н Н Н Н Н Н
׀ ׀ ׀ ׀ ׀ ׀ ׀
Н - С - С - С - С - Н Н - С - С - С - Н
׀ ׀ ׀ ׀ ׀
Н Н Н Н Н - С -Н
׀
н-бутан Н изо-бутан
2.1. Способность атомов углерода соединяться в различном порядке друг с другом и с атомами других элементов, обусловливает явление изомерии.
-
Вещества, имеющие одинаковый количественный и качественный состав молекул, но различное химическое строение и свойства называются изомерами.
-
Существует два основных типа изомерии - структурная и пространственная.
-
Структурная изомерия определяется различным порядком соединения атомов в молекуле. Различают три вида структурной изомерии:
-
вид изомерии, связанный с изменение строения углеродной цепи, называется изомерией углеродного скелета (изомерией цепи). Например, пентан имеет следующие изомеры:
С
׀
С - С - С - С - С С - С - С - С С - С - С
׀ ׀
С С
н-пентан, Tкип.= +36°С 2-метилбутан, Ткип.= +27°С 2,2 -диметилпропан, Ткип.= +5°С
-
вид изомерии, связанный с изменением места расположения кратной связи и /или атомов и групп атомов (галогенов, гидроксо-, нитрогрупп и др.), заместивших атомы водорода в углеродной цепи, называется изомерией положения. Например,
СН3 - СН2 - СН = СН2 и СН3 - СН = СН - СН
бутен-1 бутен-2
СН3 - СН2 - СН2-ОН и СН3 - СН - СН3
пропанол-1 ׀
ОН пропанол-2
-
межклассовая изомерия. Изомеры имеют одинаковую молекулярную формулу, но относятся к разным классам органических соединений. Например, этиловый спирт и диметиловый эфир отвечают формуле С2Н6О:
СН3 - СН2 - ОН СН3 - О - СН3
спирт Tкип.= +78,4°С эфир Tкип.= -23,7°С
-
Пространственная изомерия обусловливается различным расположением атомов и групп атомов в пространстве.
Пространственная изомерия подразделяется на: а)геометрическую (цис- и транс-изомерию), она возможна при наличии двойной связи в корне молекулы:
СН3 СН3 СН3 Н
С = С С = С
Н Н Н СН3
цис-изомер транс-изомер
б)Оптическая (зерккальная), она возможна при наличии ассиметричного атома углерода (при атоме углерода 4 разных заместителя)
-
Молекула каждого вещества обладает определенным химическим строением, которое может быть установлено химическими методами. Изучая свойства вещества можно определить химическое строение его молекулы, а по строению молекулы - предвидеть свойства вещества.
-
Атомы или группы атомов, образующие молекулу, взаимно влияют друг на друга, от чего зависят и химические свойства соединения.
Теория Бутлерова явилась научным фундаментом органической химии и
способствовала быстрому ее развитию. Опираясь на положения теории, А.М. Бутлеров дал объяснение явлению изомерии, предсказал существование различных изомеров и впервые получил некоторые из них.
-
Сформулируйте периодический закон и расскажите о периодической системе химических элементов Д. И. Менделеева на основе представлений о строении атомов. Каково значение периодического закона для развития науки.
Периодическая система стала одним из важнейших источников информации о химических элементах, образуемых ими простых веществах и соединениях.
Дмитрий Иванович Менделеев создал Периодическую
систему в процессе работы над своим учебником «Основы химии»,
добиваясь максимальной логичности в изложении материала.
Закономерность изменения свойств элементов, образующих систему,
получила название Периодического закона.
Согласно периодическому закону, сформулированному Менделеевым в
1869 году, свойства химических элементов находятся в периодической
зависимости от их атомных масс. То есть с увеличением относительной
атомной массы, свойства элементов периодически повторяются.*
Сравните: периодичность смены времен года с течением времени.
Данная закономерность иногда нарушается, например, аргон (инертный
газ) превышает по массе следующий за ним калий (щелочной металл).
Это противоречие было объяснено в 1914 году при изучении строения
атома. Порядковый номер элемента в Периодической системе - это не
просто очередность, он имеет физический смысл - равен заряду ядра
атома. Поэтому
современная формулировка Периодического закона звучит так:
Свойства химических элементов, а также образованных ими веществ находятся в периодической зависимости от заряда ядра атома.
Период - это последовательность элементов, расположенных в порядке возрастания заряда ядра атома, начинающаяся щелочным металлом и заканчивающаяся инертным газом.
В периоде, с увеличением заряда ядра, растет электроотрицательность элемента, ослабевают металлические (восстановительные) свойства и растут неметаллические (окислительные) свойства простых веществ. Так, второй период начинается щелочным металлом литием, за ним следует бериллий, проявляющий амфотерные свойства, бор - неметалл, и т. д. В конце фтор - галоген и неон - инертный газ.
(Третий период снова начинается щелочным металлом - это и есть периодичность)
1-3 периоды являются малыми (содержат один ряд: 2 или 8 элементов), 4-7 - большие периоды, состоят из 18 и более элементов.
Составляя периодическую систему, Менделеев объединил известные на тот момент элементы, обладающие сходством, в вертикальные столбцы. Группы - это вертикальные столбцы элементов, имеющих, как правило, валентность в высшем оксиде равную номеру группы. Группу делят на две подгруппы:
Главные подгруппы содержат элементы малых и больших периодов, образуют семейства со сходными свойствами (щелочные металлы - I A, галогены - VII A, инертные газы - VIII A).
(химические знаки элементов главных подгрупп в периодической системе располагаются под буквой «А» или, в очень старых таблицах, где нет букв А и Б - под элементом второго периода)
Побочные подгруппы содержат элементы только больших периодов, их называют переходные металлы.
(под буквой «Б» или «B»)
В главных подгруппах с увеличением заряда ядра (атомного номера) растут металлические (восстановительные) свойства.
Вариант 3
-
Охарактеризуйте ацетилен, его свойства, получение и применение.
Ненасыщенные углеводороды ряда ацетилена (алкины)
Углеводородами ряда ацетилена или ацетиленовыми углеводородами называют ненасыщенные углеводороды, в молекулах которых имеется тройная связь, т.е. группировка -СС-. 3.1. Гомология, изомерия и номенклатура. Состав каждого члена гомологического ряда ацетиленовых углеводородов может быть выражен общей эмпирической формулой СnH2n-2. Простейшим членом этого ряда является углеводород ацетилен состава С2Н2, строение которого выражают структурная и упрощенная структурная формулы: Н-СС-Н и СНСН. Гомологи ацетилена можно рассматривать как его производные, образовавшиеся в результате замещения одного или двух Н-атомов на R. Изомерия ацетиленовых углеводородов, так же как и этиленовых, обусловлена строением углеродного скелета и положения кратной связи. Но цис-, транс-изомерия у алкинов невозможна из-за линейной геометрии тройной связи. Различают два типа ацетиленовых соединений R-CC-Н и R-CC-R'. В соединениях первого типа при углероде с тройной связью имеется водород, и их называют алкинами с концевой тройной связью или «терминальными алкинами». В отличие от симметричных алкинов терминальные проявляют кислотные свойства, что позволяет легко различить между собой эти типы алкинов.
3.2.Физические свойства. Зависимости изменения физических свойств в гомологических рядах ацетиленовых углеводородов по мере возрастания числа атомов углерода в их молекулах аналогичны тем зависимостям, которые наблюдаются в рядах предельных и этиленовых углеводородов. Простейшие гомологи нормального строения до С5Н8 - газы, от С5Н8 до С16Н30 - жидкости, высшие ацетиленовые углеводороды - твердые тела. Все эти соединения бесцветны, почти не растворимы в воде.
3.3.Химические свойства. Ацетиленовым углеводородам, как и этиленовым, свойственны реакции присоединения, окисления и полимеризации по кратной связи, в данном случае тройной, а также новый класс реакций - образование ацетиленидов, который возможен, благодаря кислотным свойствам терминальных алкинов. Реакции электрофильного присоединения идут ступенчато: при взаимодействии с 1 моль реагента образуются производные этиленовых углеводородов. Затем разрывается и двойная связь, присоединяя еще один моль реагента и образуя производные предельных углеводородов. При энергичном химическом воздействии возможен распад молекул с разрывом углеродной цепи по месту тройной связи.
3.3.1. Реакции присоединения. Присоединение водорода (реакция гидрирования). В присутствии катализаторов (например, Pt или Pd, «отравленных» для понижения активности PbCO3) молекула водорода атакует кратную связь с одной стороны (син-присоединение), образуя цис-изомер алкена. Если алкин восстановливать металлическим натрием в жидком аммиаке, то реакция идет как анти-присоединение и образуются транс-изомеры алкенов:
Присоединение галогенов также протекает ступенчато. Наиболее удобна реакция с бромом, которая, как и в случае этиленовых углеводородов, может быть использована для обнаружения тройной связи по исчезновению желтой окраски раствора брома:
Присоединение галогеноводородов идет ступенчато и, в случае терминальных алкинов, с соблюдением правила Марковникова на обеих стадиях реакции:
СH3-CCH + HCl CH3-CCl=CH2 + HCl CH3-CCl2-CH3. пропин 2-хлорпропен 2,2-дихлорпропан
СH3-CCH + HCl CH3-CCl=CH2 + HCl CH3-CCl2-CH3. пропин 2-хлорпропен 2,2-дихлорпропан
СH3-CCH + HCl CH3-CCl=CH2 + HCl CH3-CCl2-CH3. пропин 2-хлорпропен 2,2-дихлорпропан
Присоединение воды (реакция гидратации, 1881г., М. Кучеров) происходит в присутствии солей окисной ртути в сернокислом растворе. Образующийся виниловый спирт неустойчив и перегруппировывается по правилу Эльтекова: водород гидроксильной группы перемещается к соседнему С-атому, π-С-С связь которого разрывается и возникает новая двойная связь между углеродом и кислородом. Таким образом, в результате реакции образуется соединение с карбонильной группой (>С=О). Из ацетилена при гидратации получается уксусный альдегид, а взаимодействие с водой его гомологов - всегда приводит к кетонам:
Присоединение монооксида углерода (реакция В. Реппе) идет в присутствии кобальтовых катализаторов и дает производные этилена, применяющиеся как мономеры:
3.3.2. Реакции окисления. Ацетиленовые углеводороды окисляются еще легче, чем этиленовые, обычно с распадом молекулы по месту тройной связи и образованием карбоновых кислот. Фиолетовая окраска содового раствора KMnO4 при действии его на алкины быстро исчезает, что служит качественной реакцией на эти непредельные соединения; в кислой среде KMnO4 окисляет алкины до карбоновых кислот:
.
3.3.3.Реакции алкинов по терминальной С-Н связи. Реакции присоединения и окисленияч алкинов аналогичны реакциям углеводородов ряда этилена. Отличительной особенностью алкинов является подвижность атомов водорода, связанных с С-атомами при тройной связи. Вследствие повышенной электроотрицательности sp-гибридного С-атома, концевая ≡Сδ--Нδ+ связь обладает заметной полярностью. Поэтому в присутствии сильных оснований возможен разрыв С-Н связи с образованием ацетиленид-иона и передачей протона основанию:
.
Кислотность алкинов невысока и проявляется только при взаимодействии с очень сильными основаниями, такими как амид натрия NaNH2, металлоорганические соединения, сухие порошкообразные щелочи. При этом водород замещается на металл и образуются ацетилениды:
При пропускании струи ацетилена в бесцветный прозрачный раствор оксида серебра в аммиачной воде - Ag(NH3)2OH -образуется белый осадок ацетиленида серебра:
HCCH + 2Ag(NH3)2OH AgCCAg + 2H2O + 4NH3.
Аналогично, при взаимодействии ацетилена и терминальных алкинов с аммиачным раствором соли закиси меди - [Сu(NH3)2Сl образуется красно-бурый осадок ацетиленида меди состава CuCCCu или R-CCCu. Таким образом, реакции с аммиачными растворами AgNO3 или CuCl являются качественными на алкины с концевой тройной связью. Ацетилениды серебра и меди в сухом виде сильно взрываются от удара или при нагревании. Под действием соляной кислоты ацетилениды разлагаются с выделением исходного ацетиленового углеводорода.
3.3.4.Полимеризация ацетилена. При пропускании ацетилена над нагретым активированным углем (400оС) происходит его тримеризация с образованием циклического углеводорода бензола (метод Н.Д. Зелинского и Б.А. Казанского). Превращение ацетилена в бензол происходит и при простом нагревании его в стеклянных трубках, но при 500оС (1860, М. Бертло).
В присутствии солей меди (I) и кислоты ацетилен легко димеризуется и далее тримеризуется:
Продукт димеризации (винилацетилен) используют для получения хлоропренового каучука:
В присутствии свободных радикалов или специальных металоорганических катализаторов алкины полимеризуются с образованием сопряженных полиенов, которые используются для получения органических полупроводников:
.
Продукт полимеризации ацетилена в присутствии одновалентной меди и окислителей называется карбин и может рассматриваться как третья аллотропная модификация углерода (наряду с алмазом и графитом). Молекулы карбина состоят только из С-атомов, находящихся в sp-гибридном состоянии:
.
3.4. Отдельные представители. Ацетилен. Представляет собой бесцветный горючий и взрывоопасный газ; Ткип. -83,6 оС. Теплота сгорания 48116 Кдж/моль; 1 объем С2Н2 растворяется в 1 объеме воды при 20 оС. Ацетилен разлагается с большим выделением тепла и, при определенных условиях, со взрывом. В чистом виде почти не имеет запаха; неприятный запах технического ацетилена обусловлен наличием в нем примесей. На воздухе ацетилен горит сильно коптящим пламенем. В технике громадное количество ацетилена получают действием воды на карбид (ацетиленид) кальция СаС2 по реакции (Велер, 1862г.):
CaC2 + 2H2O C2H2 + Ca(OH)2.
В свою очередь карбид кальция получают в электрических печах из негашеной извести и угля:
СаО + 3 С СаС2 + СО.
В настоящее время ацетилен получают термоокислительным крекингом метана, входящего в состав природных газов (при температуре свыше 1500 оС). Теплота выделяется при сгорании метана в присутствии недостаточного количества кислорода:
6СН4 + 4О2 СНСН + 8Н2 + 3СО + СО2 + Н2О.
Ацетилен является ценным исходным веществом для многих промышленных синтезов. Из него по реакции Кучерова получают уксусный альдегид, который затем превращают либо в уксусную кислоту, либо в этиловый спирт. Ацетилен служит исходным материалом для получения особого вида синтетического каучука (полихлоропренового), пластмасс, различных растворителей. Ацетилен очень опасен в обращении. С воздухом или с кислородом образует гремучую смесь (1 объем ацетилена и 2,5 объема кислорода); ацетилениды серебра и меди легко взрываются при ударе. Для работы ацетилен либо сразу же пускают в реакцию, либо хранят в стальных баллонах, растворяя в ацетоне под давлением.
-
Какие типы химических реакций выделяют в неорганической химии, дайте им характеристику.
Ковалентной связью называется химическая связь между двумя атомами за счет образования общей электронной пары. Ковалентная связь может быть неполярной - между двумя атомами с одинаковой электроотрицательностью, т. е. в простых веществах, и полярной - между атомами, электроотрицательность которых различается, т. е. в сложных веществах.
Рассмотреть образование ковалентной неполярной связи удобно на примере молекулы водорода, образующейся при соединении двух атомов водорода, каждый из которых имеет по одному неспаренному электрону:
H• + •H → H : H
При этом внешняя электронная оболочка получает недостающий электрон, становится завершенной.
Такое состояние характеризуется меньшей энергией, более устойчиво. Вот почему для разрыва ковалентной связи требуется затратить энергию (такое же количество энергии выделяется при ее образовании).
В структурных формулах ковалентная связь изображается черточкой, тогда молекула водорода будет выглядеть так: H-H
Еще раз обращаем Ваше внимание, что ковалентной называется двухэлектронная двухцентроваясвязь, когда два электрона находятся на общей орбитали двух атомов. Поэтому к ней, строго говоря, не относятся случаи, когда электроны находятся на орбиталях трех или более атомов или когда общая связь образована более чем двумя электронами (в 10-11 классах будет изучаться бензол, в молекуле которого 6 электронов образуют одну общую связь).
Ковалентная полярная связь образуется в молекуле хлороводорода:
.. ..
H· + ·Cl: → H :Cl:
·· ··
Хлор как более электроотрицательный элемент смещает к себе общую электронную пару, в результате на нем образуется частичный отрицательный заряд, а на водороде - частичный положительный:
Hδ+-Clδ−
Ковалентная связь может возникать не только при объединении двух орбиталей, содержащих по одному неспаренному электрону. Один атом может предоставить электронную пару, а второй - свободную орбиталь. Такая ковалентная связь называется донорно-акцепторной.
Например, в ионе аммония протон присоединяется к молекуле аммиака за счет образования донорно-акцепторной связи. Азот выступает донором, а протон (водород) - акцептором электронной пары:
H+ + :NH3 → NH4+
Хотя по способу образования донорно-акцепторная связь отличается от остальных, но по свойствам, в том числе по длине связи, все четыре связи одинаковы.
Чтобы подчеркнуть способ образования, донорно-акцепторную связь
могут обозначать в структурных формулах стрелкой:
H
l
[H - N → H ]+
l
H
Стрелку используют и чтобы изобразить смещение общей электронной
пары в полярной связи (H→Cl), поэтому эти два случая не следует
путать.
Ионную связь можно рассматривать как крайний случай ковалентной полярной связи, когда электроны практически полностью переходят от одних атомов к другим с образованием ионов.
Таким образом, ионная связь образуется за счет сил электростатического притяжения между ионами (притягиваются противоположные заряды).
Примером ионной связи будет хлорид натрия:
..
Na+ [:Cl:]−
··
Ионная связь характерна для соединений элементов, электроотрицательности которых различаются очень сильно, например щелочных металлов с галогенами.
Сходство с ковалентной связью заключается в том, что сложно провести резкую грань между ковалентной полярной и ионной связью, мнения разных авторов на этот счет могут различаться.
Различие ионной и ковалентной связи в том, что ионная сильнее поляризована, вплоть до полного перехода электронной пары к более электроотрицательному элементу.
Типы кристаллических решеток:
1. Ионная - в узлах кристаллической решетки расположены положительные и отрицательные ионы. Характерна для веществ с ионной связью: соединений галогенов с щелочными металлами (NaCl), щелочей (NaOH) и солей кислородсодержащих кислот (Na2SO4).
2. Атомная - в узлах кристаллической решетки атомы, связанные ковалентными связями: алмаз, кремний.
Вещества с ионными и атомными кристаллическими решетками обладают высокими твердостью и температурой плавления.
3. Молекулярная кристаллическая решетка образована молекулами, связанными слабыми межмолекулярными взаимодействиями, поэтому такие вещества непрочные, легкоплавкие (лёд, сера), зачастую возгоняются, т. е. при нагревании испаряются, минуя жидкую фазу, как сухой лёд CO2, йод I2
4. Металлическая кристаллическая решетка характерна для металлов, например, Fe
Вариант 4
-
Дайте понятие альдегидам, опишите их химическое строение и свойства. Каковы области применения муравьиного и уксусного альдегидов.
Строение молекулы альдегидов. Функциональная группа альдегидов
Альдегиды - органические вещества, молекулы которых содержат
карбонильную группу -![]() -,
связанную с атомом водорода и углеводородным радикалом.
-,
связанную с атомом водорода и углеводородным радикалом.
Общая формула альдегидов ![]() или R-CHO, CnH2nO. Функциональная
группа альдегидов (-CHO) называется альдегидной группой.
или R-CHO, CnH2nO. Функциональная
группа альдегидов (-CHO) называется альдегидной группой.
Функциональная группа альдегидов
Атом углерода в карбонильной группе находится в состоянии sp2-гибри-дизации и образует три σ-связи (одна из них - связь С-О), которые расположены в одной плоскости под углом 120оС друг к другу.
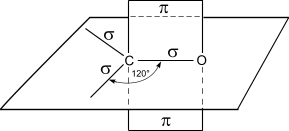
π-Связь образована р-электронами атомов углерода и кислорода.
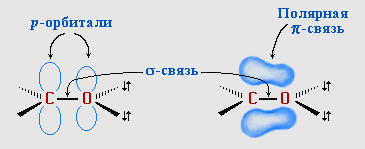
Ввиду большей электроотрицательности атома кислорода по сравнению с атомом углерода, связь С=О сильно поляризована за счет смещения электронной плотности π- связи к атому кислорода, в результате чего на атоме кислорода возникает частичный отрицательный (δ-), а на атоме углерода - частичный положительный (δ+) заряды:
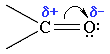
-
Гомологический ряд и номенклатура альдегидов.
Систематические названия альдегидов строят по названию соответствующего углеводорода с добавлением суффикса -аль. Нумерацию цепи начинают с карбонильного атома углерода.
Тривиальные названия производят от тривиальных названий тех кислот, в которые альдегиды превращаются при окислении.
-
изомерия углеродного скелета, начиная с С4
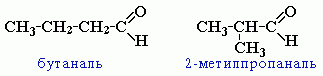
-
межклассовая изомерия с кетонами, начиная с С3
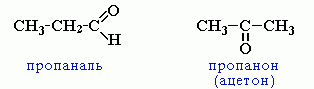
-
циклическими оксидами (с С2)
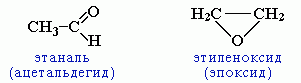
-
непредельными спиртами и простыми эфирами (с С3)
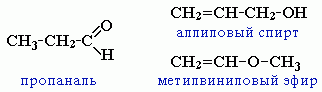
-
Физические свойства альдегидов
Метаналь (формальдегид) - газ, альдегиды С2-C5 - жидкости, высшие - твердые вещества. Низшие гомологи растворимы в воде, благодаря образованию водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода. С увеличением углеводородного радикала растворимость в воде падает.
Альдегиды обладают удушливым запахом, который при многократном разведении становится приятным, напоминая запах плодов. Альдегиды кипят при более низкой температуре, чем спирты с тем же числом углеродных атомов. Это cвязано с отсутствием в альдегидах водородных связей. В то же время температура кипения альдегидов выше, чем у соответствующих по молекулярной массе углеводородов, что связано с высокой полярностью альдегидов.
Физические свойства некоторых альдегидов:
Формальдегид - газ, с резким запахом, раздражает слизистые ткани и оказывает действие на центральную нервную систему. ОПАСЕН ДЛЯ ЗДОРОВЬЯ! Водный раствор формальдегида - формалин.
Ацетальдегид - жидкость , с запахом зелёной листвы. ОЧЕНЬ ТОКСИЧЕН! Подавляет дыхательные процессы в клетках.
Акролеин СН2 = CHCH=O акриловый альдегид, пропеналь (в производстве полимеров) - образуется при пригорании жиров, жидкость с неприятным запахом, раздражает слизистые ткани.
Бензальдегид C6H5CH=O (производство красителей) - жидкость с запахом горького миндаля, содержится в миндале, листьях черёмухи, косточках персиков, абрикосов.
-
Химические свойства. Качественная реакция на альдегиды
-
ПРИСОЕДИНЕНИЕ СИНИЛЬНОЙ КИСЛОТЫ (HCN):
-
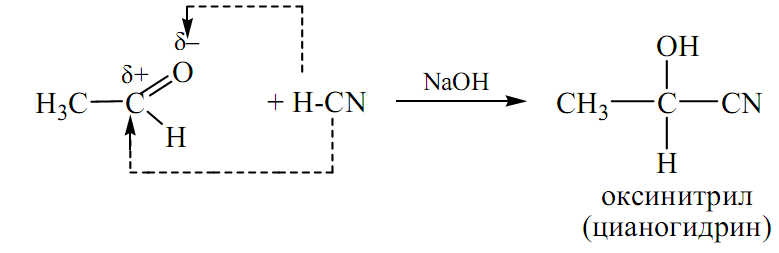
-
ПРИСОЕДИНЕНИЕ СПИРТА:
-
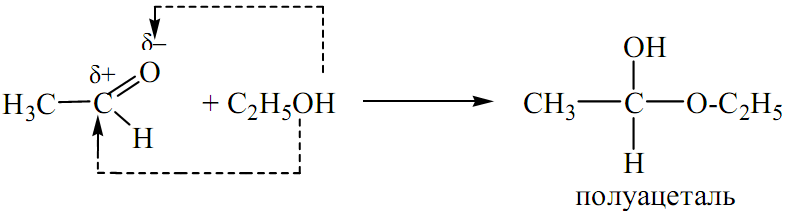
-
ПРИСОЕДИНЕНИЕ ВОДОРОДА (ВОССТАНОВЛЕНИЕ):
-
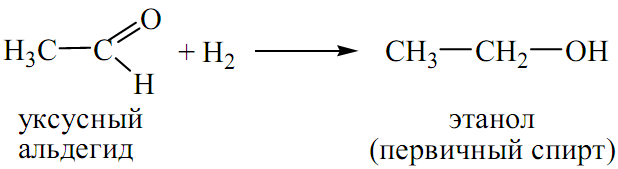
-
ПРИСОЕДИНЕНИЕ АМИНОВ И ИХ ПРОИЗВОДНЫХ:
-
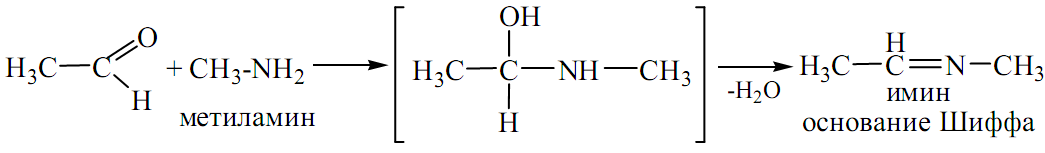
-
ОКИСЛЕНИЕ АЛЬДЕГИДОВ:
Альдегиды очень легко окисляются, кетоны окисляются трудно.
а) окисление альдегида оксидом серебра называется реакцией «серебряного зеркала»:
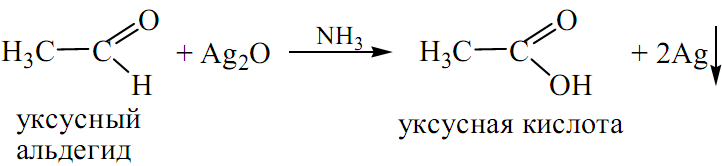
На стенке пробирки образуется налёт металлического серебра.
б) окисление альдегидов гидроксидом меди:
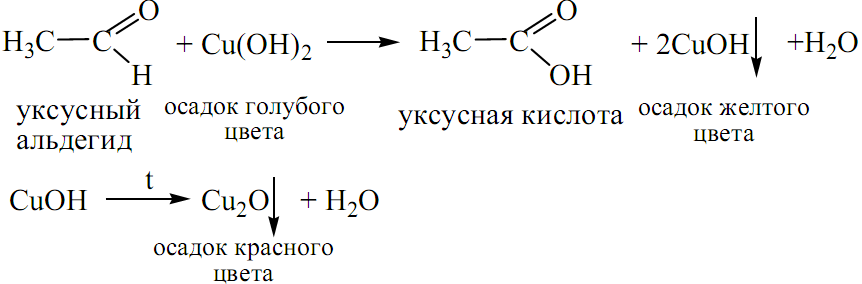
5. РЕАКЦИИ, ОБУСЛОВЛЕННЫЕ ПОДВИЖНОСТЬЮ α -ВОДОРОДНЫХ
АТОМОВ В РАДИКАЛЕ:
-
РЕАКЦИЯ АЛЬДОЛЬНОЙ КОНДЕНСАЦИИ:
-
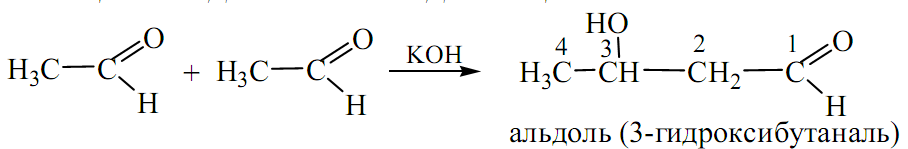
Альдоли неустойчивы, в жестких условиях дегидратируются с образованием кротонового альдегида - кротоновая конденсация:
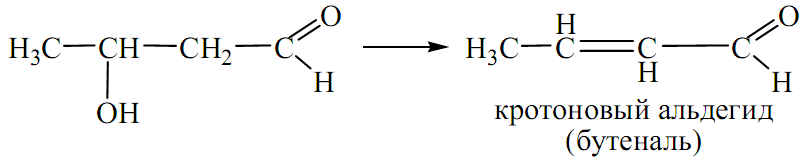
Реакция альдольной конденсации имеет большое биологическое значение, например, при образовании сахаристых веществ. При сахарном диабете холестерин и ацетоновые тела образуются при участии этой реакции.
-
Применение альдегидов.
Из всех альдегидов больше всего производится формальдегида (около 6 млн тонн/год). Он, в основном, используется в производстве смол - бакеллита, галалита (в сочетании смочевиной, меламином и фенолом), для дубления кож, протравливания зерна. Также из него синтезируют лекарственные средства (уротропин) используют как консервант биологических препаратов (благодаря способности свертывать белок). Он является предшественником метилендифенилдиизоцианата, использующегося в производстве полиуретанов игексогена (довольно сильной взрывчатки).
Второй по масштабам производства альдегид - масляный альдегид (получают около 2,5 млн тонн/год методом гидроформилирования). Некоторые альдегиды синтезируют только в небольших масштабах (менее 1000 тонн / год) и используют в качестве ингредиентов в парфюмерии и ароматов (в основном альдегиды с числом атомов карбона от 8 до 12)[1]. Например, это коричный альдегид и его производные - цитраль и лилиаль.
Ацетальдегид используется для синтеза уксусной кислоты, этилового спирта, бутадиена для получения производных пиридина, пентаэритрита и кротонового альдегида, а также при синтезе поливинилацетата и пластмасс.
Альдегиды применяют для синтеза спиртов (бутиловых, 2-этилгексанола, пентаэритрита), карбоновых кислот, полимеров, антиоксидантов, пиридиновых оснований.
-
Дайте характеристику кислотам, основаниям и солям их классификации и свойствам на основе представлений об электролитической диссоциации.
Простые вещества состоят из одного химического элемента. К ним относятся металлы и неметаллы.
Сложные вещества состоят из двух или более химических элементов. Сложные вещества, или соединения, подразделяют на классы:
-
оксиды
-
кислоты
-
основания
-
соли
Оксидами называют вещества, состоящие из двух элементов, один из которых кислород (в степени окисления −2). Оксиды делят на осно́вные, кислотные, амфотерные, безразличные (несолеобразующие).
Осно́вным оксидам соответствуют основания. Это оксиды металлов, например натрия Na2O, кальция CaO. Основные оксиды реагируют с кислотами с образованием соли и воды.
Кислотным оксидам соответствуют кислоты. Это оксиды неметаллов, например, серы SO2, фосфора P2O5, или металлов в высшей степени окисления, например, оксид хрома (VI) CrO3. Кислотные оксиды реагируют со щелочами с образованием соли и воды
Амфотерные оксиды реагируют и с кислотами, и со щелочами. Примером могут служить оксиды цинка и алюминия.
Несолеобразующие оксиды не реагируют ни с кислотами, ни со щелочами. К ним относятся некоторые оксиды неметаллов, например, оксид азота (II) NO.
Кислоты - это сложные вещества, состоящие из одного или нескольких атомов водорода и кислотного остатка.
Кислоты могут быть бескислородными, как соляная HCl, сероводородная H2S, или кислородсодержащими: азотная HNO3, серная H2SO4.
В зависимости от числа атомов водорода, кислоты делят на одноосно́вные, например, азотная HNO3, двухосно́вные - серная H2SO4, трехсно́вные - ортофосфорная (часто называют просто фосфорная) H3PO4.
С точки зрения теории электролитической диссоциации кислотами называются вещества, диссоциирующие в растворах с образованием ионов водорода:
HCl → H+ + Cl−
Основания - это сложные вещества, состоящие из металла и одной или нескольких гидроксогрупп (OH). Основания могут быть растворимыми в воде - щелочи: гидроксид натрия NaOH, гидроксид кальция Ca(OH)2, или нерастворимыми, как гидроксид меди (II) Cu(OH)2.
С точки зрения теории электролитической диссоциации основаниями являются вещества, диссоциирующие в растворах с образованием гидроксид-ионов, т. е. осно́вные гидроксиды:
NaOH → Na+ + OH−
С точки зрения протонной теории к основаниям относятся вещества, способные присоединять ионы водорода, например аммиак:
NH3 + HOH = NH4+ + OH−
Соли - это сложные вещества, в составе которых
имеется металл (или сложный положительный ион) и кислотный
остаток. Соли бывают:
• средние - в составе нет ионов водорода и гидроксогрупп,
например, хлорид натрия NaCl, карбонат натрия
Na2CO3
• кислые - содержат в своем составе ионы
водорода, например, гидрокарбонат натрия NaHCO3,
дигидрофосфат натрия NaH2PO4
• осно́вные - содержат в своем составе гидроксогруппы,
например, основный карбонат меди (II)
(CuOH)2CO3
Приложение 1
Лист согласования
Дополнения и изменения к комплекту КОС на учебный год
Дополнения и изменения к комплекту КОС на __________ учебный год по дисциплине ___________________________________________________________________________
В комплект КОС внесены следующие изменения:
__________________________________________________________________________
___________________________________________________________________________
___________________________________________________________________________
___________________________________________________________________________
___________________________________________________________________________
Дополнения и изменения в комплекте КОС обсуждены на заседании ЦМК _______________________________________________________
«_____» ____________ 20_____г. (протокол № _______ ).
Председатель ЦМК ________________ (___________________)
1</</font>