- Учителю
- Конспект урока по химии в 9 классе
Конспект урока по химии в 9 классе
Муниципальное бюджетное общеобразовательное учреждение
Кромского района Орловской области
«Закромско-Хуторская основная общеобразовательная школа»
Урок химии в 9 классе.
Тема:
"Неметаллы: атомы и простые вещества. Кислород, озон, воздух".
Автор: учитель 1 квалификационной категории
Авдюшина И. А.
2015г.
Тема урока: "Неметаллы: атомы и простые вещества. Кислород, озон, воздух".
Урок с элементами сюжетно-ролевой игры.
Цель урока: используя противопоставление с металлами, рассмотреть положение неметаллов в периодической системе и особенности строения их атомов, а также, зависимость свойств простых веществ- неметаллов от строения кристаллических решеток. Показать причины аллотропии и свойства аллотропных соединений кислорода. Познакомиться с составом и свойствами воздуха.
Задачи урока: 1. Образовательные: повторить понятия аллотропии, электроотрицательности, кристаллическое строение неметаллов.
Обобщить знания учащихся о кислороде и озоне в форме сюжетно-ролевой игры.
-
Воспитательные: Способствовать воспитанию саморазвивающейся и самореализующейся личности.
-
Развивающие: Развитие интеллекта, умения вести диалог.
Целеполагание: по окончании урока учащиеся смогут на основании положения неметаллов в периодической системе характеризовать свойства их атомов, а также, исходя из строения молекул и кристаллических решеток, характеризовать свойства аллотропных соединений.
Оборудование: плакаты "Круговорот кислорода в природе", "Применение кислорода", "Состав воздуха", таблица "Свойства металлов и неметаллов", ряд электроотрицательности, образцы неметаллов-простых веществ.
Ход урока:
-
Организационный момент.
Другого ничего в природе нет,
Ни здесь, ни там в космических глубинах.
Все, от песчинок малых до планет.
Из элементов состоит единых.
-
Изучение нового материала. Тема урока. Цель.
План урока:
-
Положение неметаллов в периодической таблице и строение их атомов. Электроотрицательность.
-
Неметаллы- простые вещества. Аллотропия.
-
"Кислород, озон, воздух". (Сюжетно-ролевая игра).
1.Положение неметаллов в периодической таблице и строение их атомов. Электроотрицательность. (Актуализация знаний учащихся в форме беседы на основе противопоставления металлов и неметаллов).
(В ходе беседы рисуем схему на доске и учащиеся в тетрадях.)
Понятия " металлы" и "неметаллы" применяют к разным объектам: к химическим элементам и к химическим веществам.
Вопросы:1. В каких формах может существовать химический элемент?
2. По каким характеристикам мы отличаем атомы металлов от атомов неметаллов?
3.Укаких элементов металлов или неметаллов больше радиус атома?
4. Сколько электронов на внешнем энергетическом уровне у металлов и неметаллов?
5.Исходя из строения атомов неметаллов, какой вывод мы делаем об их окислительно-восстановительных свойствах?
- Химический элемент может иметь три формы существования. И все эти формы имеют различия у металлов и неметаллов.
Схема.
Х
 имический элемент
имический элемент

свободные атомы простые вещества соединения элементов
М - НеМ
1. радиус. >
2. число электронов на
внешнем энергетическом уровне. <
3. электроотрицательность. <
4. окислительно-восстановительная
способность. в-ль - о-ль
Вопрос: Где проходит условная граница между металлами и неметаллами в периодической таблице?
-
По диагонали B-At.
Только из металлов состоят чётные ряды больших периодов. В итоге из 109 элементов к неметаллам относятся 22 элемента. Более верным будет все химические элементы на основании различий в строении их атомов, образуемых ими простых и сложных веществ, делить на три класса:
-
Металлы - 87 элементов из 109.
-
Неметаллы - 16 элементов
-
Инертные газы - 16 элементов.
Качественной характеристикой атомов неметаллов, т.е своеобразной мерой их неметалличности, может служить электроотрицательность.
Вопрос: Что такое электроотрицательность?
-
Способность атомов химического элемента оттягивать к себе общие электронные пары, участвующие в образовании химической связи.
Вопрос: На основании вышеизложенного какой вывод мы можем сделать об отличительных свойствах атомов металлов и неметаллов?
Вывод: У неметаллов меньше радиус атома, больше электронов на внешнем энергетическом уровне, больше электроотрицательность и они обладают окислительной способностью.
2. Неметаллы - простые вещества. Аллотропия.
А теперь мы переходим к рассмотрению неметаллов - простых веществ.
Вопрос: Вспомните, какой вид связи у простых веществ металлов и неметаллов?
-
У металлов - металлическая связь, у неметаллов - ковалентная неполярная.
Вопрос: Какими физическими свойствами обладают металлы?
-
Металлы серебристо-белые твёрдые вещества, имеют металлический блеск, высокую температуру плавления, кипения, ковкость, пластичность, электропроводность, теплопроводность.
На доске таблица "Сравнительная характеристика простых веществ металлов и неметаллов".
Металлы
Неметаллы
Агрегатное состояние
твёрдые вещества, кроме ртути
Твердые, газообразные вещества (только бром - жидкость)
Блеск
блестящие
В основном не блестят (йод и графит - исключение)
Электрическая проводимость
Хорошая
Плохая (кроме графита и кремния)
Ковкость
Хорошая
-
Пластичность
Хорошая
Плохая
Температура кипения
Высокая
Обычно низкая
Температура плавления
Очень высокая
Разная (от 3800оС до -210оС)
Цвет
серебристо-белый
все цвета спектра
В отличие от металлов неметаллы - простые вещества характеризуются большим многообразием.
Работа с таблицей.
Температуры плавления неметаллов также лежат в очень широком интервале: от 3800оС у графита до -210оС - у азота.
Эта особенность свойств неметаллов является следствием образования ими двух типов кристаллических решёток: молекулярной (O2, N2, галогены, белый фосфор) и атомной (алмаз, графит, кремний, красный фосфор).
Различным строением кристаллических решёток объясняется и явление аллотропии.
Вопрос: Вспомните, что это такое?
-
Аллотропия - это способность атомов одного химического элемента образовывать несколько простых веществ.
Например элемент фосфор образует простое вещество с молекулярной кристаллической решёткой - белый фосфор, молекулы которого имеют состав Р4 и простые вещества с атомарной кристаллической решёткой, красный фосфор и чёрный фосфор. (На доске схема строения молекулы белого и кристаллической решётки чёрного фосфора).
Имея различные кристаллические решётки эти вещества обладают и разными свойствами.
Белый фосфор, подобно другим веществам с молекулярной решёткой, легкоплавок и летуч. В воде он почти нерастворим, но хорошо растворяется во многих органических растворителях. Белый фосфор сильно ядовит.
Красный фосфор нелетуч и нерастворим в воде и органических растворителях. Красный фосфор не ядовит.
Черный фосфор обладает атомной слоистой кристаллической решеткой, характеризуется наименьшей реакционной способностью по сравнению с другими разновидностями фосфора.
Эти аллотропные модификации фосфора могут превращаться друг в друга. Превращение красного фосфора в белый вы можете наблюдать, слегка чиркнув в темноте спичкой о коробок так, чтобы спичка не зажглась. Спичка оставит на коробке слегка светящийся след - это светится белый фосфор.
Вторая причина аллотропии - разное число атомов в молекулах простых веществ - переход количества в качество.
С этим видом аллотропии мы познакомимся на примере кислорода и озона.
Разминка. Если то о чем я буду говорить характерно для простых веществ - металлов то вы поднимаете руки если для неметаллов, то встаете.
Металлический блеск (металлы- руки вверх).
Ковалентная неполярная связь (неметаллы - встают).
Молекулярная и атомная кристаллические решетки (неметаллы - встают).
В основном твердые вещества (металлы - руки вверх)
Аллотропия (неметаллы - встают).
3.Сюжетно-ролевая игра
по теме:
"Кислород. Озон. Воздух"
Учитель. К нам прибыли ученые с планеты Уран с целью изучения одной из ее оболочек - атмосферы. В состав космической экспедиции входят следующие специалисты: химик (Ф.И.) и географ (Ф.И.).
На этой встрече присутствуют корреспонденты журнала «Внеземные цивилизации» и «Химия и жизнь». Русские ученые: химик и эколог. Мы заранее присылали вам, дорогие гости Земли, много научной литературы о своей планете, поэтому вы уже немного знакомы с веществом, которое называется кислородом и его аллотропным видоизменением - озоном. Прошу всех принимать активное участие в нашей работе в течение времени карантина; потому что, пока я не буду уверена, что все имеют достаточно четкое представление о составе атмосферы Земли и свойстве основного из ее компонентов, корабль никто покинуть не сможет. Итак, начинаем нашу пресс-конференцию.( Корреспонденты задают вопросы представляясь.)
Корреспондент газеты «Внеземные цивилизации». По высказыванию Я. Берцелиуса, «Кислород - это вещество, вокруг которого вращается земная химия». А знаете ли вы, когда и кем был открыт кислород на Земле?
Химик-инопланетянин. Еще в начале XVII века газ, позднее названный кислородом, был выделен изобретателем подводной лодки К. Дреббелем, который установил его способность поддерживать дыхание. Однако результаты этих исследований были засекречены из-за их военной направленности, и поэтому они не были известны современникам.
В 1750 году М.В. Ломоносов на основании своих опытов доказал, что в состав воздуха входит кислород.
В 1774 году английский химик и философ Джозеф Пристли в результате опытов получал газ, который считал воздухом. Он писал: «Этот воздух не поглощался водой. Каково же было мое изумление, когда я обнаружил, что свеча горит в этом воздухе необычно ярким пламенем». Он поместил двух мышей: одну - в сосуд с обыкновенным воздухом, а другую - в такой же сосуд с полученным им газом. Первая мышь быстро задохнулась, а вторая в это время чувствовала себя хорошо и активно двигалась. Ученый и сам пробовал дышать полученным газом и нашел, что им дышится легко и приятно. Открытый Дж. Пристли газ и был кислород.
Корреспондент журнала « Внеземные цивилизации». Он повсюду и везде: В камне, в воздухе, в воде. Он и в утренней росе, И в небесной синеве. Где же на Земле встречается кислород?
Географ-инопланетянин. Это наиболее распространенный на Земле химический элемент. В литосфере - 47 % по массе, в атмосфере - 23 % по массе (21 % по объему).
Корреспондент журнала «Внеземные цивилизации». Атмосфера Урана на 95 % состоит из углекислого газа. А каков состав атмосферы Земли?
Географ. 78 % азота, 21 % кислорода, 0,93 % аргона, 0,03 % углекислого газа и 0,01 % приходится на долю всех остальных газов - водорода, гелия, неона, криптона, ксенона, радона. Под действием солнечной радиации молекулы газов распадаются на атомы. Атомы кислорода могут присоединяться к другим молекулам кислорода с образованием озона:
О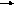
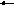
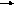
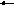 2 2О; О +
О2 О3 ,
2 2О; О +
О2 О3 ,
образуя озоновый слой, максимальная концентрация которого находится на высоте 20-25 км, который защищает вашу планету от губительного ультрафиолетового излучения.
Корреспондент журнала «Химия и жизнь». А способен ли меняться состав атмосферы?
Эколог. Если говорить кратко, то атмосфера загрязняется как по естественным причинам (извержение вулканов, пыльные бури...), так и из-за хозяйственной деятельности человека. Ее состав при этом меняется. Атмосфера содержит много пыли, которая попадает туда с поверхности Земли и частично из космоса. При сильных волнениях ветры подхватывают капли воды из морей и океанов. Вместе с каплями воды в атмосферу попадают и соли. В результате извержения вулканов, лесных пожаров и других природных явлений воздух загрязняется продуктами сгорания.
Корреспондент журнала «Химия и жизнь». Что же является основным источником загрязнения атмосферы?
Эколог. Автомобили и другие виды транспорта, тепловые электростанции. СО2, СО, оксиды азота - самые распространенные газообразные загрязнители, делающие атмосферу неблагоприятной для жизни человека и животных.
Корреспондент журнала «Химия и жизнь». Проблема охраны окружающей среды стоит перед землянами очень остро. А какие вы могли бы предложить способы решения этой проблемы на Земле?
Эколог. Ее можно решить только путем международного сотрудничества в области охраны воздуха: правильное сжигание топлива, строительство очистных сооружений, совершенствование технологии, модернизация транспорта, расширение площадей зеленых насаждений.
Корреспондент журнала «Химия и жизнь». А что вы еще знаете о свойствах кислорода?
Химик. Кислород - это газ без цвета, запаха, вкуса, плохо растворим в воде, тяжелее воздуха, при температуре -183°С превращается в подвижную жидкость.
Свойства жидкого кислорода описаны в повести нашего писателя А. Беляева «Продавец воздуха»: твердый спирт, полученный при охлаждении жидким кислородом, не горит, взрывается от удара, эфир замерзает в кристаллическую массу. Каучуковая трубка от действия жидкого воздуха становится твердой и хрупкой и может быть превращена в куски и порошок, живые цветы приобретают вид фарфоровых изделий, а фетровую шляпу можно разбить на куски, как фарфор.
Кислород в химических реакциях выступает в роли окислителя, уступая лишь фтору. Кислород отличается высокой химической активностью, из 99 элементов он взаимодействует с 86 элементами, но не соединяется с золотом, платиной, криптоном и ксеноном.
Для развития активной реакции кислорода с большинством простых и сложных веществ нужно нагревание.
Правда, есть вещество - гемоглобин крови, способное реагировать с кислородом при комнатной температуре.
Корреспондент журнала «Химия и жизнь». А чем отличается озон от кислорода?
Химик (уравнения пишет на доске). Озон обладает запахом, который вы явственно ощущаете после грозы. Само слово «озон» в переводе с греческого означает «пахнущий».
Молекула озона очень непрочная и поэтому легко вступает в химические реакции. При этом она отщепляет один атом кислорода, который взаимодействует с окисляемым веществом, и остается молекула кислорода:
О3= О + О2
Озон химически активнее кислорода, он быстро разрушает резину, очень медленно изменяющуюся в среде воздуха; он взаимодействует при комнатной температуре с серебром, образуя оксид серебра:
Ag+O3= AgO + O2↑
(а с кислородом серебро не реагирует).
На сильной окислительной способности основан метод обеззараживания питьевой воды под действием озона - озонирование.
Корреспондент журнала «Химия и жизнь». Вы сказали, что кислород является окислителем. Находит ли применение это свойство кислорода?
Химик- инопланетянин. (рассказывает по плакатам «Применение кислорода»). Обогащение воздуха кислородом делает более эффективными и экономичными многие технологические процессы, в основе которых лежат реакции окисления.
Любое пористое горючее вещество (опилки, мох, торф, уголь) в результате пропитки жидким кислородом становится взрывчатым. Такие вещества (их называют оксиликвитами) в случае необходимости могут заменить динамит при разработке месторождений полезных ископаемых.
Кислород необходим человеку для дыхания, в глубоководных скафандрах и в некоторых других случаях для дыхания человека применяется смесь кислорода с гелием.
Летчики при высотных полетах пользуются кислородными масками. Если без пищи и воды вы, люди, можете прожить несколько суток, то без кислорода - несколько минут.
Корреспондент журнала «Внеземные цивилизации». Сколько кислорода необходимо в сутки человеку для дыхания?
Химик-инопланетянин. В сутки через легкие человека проходит 800 л кислорода. И еще хочу добавить, что все живые организмы нуждаются в кислороде. Вот интересные факты. Наименее требователен к кислороду из рыб - карась, спокойно живущий в заросших прудах, где почти весь растворенный в воде кислород расходуется на окисление органических веществ.
Корреспондент журнала «Внеземные цивилизации». За счет чего восстанавливается запас кислорода на Земле?
Химик-инопланетянин. Главные поставщики кислорода - океан, морские водоросли и растения (по плакату рассказывает о круговороте кислорода в природе). Растения, поглощая атмосферный кислород, активно выделяют его в результате процесса фотосинтеза:
6СО2 + 6Н2О = С6Н12О6+6О2.
Образующиеся органические вещества разлагаются. Продолжительность одного цикла в круговороте кислорода - 2000 лет.
Корреспондент журнала «Химия и жизнь». Где же берут кислород те, кто отправляется в путешествие на космическом корабле?
Химик. Для дыхания в замкнутых помещениях кислород регенерируют.
Заключительное слово учителя
Вездесущий, все могущий и в то же время невидимый - все эти три эпитета можно отнести к кислороду. Кислород - вездесущ: из него в значительной степени состоят не только воздух, вода и земля, но и мы с вами. Могущество кислорода проявляется уже в том, что мы им дышим, а ведь дыхание - синоним жизни. Dum spiro spero («пока дышу, надеюсь»).
Вот и закончилось время нашего карантина, и мы абсолютно уверены в том, что время, проведенное на нашей Земле, позволит вам еще больше узнать о свойствах атмосферы нашей третьей планеты от Солнца.
-
Закрепление.
Тест:
1.Имеют большой радиус атомов.
А.Металлы.
В.Неметаллы
2.В основном проявляют окислительные свойства.
А.Металлы
В.Неметаллы.
3.Простые вещества образованы металлической связью.
А. Металлы.
В.Неметаллы
4.Обладают большей способностью к аллотропии.
А.Неметаллы.
В.Металлы
5.Имеют на внешнем энергетическом уровне от 4 до 8 электронов.
А.Металлы
В.Неметаллы.
6.Образуют два типа кристаллических решеток: молекулярные и атомные.
А.Металлы
В.Неметаллы.
7.Способность атомов химического элемента оттягивать к себе общие электронные пары называется
А.Аллотропия
В.Электроотрицательность.
С.Коррозия
8.Объемная доля азота в воздухе.
А.75%
В.78%.
С.90%
9.Масса 1л воздуха при (н.у.)
А.1,29г.
В.2г
С. 1,5г
10.Аллотропная модификация кислорода.
А. Графит
В. Белый фосфор
С. Озон.
Проводим проверку тестов. Учащиеся меняются тестами. Учитель читает правильный ответ, а учащиеся проверяют друг друга. Норма оценок: 10 правильных ответов - "5", 8 ответов-"4", 7-6 -"3",менее 6 -"2".
IY. Подведение итогов урока. Выставление оценок.
Y.Домашнее задание: п.15, упр.1, 4 (в конце параграфа), рабочая тетрадь: задании к уроку 19.
YI. Рефлексия:
Игра "Дальше…Дальше" (За одну минуту ответить на большее число вопросов).
1.Объемная доля кислорода в воздухе? (21%)
2.Смесь газов, из которых состоит атмосфера Земли? (Воздух)
3.Светло-синий газ, образующийся при грозовых разрядах. (Озон)
4.Высота озонового слоя над поверхностью Земли. (20-25км.)
5.Говорят, что человек вдыхает кислород, а выдыхает углекислый газ. Верно ли это утверждение? (Человек вдыхает воздух, богатый кислородом, а выдыхает тот же воздух, но обогащенный углекислым газом)
6.Кто из ученых экспериментально доказал состав воздуха? (Антуан Лавуазье)
7. Искусственная дыхательная смесь. (смесь кислорода с гелием)
8.В произведении Жюля Верна "Опыт доктора Окса" описан состав воздуха: "семьдесят девять частей азота, двадцать одна часть кислорода, углекислота и водяные пары в переменных количествах…". Какие вещества, кроме указанных в отрывке, входят в состав атмосферного воздуха? (Инертные газы. Ж. Верн не знал об их существовании, потому что первый инертный газ - гелий был открыт через 25лет после написания книги)
9.Движущийся воздух. (Ветер)
10.Чем отличается воздух над лесом и над большим городом? (Содержанием углекислого газа)
11.Составная часть воздуха, газ, называемый "удушающая материя", "безжизненный", "рождающий селитру". (Азот)
12.Физиологический процесс в организме человека, в основе которого лежит газообмен. (Дыхание)
13. Элементы, атомы которых имеют маленький радиус. (Неметаллы)
14.Проявляют восстановительные свойства. (Металлы)
15.Простые вещества образованы ковалентной неполярной связью. (Неметаллы)
16.Газовая оболочка, окружающая небесное тело.(Атмосфера)