- Учителю
- Рабочая тетрадь по химии для учащихся 8 класса
Рабочая тетрадь по химии для учащихся 8 класса








 Акмолинская область
Акмолинская область 
Шортандинский район
Жолымбетская средняя школа №1


Рабочая тетрадь по химии
для учащихся 8 класса
(дополнительные задания для закрепления ЗУН)

Разработала: Смагулова Гульнар Елдесовна
учитель химии ЖСШ №1
Жолымбет-2013г
ЗНАТЬ
____________________________________________________________________
ПЕРВОНАЧАЛЬНЫЕ ХИМИЧЕСКИЕ ПОНЯТИЯ
Предмет химии. Вещества и их свойства.
Химия занимает центральное место в ряду естественных наук, поскольку она изучает элементы и образуемые ими соединения, которые составляют Вселенную, и помогает нам понять окружающий нас мир.
В химии, как и в любой науке, есть информация, которую нужно запомнить и подружиться с некоторыми понятиями как:
Химия - это наука о …………………………………………………………………..
…………………………………………………………………………………………..…………………………………………………………………………………………
Химия изучает ………………………………………………………………………..
………………………………………………………………………………………….………………………………………………………………………………………….
Вещество - это………………………………………...............................................
…………………………………………………………………………………………..…………………………………………………………………………………………
Свойства - это признаки……………………………………………...........................
…………………………………………………………………………………………………………………………………………………………………………………….
В природе вещества встречаются в………………………………………………….
…………………………………………………………………………………………
Смеси по агрегатному состоянию делятся на ……………………………………...
………………………………………………………………………………………….
Определите однородные и неоднородные смеси: молоко, камень, песок, чай, мед, варенье, поваренная соль, бензин, воздух, известковая вода, спирт и заполните таблицу:
Однородная смесь
Неоднородная смесь
____________________________________________________________________
1
ЗНАТЬ
____________________________________________________________________
Физические и химические явления.
Признаки химических реакции.
Изменения, которые происходят с окружающими нас веществами и предметами называются явлениями.
Различают два вида явлении: ………………………………………………………..
При физическом явлений изменяется………………………………………………..
………………………………………………………………………………………но его …..………………………………………………………………………………….
При химическом явлении происходит ……………………………………………...
…………………………………………………………………………………………. и изменяется ………………………………………………………………………….
Подчеркните явления, которые относятся к химическим:
плавление, облачность, гниение, горение, ржавление, искривление гвоздя, испарение, изменение цвета, получение бензина из нефти, скисание молока.
Протекание химической реакции можно определить по следующим признакам: …………………………………………………………………………………………………………………………………………………………………………………….
Приведите примеры признаков химической реакции:
Выделение тепла:………………………………………………………………………………
……………………………………………………………………………………………………
Выделение газа………………………………………………………………………………….
……………………………………………………………………………………………………
Поглощение тепла……………………………………………………………………………
…………………………………………………………………………………………………………………………………………………………………………………………………………..
Выпадение осадка ……………………………………………………………………………
……………………………………………………………………………………………………
Появление запаха ……………………………………………………………………………
…………………………………………………………………………………………………….
Изменение цвета ………………………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………………………………………….
____________________________________________________________________
2
ЗНАТЬ
____________________________________________________________________
Простые и сложные вещества.
Атомы и молекулы.
Из курса физики вы знаете, что молекулы состоят из атомов и молекул.
Молекула - мельчайшая частица. Атомы, соединяясь, образуют молекулу, а молекула, распадаясь, превращается в атомы.
Атомы и молекулы невидимы, но на примере разложения воды можно убедиться в их существовании:
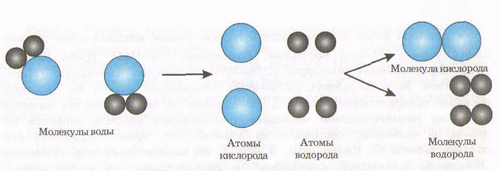
Сложные вещества - это ……………………………………………………………..
………………………………………………………………………………………….
Простые вещества - это ……………………………………………………………...
………………………………………………………………………………………….
Обобщите данные о простых и сложных веществах и заполните таблицу:
Вещества и их характеристики
-
Простое вещество
Сложное вещество
Химически неделимо
Химически делимо
____________________________________________________________________
3
ЗНАТЬ
____________________________________________________________________
Химические элементы и их знаки.
Относительные атомные массы химических элементов.
Понятие о химическом элементе является основным в химии.
Относительная атомная масса обозначается знаком - Аr . Безразмерная величина.
Химические элементы делятся на две большие группы ………………………..
………………………………………………………………………………………….
Заполните таблицу, пользуясь периодической системой химических элементов:
Название элемента
Химический знак элемента
Относительная атомная масса
N
Водород
32
Кремний
Mg
Марганец
Mn
Серебро
16
Р
Напишите названия и символы химических элементов соответствующие названию стран:
………………………………………………………………………………………………... …
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
! Химические элементы - это атомы определенного вида.
__________________________________________________________________
4
ЗНАТЬ
___________________________________________________________________
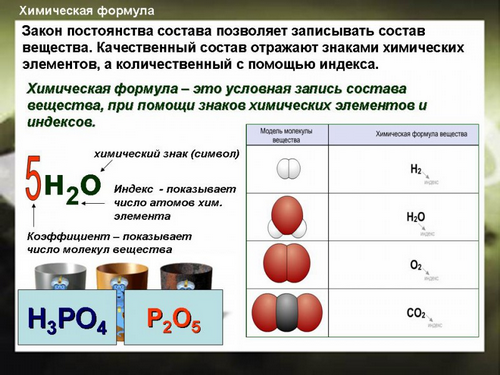
Химические формулы.
Относительная молекулярная масса вещества.
Массовая доля.
Химическая формула - это условное обозначение состава вещества с помощью символов химических элементов и индексов.
Относительная молекулярная масса обозначается буквой - Мr , является безразмерной величиной и вычисляется следующим образом:
Мr (Н2 О) = 2 х А r ( Н ) + А r ( О) = 1х2 + 16 = 18.
! По химической формуле можно определить следующее:
-
Простое оно или сложное
-
Качественный состав (из каких видов атомов состоит)
-
Количественный состав (из скольких каждого вида атомов состоит)
-
Относительную молекулярную массу
-
Массовые отношения элементов
Массовая доля - это отношение массы атомов элемента, входящего в состав химического соединения, к массе молекулы данного вещества.
Она выражается в - % или в массовых долях, и обозначается греческой буквой - ω (омега).
n(э) х А r (э)
ω (э) = ---------------------- х 100%
Мr (вещества)
ω (э) - массовая доля элемента
n (э) - число атомов элемента
! Коэффициент « 1 » перед формулой не пишется.
____________________________________________________________________
5
САМОСТОЯТЕЛЬНАЯ РАБОТА
____________________________________________________________________
Опишите качественный и количественный состав молекул следующих веществ: Na2CO3 - cода, Cl2 - хлор, Al 2 (SO4)3 - сульфат алюминия.
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Чему равны массовые доли элементов в следующих веществах: NH3 , N2O, HCl, P2O5, K2S, CuO.
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………….
Сколько химических элементов встречается в природе?
…………………………………………………………………………………………………………………………………………………………………………………….
Какие химические элементы наиболее распространены:
а) в земной коре;
б) в морской воде?
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Напишите, как произносятся следующие формулы:
HCl…………………………………………………………………………………….
H2SO4 …………………………………………………………………………………..
NaNO3 …………………………………………………………………………………
Mg (NO3)2………………………………………………………………………………
____________________________________________________________________
6
ЗНАТЬ
____________________________________________________________________
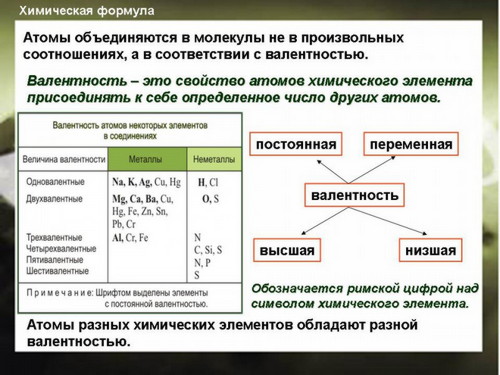
Валентность химических элементов.
Составление химических формул соединений по валентности элементов.

При составлении химической формулы биэлементного соединения по известной валентности элементов, входящих в состав данного вещества, находят число атомов и ставят их в формуле в виде индексов.
III II
Например: Al O
-
находим наименьшее кратное число выражающее валентность обоих элементов: 2х3 = 6;
-
Это число делим на валентность каждого элемента:6:3=2; 6:2=3;
-
определим отношение атомов - 2:3;
-
эти индексы проставим рядом с элементами и записываем формулу оксида алюминия - Al 2O3 .
____________________________________________________________________
7
ЗАПОМНИ
Образец оформления решения задачи с объяснением:
Задача: Вычислите массовую долю фосфора в оксиде фосфора ( V).
Дано: Решение:
-
находим относительную молекулярную массу оксида фосфора (V):
Р2 О5
Мr (Р2О5) = 2Аr(Р) + 5 Аr(О) = 2х31 + 5х16 = 142.
ω - ? 2) вычисляем массовую долю фосфора в данном оксиде:

Ответ: ω(Р) = 43,7%
____________________________________________________________________
Задача: Выведите простейшую формулу соли, если известны массовые доли элементов, входящих в состав: К - 39,69%; Mn - 27.87%; O - 32,46%.
Дано: Решение :
ω (К)- 39,69% 1) находим отношение атомов. Для этого массовые
ω (Mn)-27,87% доли каждого элемента делим на его атомную массу:
ω (O) - 32,46% Аr(К) = 39; Аr(Mn)= 55; Аr(O)=16.

найти формулу
Кх Mnу Oz -? 2) в формулах веществ отношение количества атомов
представляет собой отношение целых чисел, поэтому
полученные дроби делим на наименьшее число и получаем:
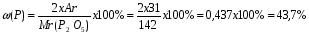
3) подставляем в формулу вместо обозначений х : у : z их численные значения: К2 Mn O4
Ответ: Формула соли- К2 Mn O4
____________________________________________________________________
8
УМЕТЬ
Решите задачу:
1. Вычислите массовые отношения элементов, входящих в состав следующих веществ: а) Н2 О; б) СаО; в) Са(ОН)2
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
2. В формулах соединений: а) СаСО3 ; б) С2 Н5 ОН; в) Аg NO3; г) NaClO3
рассчитайте массовую долю кислорода.
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………….. ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
3. Напишите формулы водородных соединений следующих элементов, согласно их валентности: а) фосфора (III) …………………………………………………………
б) кремния (IV)………………………………………………
в) хлора (I)…………………………………………………...
г) серы (II)……….……………………………………………
4. Определите валентность всех элементов в следующих соединениях:
H2 S; H2 SO4 ; NaOH; FeSO4; H3 PO4; CrBr3; FeCl2; CuO; PH3; B2 O3.
над символами элементов напишите значения валентности.
5. Относительная молекулярная масса кислородного соединения серы в два раза больше относительной молекулярной массы молекулы кислорода. Определите формулу этого удушливого газа.
……………………………………………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………………………………………….. 6. Определите формулу серосодержащей кислоты, если массовые отношения водорода, серы и кислорода равны 1:16:32 ……………………………………………
…………………………………………………………………………………………………………………………………………………………………………………………………………..
____________________________________________________________________
9
ЗНАТЬ
Закон постоянства состава вещества.
Каждое химически чистое вещество, независимо от места
нахождения и способа получения, имеет один и тот же постоянный
состав.
Зная атомное отношение элементов в формуле, можно вычислить………………
.........................................................................................................................................
Пример: Рассмотрим образование оксида магния (MgO) из магния и
кислорода.
Из формулы оксида магния видно, что на 1 атом магния приходится
1 атом кислорода. Зная атомные массы магния и кислорода можно
определить, в каких массовых отношениях соединяются между собой
эти элементы:
т (Mg) : т (O) = 56а.е.м. : 32 а.е.м. = 56г:32г = 7:4
Ar (Mg ) : Ar (S) = 56 : 32 = 7:4
____________________________________________________________________
10
ЗНАТЬ
Уравнения химических реакций
Закон сохранения массы веществ.

Для составления химических уравнений необходимо соблюдать ряд последовательных действий. Каких?
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Завершите уравнения химических реакций и расставьте коэффициенты:
Na + Cl2 = ………………………... S + O2 = ………………………….
P + O2 = …………………………. Fe + S = ………………………….. H2 + Cl2 = ………………………… N2 + H2 = ………………………….
Составьте уравнения следующих химических реакции и расставьте коэффициенты:
Fe + ….. = FeCl3 H2S + …. = H2O + SO2
Al + …. = Al2S3 …. + HCl = ZnCl2 + H2
…. + CuSO4 = FeSO4 + Cu CaO + ….. = CaCO3
Какую массу Fe2O3 и SnO2 необходимо взять для получения 10 граммов чистого металла?
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………...
………………………………………………………………………………………….
____________________________________________________________________
11
ЗНАТЬ
Количество вещества. Моль.
Число Авогадро. Молярная масса.
Количество вещества выражается в молях.
Моль - это количество вещества, которое содержит столько же частиц, сколько атомов углерода содержится в 0,0012кг (12 г )углерода.
v = 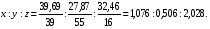 [моль]
[моль]
М - молярная масса вещества, показывает массу одного моля вещества.
М = 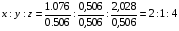 [ г/моль]
[ г/моль]
Численное значение молярной массы вещества М равна численному значению Ar и Mr данного вещества.
(Mr (Н2О)= 18, М (Н2О) = 18 г/моль. Ar (Fe) =56а.е.м. Ar (Fe) =56 г/моль )
NA - число Авогадро, показывающее число частиц, составляющих 1 моль вещества. NA = 6,02 х 1023моль-1.
Взаимосвязь между количеством вещества и массой, числом частиц, объемом выражается следующими формулами и можно проводить расчеты:
v = 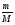 ;
;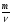 v =
v =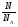 ;
; 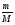 =
= 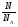 ;
; 
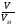 ; N=NA
; N=NA 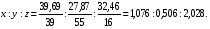
Количество вещества обозначается…………… и определяется по формуле:
где М …………………………………………………………………….., которая показывает, ……………………………………………………………………………………
Задача: Определите количество вещества сульфата натрия (Na2 SO4), если
его масса равна 49,7г.
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………......
____________________________________________________________________
12
САМОСТОЯТЕЛЬНАЯ РАБОТА
-
Образец вещества массой 6,6г содержит 9,03 х 1023молекул. Определите молярную массу этого вещества. ………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………….
-
Количество вещества сульфида натрия Na2S равно 0,6 моль. Определите массу натрия, необходимого для получения данного образца сульфида. …………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
-
На одной чаше весов находится 30г мела СаСО3. Если на другую чашу положить серу в количестве 1 моль, уравновесятся ли весы, если нет, то какого вещества больше.
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
-
Заполните таблицу:
Формула вещества
m - масса
М-молярная масса
v -количество вещества
N - количество молекул
CO2
220 г
34 г
2 моль
80 г
3,01х1023
H2SO4
12,04х1023
NO
5 моль
18 г/моль
3 моль
CaCO3
10 г
-
Сколько будет весить 1 моль комаров, если один комар весит 0,2г……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………….. _________________________________________________________________
13
ЗНАТЬ
Типы химических реакций.
Различают четыре типа химических реакции:
-
Реакции соединения
-
Реакции разложения
-
Реакции замещения
-
Реакции обмена
Реакции соединения - это…………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Реакции разложения - это …………………………………………………………….......
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Реакции замещения - это …………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Реакции обмена - это ………………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Самостоятельно заполните таблицу:
а) реакции разложения малахита,
б) взаимодействия алюминия с раствором хлорида меди,
в) реакцию между растворами сульфата меди и гидроксида натрия,
г) сжигание фосфора
Признаки, указывающие на появление новых веществ
Уравнение реакции
Тип реакции
Определение данного типа реакции
_______________________________________________________________
14
УМЕТЬ
Задание на закрепление усвоенных знаний:
Расставить коэффициенты и определить тип реакции:
CaCO3 = Ca + CO2 …………………………........................................................
H2 + O2 = H2O……………………………………………………..........................
Zn + H2SO4 = ZnSO4 + H2………………………………………..........................
NaCl + AgNO3 = NaNO3 + AgCl ……………………………………………….
H2 + Cl2 = HCl ……………………………………………………………………..
CaBr2 + Cl2 = CaCl2 + Br2........................................................................................
H2SeO4 = H2O + SeO3 ……………………………………………........................
H2S + K2O = K2S + H2O ……………………………………………………….....
Дописать уравнения реакций и определить их тип:
III II
Al + O2 = Al O ……………………………………………………………………
III II
Fe O + H2 = Fe + H2O ……………………………………………………………
II II II II IV II
Zn S + O2 = Zn O + S O ………………………………………………………...
I I III I
Al + H Cl = Al Cl + H2 ……………………………………………………………...
III II I I III I
Fe O + H Cl = Fe Cl + H2O ……………………………………………………...
III II II II
Fe O + C = Fe + C O …………………………………………………………….
____________________________________________________________________
15
УМЕТЬ
Решение разноуровневых задач:
А.
1. Найти массу Al2O3 по уравнению: 4Al + 3O2 = 2Al2O3, если объем кислорода равен 11,2 литра………………………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
2. Найти количество вещества HCl по уравнению: H2 + Cl2 = 2HCl, если объем водорода равен 44,8 литра. ……………………………………………………….
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
3. Найти количество вещества FeCl3 по уравнению реакции:
2Fe + 3Cl2 = 2FeCl3 , если масса железа равна 5,6 грамм…………………………
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
4. Найти объем, количество вещества и количество молекул 440 граммов СО2.
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
-
Состав вещества выражен формулой SO3.
Определите:
a) Название вещества ………………………………………………………………………..
б) Качественный состав………………………………………………………………….....
в) Количественный состав …………………………………………………………………
г) Валентность химических элементов…………………………………………………..
д) Молярную массу……………………………………………………………………………
е) Массовые доли элементов, образующих вещество…………………………………
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………….
ж) Массу вещества количеством 1,5 моль……………………………………………....
...…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
____________________________________________________________________
16
УМЕТЬ
В.
1. В 160 г образца соединения содержится 128 г меди и 32 г кислорода. Установите формулу соединения……………………………………………………........
…………………………………………………………………………………………………………………………………………………………………………………………………………
2. Составить формулы соединений элемeнтов: K (I); Al (III); Mg (II); S (IV);
As (V)с каждым из элементов: O (II); F (I); C (VI); N (III).
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
3. Заполните таблицу:
Формула вещества
масса
Молярная масса
Количество вещества
Количество молекул
MgCO3
5 моль
Na2O
25 г
HCN
18,06х1023
88 г
-
моль
4.Какая масса HCl потребуется для реакции с 5 молями NaOH по уравнению: NaOH + HCl = NaCl + H2O………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
5. Какой объем водорода получится из 8 граммов кальция в реакции:
H2SO4 + Ca = CaSO4 + H2. ………………………………………………………………......
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
6. Дополнительное задание - определить валентности:
Fe2O3, SO2, SO3, Cl2O7, Cr2O3, NH3, CH4
____________________________________________________________________
17
УМЕТЬ
формула
М
m
V
N
C3H8
2 моль
SO2
40 л
O2
80 г
N2
9,03х1023
96 г
134,4 л
1. Заполните таблицу.
2. Какой объем H2S выделяется в реакции: Zn + H2SO4 = H2S + ZnSO4, если в реакции участвует 3 моль H2SO4…………………………………………………………...............................
…………………………………………………………………………………………………………………………………………………………………………………………………………..…………………………………………………………………………………………………..……………………………………………………………………………………………………...... .....................
Найти массу, количество вещества и объем, занимаемый 9,03х1023 молекул NO.…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………...............................................................................
4. Масса золы составляет 1,2% от массы сожженного дерева, а массовая доля кальция в золе равна 25%. Вычислить массу магния в дереве массой 700 кг.
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………........
5.Составить формулы оксидов (бинарных соединений с двухвалентным кислородом) и хлоридов (бинарных соединений с одновалентным хлором) серы (IV) и (VI), азота (I), (II), (III), (IV) и (V) , марганца (I), (II), (IV), (V) и (VII).
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Найдите ошибку.
I II IV I V I I V II IV
Ag2O, FeO, Fe2O3, N2O, SO2, CaO, Mn2O7, RuO4
____________________________________________________________________
18
ЗНАТЬ
КИСЛОРОД. ОКСИДЫ. ГОРЕНИЕ.
Лавуазье Антуан Лоран
Французский химик. Один из основоположников
классической химии. Ввел в химию строгие
количественные методы исследования.
Получил кислород. Доказал сложный состав атмосферного воздуха, содержащего кислород и «удушливый воздух» (азот). Доказал сложный состав воды, установив, что она состоит из кислорода и водорода.
-
Кислород - «оxygenium» - рождающий кислоты.
-
O2 - газообразное вещество, молекула которого имеет кратные связи, (O=O).
-
Горение - это реакции, при которых происходит окисление веществ с выделением тепла и света.
-
Оксиды - это сложные вещества, состоящие из двух элементов, один из которых кислород.
Простое вещество + кислород = оксиды.
4 Fe + 3 O2 = 2 Fe2O3
____________________________________________________________________
19
УМЕТЬ
1. Опишите химические и физические свойства кислорода и напишите уравнения соответствующих реакций: …………………………………………………..
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Li + O2 = СН4 + О2 =
Cu + O2 = С2Н5ОН + О2 =
Н2S + O2 = NH3 + O2 =
2. Составьте уравнения реакций, с помощью которых можно осуществить следующие превращения:
KClO3 → O2 → CO2 → O2 → H2O → O2 → P2O5
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………….
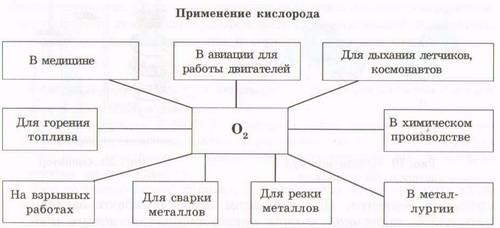
3. Какую роль играет кислород в жизни живых организмов?
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………................................................
4. Какое явление называется аллотропией? ............................................................
........................................................................................................................................................................................................................................................................................................................................................................................................................
5. Какие инертные элементы содержатся в составе воздуха? ............................
.......................................................................................................................................................................................................................................................................................................................................................................................................................
6. Какие газы опасные газы могут присутствовать в воздухе и какие меры защиты предлагаете?..................................................................................................
..........................................................................................................................................................................................................................................................................................................................................................................................................................
____________________________________________________________________
20
ЗНАТЬ
Тепловые эффекты химических реакций.
.....................................................................................................................................................................................................................................................................................................................................................................................................................................................................................называется тепловым эффектом реакции.
Эндотермические реакции - это...............................................................................
...........................................................................................................................................................................................................................................................................
Экзотермические реакции - это..............................................................................
................................................................................................................................................................................................................................................................................
В термохимических уравнениях реакции указывается ..........................................
........................................................................................................................................
Величина теплового эффекта зависит от: ..............................................................
.......................................................................................................................................................................................................................................................................................................................................................................................................................
По термохимическим расчетам можно проводить различные расчеты, например: Определите тепловой эффект реакции разложения 1 моля СаСО3,
если при образовании 10 г СаСО3 по реакции СаО + СО2 =СаСО3
выделилось 16 кДж теплоты.
Решение: 1. Найдем количество теплоты, которое выделяется при образовании
1 моля СаСО3 ( Мr (СаСО3) = 100 г/моль):
при образовании 10 г СаСО3 выделилось 16 кДж теплоты
при образовании 100 г СаСО3 выделилось х кДж теплоты
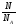
2. Термохимическое уравнение реакции образования 1 моля СаСО3:
СаО + СО2 = СаСО3 + 160 кДж
3. Термохимическое уравнение реакции разложения 1 моля СаСО3:
СаСО3 = СаО + СО2 - 160 кДж
Ответ : В результате разложения 1 моля СаСО3 поглощается 160 кДж
теплоты.
____________________________________________________________________
21
ЗНАТЬ
Закон Авогадро. Молярный объем газа.
Относительная плотность газов.
Объемные отношения газов при химических реакциях.
В равных объемах различных газов при одинаковых условиях (температуре и давление) содержится одинаковое число молекул.
-
объем газа определяется не размером его молекул, а расстоянием между ними;
-
объем одного моля любого газа (NA=6,02х1023 молекул)при определенных условиях есть величина постоянная;
-
Объем одного моля газа называется молярным объемом и обозначается.............. ;
-
Молярный объем любого газа при н.у. равен 22,4 л/моль.
-
V = VM x ν
-
ν = V/ VM
Нормальные условия (н.у.)
нормальная температура нормальное давление
00С, или 273К 1 атм = 750 мм.рт.ст. или
101,325кПа
Объем при н.у. Vн.у.=22,4 л/моль
-
Относительная плотность одного газа по другому газу равна отношению их молярных или относительных молекулярных масс -D.
D = Mr (газ1) / Mr газ2 , М(возд)=29;
например: D(возд) (Н2) = М(возд) / М(Н2) = 29/2 = 14,5.
-
1 моль любого газа при н.у. всегда занимает один и тот же объем, равный 22,4л, коэффициенты в уравнениях реакции показывают число молей и число объемов газообразных веществ.
____________________________________________________________________
22
УМЕТЬ
Практические задачи
При решении практических задач необходимую информацию найдите в учебнике .
Задание к этапу актуализации знаний:
I. Найти массу, количество молекул 5 моль Mg2C. Найти количество вещества, количество молекул 9,8 г. H2SO4.
II. Найти количество вещества, количество молекул 440 г CO2. Найти массу, количество молекул 6 моль SO3.
Задания для закрепления усвоенных знаний (фронтальная работа):
-
Найти объем, занимаемый 3 моль СО2 (5 моль Н2).
-
Найти массу 40 л СО2 (50 л О2).
Задания для индивидуальной работы для закрепления усвоенных знаний:
Заполнить таблицу
формула
М
m
V
N
H2
2 моль
N2
10 л
NO
40 г
SO2
12,04*1023
56 г
44,8 л
формула
М
m
V
N
CO2
3 моль
N2
20 л
O2
15 г
NO
30,1*1023
176 г
89,6 л
формула
М
m
V
N
H2S
6 моль
CH4
50 л
H2
35 г
SO2
15,05*1023
108 г
67,2 л
____________________________________________________________________
23
УМЕТЬ
Задание на закрепление усвоенных знаний:
-
Плотность газа по воздуху 2. Какова его молярная масса?
-
Плотность газа по гелию 0,5. Какова его молярная масса ?
-
Соединение фосфора с водородом имеет такую же плотность, что и сероводород H2S. Найдите его формулу.
-
Плотность паров цинка по водороду 33. Каков состав молекулы цинка?
-
Плотность паров фосфора по водороду 62. Найдите его формулу.
-
Сколько атомов в молекулах серы при 500 Со и 1160 Со, если плотность паров серы при этих условиях соответственно равны 6,62 и 2,2.
-
Легче или тяжелее воздуха NH3 ?
-
Найдите массу 20 см3 гелия.
-
Сколько молекул находятся в 560 мл SO2 ?
-
Какой воздух тяжелее: сухой или влажный?
Вычисления по уравнениям реакций:
1. В реакцию: 2NO + O2 = 2 NO2 вступило 78,4 литра NO. Какой объем
кислорода при этом вступило в реакцию?
2. В реакцию: CuO + H2SO4 = CuSO4 + H2O вступило 8 грамм CuO. Сколько
грамм CuSO4 при этом образуется?
3. Относительная плотность газа равна 15. Найдите его относительную
плотность по воздуху, и плотность в г/л.
4. Определите объем, который занимают 0,07 кг азота N2 при 210 С и
давлении 142 кПа.
5. Из нижеследующих реакций определите экзотермические и
эндотермические реакции:
N2 + 3H2 = 2 NH2 + 92 кДж Н2 + Сl2 - 185 кДж = 2 HCl
Ca (OH)2 = CaO + H2O - 67 кДж 2HgO + 180 кДж = Hg +O2
N2 + O2 + 180 кДж = 2 NO S + O2 = SO2 + 297 кДж
H2 + O2 = 2 H2O + 570 кДж 2H2O = 2 H2 + O2 - 570 кДж
6. При взаймодейтсвии 3,2 железа с серой выделилось 9,5 кДж теплоты.
Составьте термохимическое уравнение этой реакции.
7. В реакции взаймодействия 9 г алюминия с кислородом выделяется 273,5
кДж теплоты. Определите количество теплоты, которое выделится при
окислении 3 молей алюминия.
_________________________________________________________________
24