- Учителю
- Опорный конспект «Хлор», 9 класс
Опорный конспект «Хлор», 9 класс



Характеристика элемента
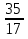 Cl +17 2 ) 8 ) 7 )
Cl +17 2 ) 8 ) 7 )
--1
+1
+3
+5
+7
+e -e
↑
↑↓
↑↓
↑↓
1s22s22p63s23p5
Изотопы: 35Cl - 75% 37Cl -25%
Нахождение в природе
NaCl - поваренная соль, галит
NaCl∙KCl - сильвинит
KCl - сильвин
MgCl2∙KCl∙6H2O - карналлит
Строение молекулы
.. ..
Cl2 :Cl (:) Cl: Cl - Cl
˙˙ ˙˙
Ковалентная неполярная связь
Э.О. (по Полингу) = 3,16
H2OФизические свойства

tкип.= - 34ºC
малорастворим
Получение
В промышленности:
Электролиз раствора хлорида натрия.
2NaCl→ 2Na + Cl2
В лаборатории:
16HCl + 2KMnO4 = 2MnCl2+ 5Cl2+ 2KCl+ 8H2O
2HCl + CaOCl2→ Cl2 + H2O + CaCl2
Химические свойства
Сильный окислитель!
С простыми веществами:
-
2Fe + 3Cl2
 2FeCl3
2FeCl3 -
H2 + Cl2 → 2HCl
Со сложными веществами:
-
Вытесняет бром из бромидов
Cl2 +2KBr →2KCl + Br2
-
C водой:
Cl2 + H2O ↔ HCl + HClO -Q
-
С растворами щелочей на холоду
2KOH + Cl2= KCl + KClO + H2O
При нагревании:
6KOH + 3Cl2= 5KCl + KClO3 + 3H2O
-
С гидроксидом кальция:
Сa(OH)2 + Cl2 = CaOCl2 + H2O
Хлорная известь
Применение
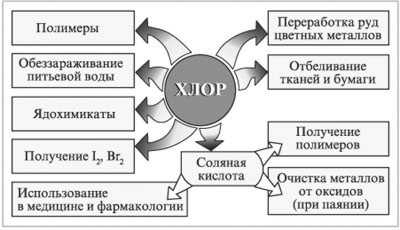 Соединения
Соединения
HCl - соляная кислота, KClO3 - бертолетова соль
Качественная реакция
Ag+ + Cl- = AgCl↓- белый творожистый осадок
Открытие
Xлор получен впервые в 1774 К. Шееле взаимодействием соляной кислоты с пиролюзитом МnO2. Однако, только в 1810 г. Дэви установил, что хлор - элемент и назвал его chlorine (от греческого chloros - жёлто-зелёный). В 1813 Ж.Л. Гей-Люссак предложил для этого элемента название хлор.
Ответьте на вопросы:
-
Составьте уравнение реакции получения хлора по способу Шееле.
-
Какой объем хлора можно получить из 34 г пиролюзита, содержащего 5% примесей?