- Учителю
- Полугодовая контрольная работа 10 класс
Полугодовая контрольная работа 10 класс
Вариант 1 Уровень А
1. Если вещество имеет запах, то в узлах его кристаллической решётки находятся
А) атомы неметаллов Б) катионы В) молекулы Г) атомы металлов
2. Ковалентная полярная связь в молекулах веществ группы
А) НCl, Cl2 Б) Cl2, NH3 В) CaCl2, NaBr Г) NH3, SiO2
3. Окислительно- восстановительными являются все реакции
А) обмена Б) замещения В) соединения Г) разложения
4. Наиболее выраженными металлическими свойствами обладает элемент 4-го периода
А) калий Б) цинк В) кальций Г) германий
5.Элементы V группы образуют высшие оксиды с общей формулой
А) ЭО3 Б) Э2О3 В) Э2О5 Г) ЭО2 .
6. Степень окисления марганца наибольшая в соединении
А) МпО2 Б) Н2MnO3 В) Na2 MnO4 Г) КМпО4
7. Катион Э3+некоторого элемента имеет электронную конфигурацию Is22s22p6. Число протонов в ядре атома данного элемента А) 10 Б) 13 В) 16 Г) 17
8. Ядро атома изотопа 84Kr содержит А) 84 протона и 36 нейтронов Б) 48 протонов и 36 нейтронов В) 36 протонов и 48 электронов Г) 36 протонов и 48 нейтронов
9. Скорость химической реакции CH4 +2O2 = CO2 + 2H2O при увеличении концентрации исходных веществ в 3 раза повышается в А) 6 раз Б) 9 раз В) 18 раз Г) 27 раз
10. Единица измерения скорости гомогенной реакции
А) л/моль Б) г/моль В) моль/с Г) моль/л∙с
В-1. Установите соответствие между формулой соли и её способностью подвергаться гидролизу:
1) Al2S3A) по катиону
2) K2SO3 Б) по аниону
3) CrCl3 В) по катиону и аниону
4) K2SO4 Г) гидролизу не подвергается
5) KF
В-2. Установите соответствие между названиями соли и средой её водного раствора:
название соли среда
-
хлорид натрия А) кислая
-
фосфат калия Б) нейтральная
-
нитрат цинка В) щелочная
-
сульфат цезия
-
силикат лития
-
хлорид магния
В-3. Электролизом раствора можно получить металл
-
медь
-
калий
-
цинк
-
натрий
-
серебро
Уровень C
V2O5
1. а) Дайте характеристику реакции: 2 SO2 + О2 ↔ 2SO3+Q .
б) В какую сторону сместится химическое равновесие этой реакции при:
А) понижении температуры Б) повышении давления В) увеличении концентрации кислорода
в) Определите скорость реакции при 500С, если при 300С скорость реакции 0,2 моль/л∙с,
а температурный коэффициент равен 3.
2. Напишите схемы анодного и катодного процесса и суммарное уравнение электролиза водного раствора сульфата меди (II). Определите массу вещества, выделившегося на аноде (выход 75%) при электролизе раствора, содержащего 80г сульфата меди (II).
3. Расставьте коэффициенты со схемой электронного баланса P + HNO3 + H2O→ NO + H3PO4
Вариант 2 Уровень А
1.Если вещество тугоплавко и не проводит электрический ток, то в узлах его кристаллической решётки находятся А) атомы неметаллов Б) катионы В) молекулы Г) атомы металлов
2. Ионная связь в молекулах веществ группы А) НCl, Cl2 Б) Cl2, NH3 В) CaCl2, NaBr Г) NH3, SiO2
3. Окислительно- восстановительной не является реакция взаимодействия воды с
А) гидридом калия Б) натрием В) углекислым газом Г) хлором
4. Наиболее выраженными неметаллическими свойствами обладает элемент VI группы
А) сера Б) кислород В) селен Г) теллур
5.Элементы IV группы образуют высшие оксиды с общей формулой А) ЭО3 Б) Э2О3 В) Э2О5 Г) ЭО2 .
6. Степень окисления азота наибольшая в соединении А) NО2 Б) НNO3 В) N2 O Г) NО
7.Анион Э 2- некоторого элемента имеет электронную конфигурацию Is22s22p6. Число протонов в ядре атома данного элемента А) 10 Б) 13 В) 6 Г) 8
8.Ядро атома изотопа 79Se содержит А) 79 протонов и 34 нейтрона Б) 34 протона и 45 нейтронов
В) 34 протона и 44 электрона; Г) 34 протона и 79 нейтронов
9. Скорость химической реакции 2CO + O2 = 2CO2 при увеличении концентрации угарного газа в 4 раза повышается в А) 16 раз Б) 4 раза В) 64 раза Г) 8 раз
10. Формула определения скорости гомогенной реакции
А) V= C∙t Б) V= t2-t1/C2-C1 В)V= − C2-C1 /t2-t1 Г) V= C2-C1
В-1. Установите соответствие между формулой соли и её способностью подвергаться гидролизу:
1) Al2(SO4)3A) по катиону
2) K2SO4 Б) по аниону
3) CaCl2 В) по катиону и аниону
4) K2S Г) гидролизу не подвергается
5) (NH4)2CO3
В-2. Установите соответствие между названиями соли и средой её водного раствора:
название соли среда
-
карбонат натрия А) кислая
-
фторид калия Б) нейтральная
-
нитрат алюминия В) щелочная
-
сульфит лития
-
хлорид бария
-
сульфат цинка
В-3. Электролизом раствора нельзя получить металл
-
медь
-
калий
-
золото
-
натрий
-
алюминий
Уровень C
1. а) Дайте характеристику реакции: 2 CO+ О2 ↔ 2CO2 + Q
б) В какую сторону сместится химическое равновесие этой реакции при:
А) повышении температуры Б) повышении давления В) уменьшении концентрации углекислого аза
в) Определите скорость реакции при 200С, если при 500С скорость реакции 0,8 моль/л∙с,
а температурный коэффициент равен 2.
2. Напишите схемы анодного и катодного процесса и суммарное уравнение электролиза водного раствора хлорида калия. Определите массу вещества, выделившегося на катоде (выход 50%) при электролизе раствора, содержащего 29,8г хлорида калия.
3. Расставьте коэффициенты со схемой электронного баланса CuO + NH3 → N2 + Cu + H2O
Вариант 3 Уровень А
1. Если вещество твёрдое, электро- и теплопроводное, ковкое, то в узлах его кристаллической решётки находятся А) атомы неметаллов Б) анионы В) молекулы Г) атомы и катионы металлов
2. Ковалентная неполярная связь в молекулах веществ группы
А) НCl, Cl2 Б) Cl2, N2 В) CaCl2, NaBr Г) NH3, SiO2
3. Окислительно- восстановительной является реакция взаимодействия соляной кислоты с
А) оксидом цинка Б) гидроксидом натрия В) карбонатом калия Г) магнием
4. Наиболее выраженными неметаллическими свойствами обладает элемент 4-го периода
А) калий Б) бром В) мышьяк Г) германий
5.Элементы VII группы образуют летучее водородное соединение с общей формулой
А) ЭН3 Б) ЭН2 В) ЭНГ) ЭН4
6. Степень окисления марганца наименьшая в соединении
А) МпО Б) MnO2 В) К2 MnO4 Г) Са(МпО4)2
7. Катион Э2+ некоторого элемента имеет электронную конфигурацию Is22s22p6. Число протонов в ядре атома данного элемента А) 12 Б) 13 В) 16 Г) 17
8. Ядро атома изотопа 73Ge содержит А) 73 протона и 73 нейтрона Б) 32 протона и 41 нейтрон В) 32 протона и 41 электрон Г) 32 протона и 32 нейтрона
9. Скорость химической реакции N2 +3H2 = 2NH3 при увеличении концентрации исходных веществ в 3 раза повышается в А) 6 раз Б) 9 раз В) 81 раз Г) 27 раз
10. Формула скорости гетерогенной реакции
А) V= C∙t Б) V= t2-t1/C2-C1 В)V= − C2-C1 /t2-t1 Г) V=Δν/S Δ t
В-1. Установите соответствие между формулой соли и её способностью подвергаться гидролизу:
1) AlСl3 A) по катиону
2) K2S Б) по аниону
3) CаCl2 В) по катиону и аниону
4) FeSO4 Г) гидролизу не подвергается
5) KNO3
В-2. Установите соответствие между названиями соли и средой её водного раствора:
название соли среда рН
-
силикат натрия А) кислая
-
нитрат серебра Б) нейтральная
-
хлорид бария В) щелочная
-
сульфат kbnbz
-
сульфит калия
-
хлорид аммония
В-3. Электролизом раствора и расплава можно получить металл
-
медь
-
калий
-
литий
-
ртуть
-
серебро
Уровень C
1.а) Дайте характеристику реакции: H2 + Cl2 ↔ 2 HCl + Q
б) В какую сторону сместится химическое равновесие этой реакции при:
А) повышении температуры Б) повышении давления В) уменьшении концентрации хлороводорода.
в) Определите скорость реакции при 200С, если при 00С скорость реакции 0,4 моль/л∙с, а температурный коэффициент равен 3.
2. Написать схемы анодного и катодного процесса и суммарное уравнение электролиза водного раствора нитрата меди (II). Определите массу вещества, выделившегося на аноде (выход 75%) при электролизе раствора, содержащего 37,6г нитрата меди (II).
3. Расставьте коэффициенты со схемой электронного баланса С + HNO3 → СO2 + NO+ H2O
Вариант 4 Уровень А
1.Если вещество тугоплавко и проводит электрический ток в расплаве и растворе, то в узлах его кристаллической решётки находятся
А) атомы неметаллов Б) катионы В) молекулы Г) атомы металлов
2. Ковалентная полярная и ионная связь соответственно в молекулах веществ группы
А) НCl, Cl2 Б) Cl2, NH3 В) CaCl2, НBr Г) NH3, SiO2
3. Окислительно- восстановительными не могут быть реакции
А) обмена Б) замещения В) соединения Г) разложения
4. Наиболее выраженными металлическими свойствами обладает элемент I-ой группы
А) калий Б) натрий В) литий Г) цезий
5.Элементы V группы образуют летучие водородные соединения с общей формулой
А) ЭН3 Б) ЭН2 В) ЭО Г) ЭН4 .
6. Степень окисления серы наименьшая в соединении А) SО2 Б) Н2SO3 В) Al2 (SO4)3 Г) Na2S
7.Анион Э3- некоторого элемента имеет электронную конфигурацию Is22s22p6. Число протонов в ядре атома данного элемента А) 10 Б) 13 В) 7 Г) 8
8.Ядро атома изотопа 81Br содержит А) 81 протон и 81 нейтрон Б) 35 протонов и 46 электронов
В) 35 протонов и 35 нейтронов Г) 35 протонов и 46 нейтронов
9. Скорость химической реакции 2NO + O2 = 2NO2 при увеличении давления в 4 раза повышается в
А) 16 раз Б) 4 раза В) 64 раза Г) 8 раз
10. Вещества, замедляющие химические реакции
А) ингибиторы Б) катализаторы В)инициаторы Г) активаторы
В-1. Установите соответствие между формулой соли и её способностью подвергаться гидролизу:
1) CaBr2A) по катиону
2) K2SO3 Б) по аниону
3) Cr2S3 В) по катиону и аниону
4) Li2S Г) гидролизу не подвергается
5) (NH4)2SO4
В-2. Установите соответствие между названиями соли и средой её водного раствора:
название соли среда
-
карбонат алюминия А) кислая
-
силикат калия Б) нейтральная
-
нитрат железа (II) В) щелочная
-
сульфид лития
-
хлорид калия
-
сульфат магния
В-3. Только электролизом расплава можно получить металл
-
серебро
-
ртуть
-
кальций
-
натрий
-
алюминий
Уровень C
-
а) Дать характеристику реакции: 2NO + O2
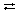 2NO2 + Q
2NO2 + Q
б) В какую сторону сместится химическое равновесие этой реакции при:
А) понижении температуры Б) понижении давления В) увеличении концентрации бурого газа.
в) Определить скорость реакции при 100С, если при 300С скорость реакции 0,81моль/л∙с,
а температурный коэффициент равен 3.
3. 3. Написать схемы анодного и катодного процесса и суммарное уравнение электролиза водного раствора бромида натрия. Определите массу вещества, выделившегося на катоде (выход 80%) при электролизе раствора, содержащего 41,2г бромида натрия.
3. Расставьте коэффициенты со схемой электронного баланса Н2S + Br2 + H2O → H2SO4 + HBr